Ikatan kovalen bukan -polar
- 1109
- 167
- Clarence Greenholt DDS
Kami menerangkan apa ikatan kovalen bukan -polar, ciri -cirinya dan beberapa contoh
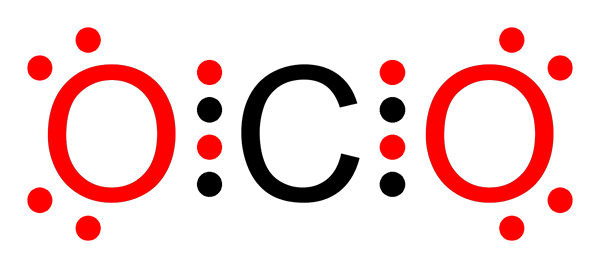
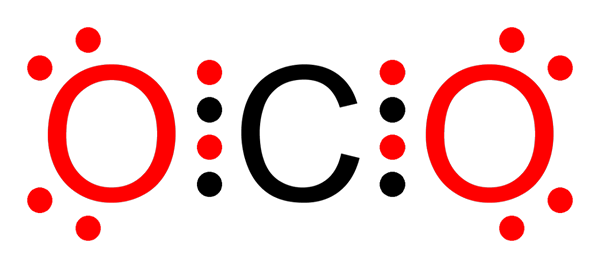 Ikatan kovalen karbon dioksida yang tidak kovalen
Ikatan kovalen karbon dioksida yang tidak kovalen Apakah ikatan kovalen bukan -polar?
A ikatan kovalen bukan -polar, Juga dipanggil ikatan kovalen tulen atau apolar, ia adalah kesatuan dua atom yang berkongsi satu atau lebih pasangan elektron sama. Dalam kata lain.
Jenis pautan ini adalah antara dua atom yang sama (elemen yang sama) atau antara dua atom yang berbeza, tetapi yang mempunyai elektronegativiti yang sangat serupa.
Terdapat tiga jenis pautan kimia yang menjaga atom bersama antara satu sama lain. Ini adalah: ikatan ionik, ikatan kovalen dan pautan logam. Pautan ini berbeza mengikut bagaimana elektron diedarkan di sekitar atom.
Dalam kes ikatan kovalen, kedua -dua atom berkongsi elektron valensi, yang bermaksud bahawa elektron -elektron ini, bukannya berputar di sekitar atom, berputar di sekitar kedua -dua. Walau bagaimanapun, ini tidak selalunya sama, kerana elektron lebih suka menghabiskan lebih banyak masa berhampiran atom elektronegatif yang paling banyak, yang menimbulkan ikatan kovalen kutub.
Sekiranya berlaku ikatan kovalen bukan -polar ini tidak berlaku, kerana kedua -dua atom mempunyai elektronegativiti yang sama atau elektronegativiti yang sangat serupa.
Ciri -ciri pautan kovalen bukan -polar
1. Ia terbentuk di antara atom dengan elektronegativiti yang sama atau sangat serupa
Mereka adalah pautan kovalen yang membentuk antara atom yang sama atau yang mempunyai elektronegativiti yang sangat serupa. Secara umum, ikatan kovalen dianggap tidak kutub jika perbezaan elektronegativiti kurang daripada atau sama dengan 0.4.
Boleh melayani anda: asid succinic: struktur, sifat, mendapatkan, menggunakan2. Mereka boleh menjadi mudah, berganda atau tiga
Bergantung pada bilangan pasang elektron yang kedua -dua atom berkongsi, ikatan kovalen bukan -pololar atau apolar boleh mudah, berganda atau tiga.
Apabila ikatan dibentuk oleh sepasang elektron, ia dipanggil pautan mudah, apabila dua pasangan elektron dikongsi, ia dipanggil ikatan ganda, dan jika tiga pasangan elektron dikongsi, ia dipanggil triple link.
3. Mereka hampir selalu melibatkan bukan logam
Logam adalah elemen dengan elektronegativiti yang sangat rendah yang membentuk pautan logam antara satu sama lain. Apabila dikaitkan dengan bukan logam, mereka selalu membentuk sama ada ikatan ionik atau pautan kutub. Atas sebab ini, ikatan kovalen bukan -polar hanya terbentuk antara unsur -unsur bukan logam seperti hidrogen dan karbon.
4. Mereka menimbulkan sebatian apolar
Sebatian yang hanya mempunyai ikatan kovalen non -polar akan dibentuk oleh molekul apolar. Jenis -jenis sebatian ini dicirikan dengan mempunyai titik mendidih dan gabungan yang rendah berbanding dengan logam dan sebatian ionik (ada juga gas pada suhu bilik), mereka tidak larut dalam air dan konduktor haba dan elektrik yang buruk.
5. Mereka boleh membentuk sebatian pepejal, cecair atau gas pada suhu bilik
Sebat.
Oleh kerana itu, sesetengahnya adalah gas pada suhu bilik (seperti hidrogen, h2, dan nitrogen, n2), yang lain adalah cecair (seperti Bromo, BR2), sementara yang lain pepejal (seperti naphthalene, c10H8).
6. Mereka mempunyai tenaga pautan yang agak rendah.
Berbanding dengan pautan ionik, ikatan kovalen bukan -polar lebih mudah dipecahkan, kerana mereka mempunyai tenaga pautan yang lebih rendah. Ini bermaksud bahawa anda perlu menggunakan tenaga yang kurang untuk memecahkan ikatan kovalen bukan -polar daripada ikatan ionik.
Boleh melayani anda: Undang -undang stoikiometriContoh pautan kovalen non -polar
Pautan H-H dalam molekul hidrogen (h2)
Dalam molekul hidrogen, h2, Dua atom hidrogen berkongsi satu -satunya elektron valensi untuk membentuk ikatan kovalen yang mudah.
 Molekul hidrogen
Molekul hidrogen Oleh kerana kedua -dua atom adalah sama, perbezaan dalam elektronegativiti antara kedua.
Pautan F-F dalam molekul fluorin (F2)
Contoh ini menyoroti fakta bahawa tidak kira elektronegativiti atom, tetapi perbezaan elektronegativiti kedua -dua atom yang membentuk pautan untuk mengetahui jika pautan itu akan kovalen bukan kutub atau tidak.
 Molekul fluorin
Molekul fluorin Fluorin adalah elemen elektronegatif yang paling banyak dalam jadual berkala, jadi ia cenderung untuk mengeluarkan elektronnya dari unsur -unsur lain untuk membentuk ikatan kutub atau ionik.
Walau bagaimanapun, apabila atom fluorida dikaitkan dengan yang lain sama dengannya, tidak boleh mengeluarkan elektron dari yang lain (tidak ada perbezaan dalam elektronegativiti), sehingga mereka tidak mempunyai pilihan tetapi untuk membagikannya dengan adil dan bentuk, dengan itu, dengan demikian, a Pautan kovalen bukan -polar.
O-O pautan dalam molekul ozon (atau3)
Seperti dalam kes molekul fluorin, oksigen juga merupakan elemen yang sangat elektronegatif. Walau bagaimanapun, dengan membentuk pautan dengan atom oksigen lain, ia membentuk ikatan kovalen bukan -polar. Demikianlah kes molekul ozon.
 Molekul ozon
Molekul ozon Dalam kes ini, atom oksigen pusat dikaitkan dengan dua atom oksigen lain dengan cara ikatan kovalen non -polar atau apolar.
Boleh melayani anda: magnesium oksida: struktur, sifat, tatanama, kegunaanPautan N-N dalam molekul nitrogen (n2)
Molekul nitrogen mengandungi ikatan kovalen bukan -polar, di mana setiap atom nitrogen berkongsi tiga elektron valensi hilang dengan yang lain.
 Molekul nitrogen
Molekul nitrogen Atas sebab ini, kedua -dua atom berkongsi sejumlah tiga pasang elektron, sehingga membentuk ikatan kovalen tiga.
Pautan C-H dalam molekul metana (CH4)
Metana adalah contoh ikatan kovalen bukan -polar yang terbentuk di antara atom unsur -unsur yang berbeza, dalam kes ini, karbon dan hidrogen.
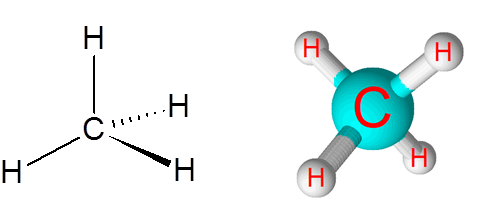 Molekul metana
Molekul metana Perbezaan elektronegativiti antara kedua -dua elemen adalah 0.4 yang meletakkan sempadan ini hanya antara ikatan bukan -polar dan kutub.
Pautan c = c dalam molekul etilena (c2H4)
Molekul etilena, juga dipanggil eteno, mempunyai lima pautan. Empat pautan C-H dan ikatan berganda c = c. Dalam kedua -dua kes, pautan itu sesuai dengan ikatan kovalen bukan -pololar atau apolar.
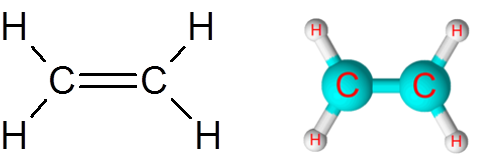 Molekul etilena
Molekul etilena
- « 6 Tarian dan Tarian Tipikal Quintana Roo Lebih Terkenal
- Tarian 9 dan tarian khas Michoacán lebih terkenal »

