Ciri -ciri pautan ionik, bagaimana bentuk dan contoh

- 1401
- 369
- Erick Krajcik
Dia pautan ionik Ia adalah jenis ikatan kimia di mana terdapat tarikan elektrostatik antara ion dengan beban bertentangan. Iaitu, ion yang dimuatkan secara positif membentuk pautan dengan ion yang dimuat secara negatif, memindahkan elektron dari satu atom ke yang lain.
Jenis ikatan kimia ini berlaku apabila elektron valensi satu atom dipindahkan ke yang lain. Atom yang kehilangan elektron menjadi kation (dimuatkan secara positif), dan orang yang memperoleh elektron menjadi anion (dimuatkan secara negatif).
 Contoh ikatan ionik: Natrium fluorida. Natrium kehilangan elektron Valencia dan memberikannya ke fluorida. WDCF [cc by-s (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Contoh ikatan ionik: Natrium fluorida. Natrium kehilangan elektron Valencia dan memberikannya ke fluorida. WDCF [cc by-s (https: // creativeCommons.Org/lesen/by-sa/3.0)] [TOC]
Konsep pautan ionik
Ikatan ionik adalah dengan yang mana zarah -zarah yang dikenakan elektrik, dipanggil ion, berinteraksi untuk menimbulkan pepejal dan cecair ionik. Pautan ini adalah hasil interaksi elektrostatik antara ratusan juta ion, dan tidak terhad hanya kepada beberapa daripada mereka; iaitu, ia melampaui daya tarikan antara beban positif ke arah beban negatif.
Pertimbangkan sebagai contoh natrium klorida kompaun ionik, NaCl, yang paling dikenali sebagai garam meja. Di NaCl, ikatan ionik mendominasi, jadi ia terdiri daripada ion Na+ dan Cl-. Na+ Ia adalah ion positif atau kation, sementara cl- (Klorida) adalah ion negatif atau anion.
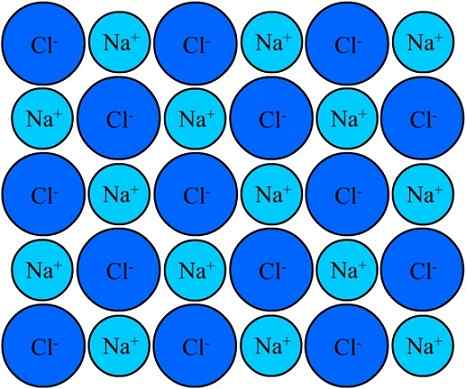 Na+ dan cl-ion dalam natrium klorida kekal bersatu terima kasih kepada ikatan ionik. Sumber: Eyal Bairey melalui Wikipedia.
Na+ dan cl-ion dalam natrium klorida kekal bersatu terima kasih kepada ikatan ionik. Sumber: Eyal Bairey melalui Wikipedia. Kedua -dua Na+ Seperti Cl- Mereka tertarik untuk bertentangan dengan beban elektrik. Jarak antara ion ini membolehkan orang lain mendekati, sehingga pasangan dan pasangan NaCl muncul. Na kation+ Mereka akan menangkis satu sama lain kerana mempunyai beban yang sama, dan yang sama berlaku antara satu sama lain dengan anion cl-.
Ada masa ketika berjuta -juta ion+ dan Cl- Mereka berjaya menyatukan, bersatu padu, berasal dari struktur yang stabil; Yang ditadbir oleh pautan ionik (imej unggul). Na kation+ Mereka lebih kecil daripada cl anion- Kerana daya nuklear yang semakin meningkat nukleusnya pada elektron luaran.
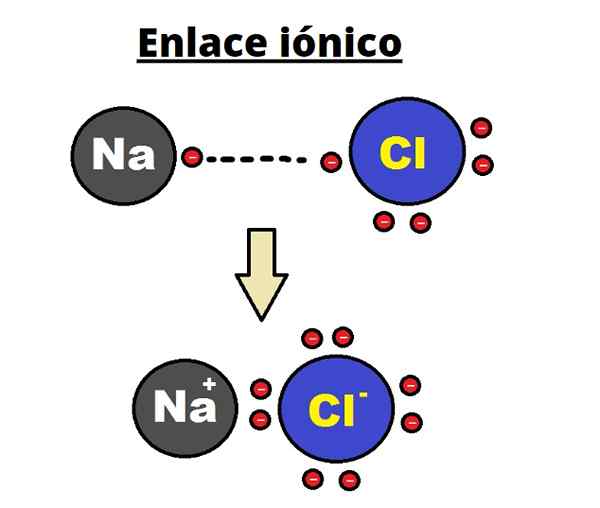 Pautan ionik NaCl. Rhannosh/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/3.0)
Pautan ionik NaCl. Rhannosh/cc by-sa (https: // creativeCommons.Org/lesen/by-sa/3.0) Ikatan ionik dicirikan dengan menubuhkan struktur yang diperintahkan di mana jarak antara ion (na+ dan Cl- Dalam kes NaCl) ia kecil berbanding dengan pepejal lain. Terdapat perbincangan mengenai struktur kristal ionik.
Bagaimana pautan ionik?
Ikatan ionik hanya berlaku jika pengedaran elektron berlaku supaya beban ion timbul. Pautan jenis ini tidak pernah berlaku di antara zarah neutral. Semestinya ada kation dan anion. Tetapi dari mana asalnya?
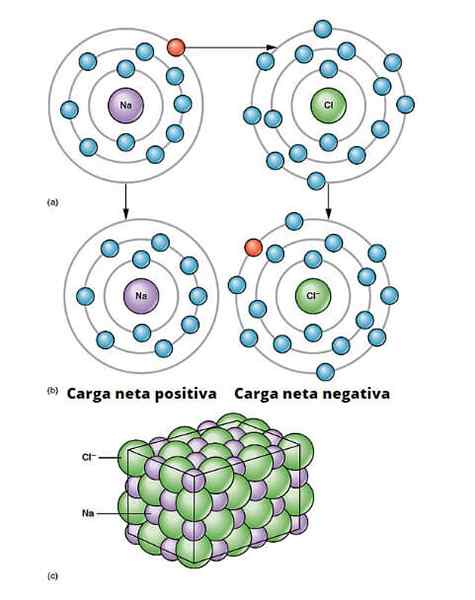 Ilustrasi pautan ionik. a) natrium mempunyai beban bersih negatif. b) Natrium memberikan elektron kepada klorin. Natrium adalah dengan beban bersih positif dan klorin dengan beban bersih negatif, menghasilkan ikatan ionik. Jenis hubungan antara berjuta -juta atom Na dan Cl menimbulkan garam fizikal. Openx College/CC oleh (https: // creativeCommons.Org/lesen/oleh/3.0)
Ilustrasi pautan ionik. a) natrium mempunyai beban bersih negatif. b) Natrium memberikan elektron kepada klorin. Natrium adalah dengan beban bersih positif dan klorin dengan beban bersih negatif, menghasilkan ikatan ionik. Jenis hubungan antara berjuta -juta atom Na dan Cl menimbulkan garam fizikal. Openx College/CC oleh (https: // creativeCommons.Org/lesen/oleh/3.0) Terdapat banyak cara yang berasal dari ion, tetapi pada dasarnya banyak berdasarkan reaksi pengurangan pengoksidaan. Sebilangan besar sebatian ionik bukan organik terdiri daripada elemen logam dengan elemen bukan logam (yang blok p dari jadual berkala).
Logam mesti mengoksida, kehilangan elektron, untuk berubah menjadi kation. Sebaliknya, elemen bukan logam dikurangkan, memperoleh elektron ini, dan menjadi anion. Imej berikut menggambarkan perkara ini untuk pembentukan NaCl dari natrium dan atom klorin:
Boleh melayani anda: asid arsenik (H3SO4): sifat, risiko dan kegunaan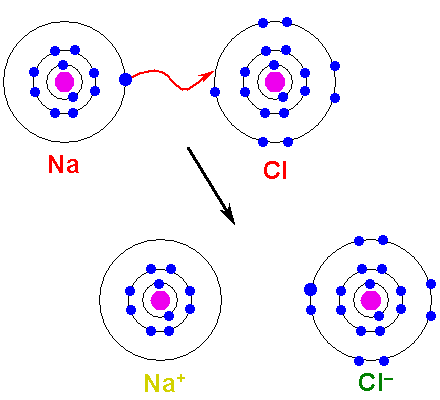 Pembentukan pautan ionik. Sumber: Shafei di Arab Wikipedia / Domain Awam
Pembentukan pautan ionik. Sumber: Shafei di Arab Wikipedia / Domain Awam Atom NA mendermakan salah satu elektron Valencia ke CL. Apabila pengagihan elektron ini berlaku, ion Na terbentuk+ dan Cl-, yang mula menarik segera dan elektrostatik.
Oleh itu dikatakan bahawa na+ dan Cl- Mereka tidak berkongsi sepasang elektron, tidak seperti apa yang boleh dijangkakan untuk ikatan kovalen Na-CL hipotetikal.
Sifat pautan ionik
Ikatan ionik tidak beralasan, iaitu, kekuatannya tidak ada dalam satu arah, tetapi disebarkan oleh ruang berdasarkan jarak yang memisahkan ion. Fakta ini penting, kerana ini bermaksud bahawa ion sangat bersatu, yang menerangkan beberapa sifat fizikal pepejal ionik.
Takat lebur
Ikatan ionik bertanggungjawab untuk garam ke suhu 801 ºC. Suhu ini jauh tinggi berbanding dengan titik gabungan beberapa logam.
Ini kerana NaCl mesti menyerap haba yang cukup supaya ionnya mula mengalir dengan bebas di luar kristal mereka; iaitu, tarikan antara NA mesti diatasi+ dan Cl-.
Takat didih
Titik gabungan dan mendidih sebatian ionik adalah produk yang sangat tinggi dari interaksi elektrostatik mereka yang kuat: ikatan ionik mereka. Walau bagaimanapun, kerana pautan ini melibatkan banyak ion, tingkah laku ini biasanya diberikan kepada kuasa intermolecular, dan tidak betul kepada ikatan ionik.
Dalam kes garam, apabila NaCl telah dicairkan, cecair yang terdiri daripada ion awal yang sama diperolehi; Hanya sekarang mereka bergerak dengan kebebasan yang lebih besar. Pautan ionik masih ada. Ion na+ dan Cl- Mereka bertemu di permukaan cecair untuk menghasilkan ketegangan permukaan yang hebat, yang menghalang ion dari melarikan diri dari fasa gas.
Oleh itu, garam lebur mesti meningkatkan suhu sehingga mendidih. Titik mendidih NaCl ialah 1465 ºC. Pada suhu ini, haba melebihi tarikan antara NA+ dan Cl- Dalam cecair, jadi wap NaCl mula terbentuk dengan tekanan yang sama dengan atmosfera.
Elektronegativiti
Sebelum ini dikatakan bahawa ikatan ionik terbentuk di antara elemen logam dan elemen bukan logam. Ringkas akaun: antara logam dan bukan logam. Biasanya ini adalah dari segi sebatian ionik bukan organik; Di atas semua, jenis binari, seperti NaCl.
Untuk pengedaran elektron (NA+Cl-) dan bukan perkongsian (NA-CL), mesti ada perbezaan elektronegativiti yang besar antara kedua-dua atom. Jika tidak, tidak akan ada hubungan ionik di antara mereka dua. Mungkin pendekatan NA dan CL, berinteraksi, tetapi dengan serta -merta CL, untuk elektronegativiti yang lebih besar, "merampas" elektron ke NA.
Walau bagaimanapun, senario ini hanya digunakan untuk sebatian binari, MX, seperti NaCl. Untuk garam atau sebatian ionik yang lain, proses latihan mereka lebih rumit dan tidak dapat ditangani dari perspektif atom atau molekul yang semata -mata.
Ia boleh melayani anda: AlquinosLelaki
Tidak ada jenis ikatan ionik yang berlainan, kerana fenomena elektrostatik adalah semata -mata fizikal, hanya mengubah cara di mana ion berinteraksi, atau bilangan atom yang mereka miliki; iaitu, jika mereka adalah ion monoatomik atau poliiatom. Juga, setiap elemen atau sebatian menyebabkan ion ciri yang mentakrifkan sifat kompaun.
Di bahagian Contoh, titik ini akan diperkuat, dan akan dilihat bahawa pautan ionik adalah sama pada dasarnya dalam semua sebatian. Apabila ini tidak dipenuhi, dikatakan bahawa ikatan ionik mempunyai watak kovalen tertentu, yang merupakan kes banyak logam peralihan, di mana anion diselaraskan dengan kation; Contohnya, FECL3 (Iman3+-Cl-).
Contoh pautan ionik
Beberapa sebatian ionik akan disenaraikan di bawah, dan ion dan perkadaran mereka akan diserlahkan:
- Magnesium klorida
Mgcl2, (Mg2+Cl-), Dalam perkadaran 1: 2 (mg2+: 2 cl-)
- Potassium fluoride
Kf, (k+F-), Dalam perkadaran 1: 1 (k+: F-)
- Natrium sulfida
Na2S, (na+S2-), Dalam perkadaran 2: 1 (ke -2+: S2-)
- Lito hidroksida
Lioh, (li+Oh-), Dalam perkadaran 1: 1 (li+: Oh-)
- Kalsium fluorida
Caf2, (AC2+F-), Dalam perkadaran 1: 2 (ca2+: 2f-)
- Natrium karbonat
Na2Co3, (NA+Co32-), Dalam perkadaran 2: 1 (ke -2+: Co32-)
- Kalsium karbonat
Pencuri3, (AC2+Co32-), Dalam perkadaran 1: 1 (ca2+: Co32-)
- Potassium permanganat
Kmno4, (K+Mne4-), Dalam perkadaran 1: 1 (k+: Mn4-)
- Tembaga sulfat
Cuso4, (Cu2+SW42-), Dalam perkadaran 1: 1 (CU2+: Jadi42-)
- Barium hidroksida
BA (oh)2, (BA2+Oh-), Dalam perkadaran 1: 2 (BA2+: Oh-)
- Aluminium bromida
Alb3, (Kepada3+Br-), dalam perkadaran 1: 3 (ke3+: 3br-)
- Oksida besi (iii)
Iman2Sama ada3, (Iman3+Sama ada2-), Dalam perkadaran 2: 3 (2fe3+: 32-)
- Strontium oksida
Sro, (SR2+Sama ada2-), Dalam perkadaran 1: 1 (SR2+: Sama ada2-)
- Silver Chloride
AGCL, (AG+Cl-), Dalam perkadaran 1: 1 (AG+: Cl-)
- Yang lain
-Ch3Cona, (pilih3COO-Na+), Dalam perkadaran 1: 1 (CHO3COO-: Na+)
- NH4Saya, (NH4+Yo-), Dalam perkadaran 1: 1 (NH4+: Yo-)
Setiap sebatian ini membentangkan ikatan ionik di mana berjuta -juta ion, sepadan dengan formula kimia mereka, tertarik secara elektrostatik dan berasal dari pepejal. Semakin besar magnitud beban ioniknya, semakin kuat tarikan dan penolakan elektrostatik akan.
Oleh itu, ikatan ionik cenderung lebih kuat semakin besar tuduhan ion yang membentuk sebatian.
Boleh melayani anda: alkenesLatihan yang diselesaikan
Beberapa latihan yang meletakkan pengetahuan asas mengenai pautan ionik akan diselesaikan di bawah.
- Latihan 1
Antara sebatian berikut yang manakah ionik? Pilihannya ialah: HF, H2Atau, nah, h2S, nh3 dan mgo.
Sebatian ionik mesti mempunyai ikatan ionik mengikut definisi. Semakin besar perbezaan elektronegativiti di antara unsur -unsur komponennya, semakin besar watak ionik pautan tersebut.
Oleh itu, pilihan yang tidak mempunyai elemen logam dibuang pada prinsip: HF, H2Atau, h2S dan NH3. Semua sebatian ini dibentuk hanya oleh elemen bukan logam. Kation nh4+ Ini adalah pengecualian untuk peraturan ini, kerana ia tidak mempunyai logam.
Pilihan selebihnya adalah NAH dan MGO, yang masing -masing mempunyai logam NA dan MG, bersatu dengan unsur -unsur bukan logam. Nah (na+H-) dan mgo (mg2+Sama ada2-) Mereka adalah sebatian ionik.
- Latihan 2
Pertimbangkan sebatian hipotesis berikut: AG (NH4)2Co3Yo. Apakah ion anda dan dalam perkadaran apa dalam pepejal?
Mengurangkan sebatian pada ion mereka yang kita ada: AG+, NH4+, Co32- dan saya-. Ini disambungkan secara elektrostatik berikutan perkadaran 1: 2: 1: 1 (AG+: 2nh4+: Co32-: Yo-). Bermaksud bahawa jumlah kation NH4+ Ia dua kali ganda untuk ion ag+, Co32- dan saya-.
- Latihan 3
Antara sebatian berikut yang manakah dijangka pada dasarnya bahawa pautan ionik terkuat? Pilihannya ialah: KBR, CAS, NA2SW4, Cuo, Alpo4 dan pb3P4.
KBr terdiri daripada k ion+ dan br-, Dengan magnitud beban. Kemudian, Cas mempunyai ion CA2+ dan s2-, Dengan beban magnitud berganda, jadi boleh dianggap bahawa pautan ionik di CAS lebih kuat daripada di KBr; Dan juga lebih kuat daripada di NA2SW4, kerana yang terakhir terdiri daripada ion na+ Dan juga42-.
Kedua -dua CAS dan CUO mungkin mempunyai pautan ionik yang sama kuat, kerana kedua -duanya mengandungi ion dengan beban magnitud berganda. Kemudian kami mempunyai ALPO4, dengan ion al3+ dan po43-. Ion ini mempunyai beban magnitud tiga, jadi pautan ionik di ALPO4 Ia harus lebih kuat daripada semua pilihan di atas.
Dan akhirnya, kami mempunyai pemenang PB3P4, Nah, jika kita mengandaikan bahawa ia dibentuk oleh ion, mereka menjadi PB4+ Dan p3-. Beban mereka mempunyai magnitud terbesar; Dan oleh itu, PB3P4 Ia adalah sebatian yang mungkin mempunyai ikatan ionik terkuat.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Ikatan ion. Diperoleh dari: dalam.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (11 Februari 2020). Ionic vs Covalent Bonds - memahami perbezaannya. Pulih dari: Thoughtco.com
- Editor enyclopaedia Britannica. (31 Januari 2020). Ikatan ion. Encyclopædia Britannica. Pulih dari: Britannica.com
- Kamus Chemicool. (2017). Definisi ikatan ionik. Pulih dari: chemicool.com
- « Ciri keseimbangan granrataria, bahagian dan cara menggunakannya
- Rutherford Sejarah Model Atom, Eksperimen, Postulates »

