Pautan pi
- 1969
- 73
- Delbert Dare
Kami menerangkan pautan Pi, bagaimana ciri -cirinya terbentuk, dan kami memberikan beberapa contoh
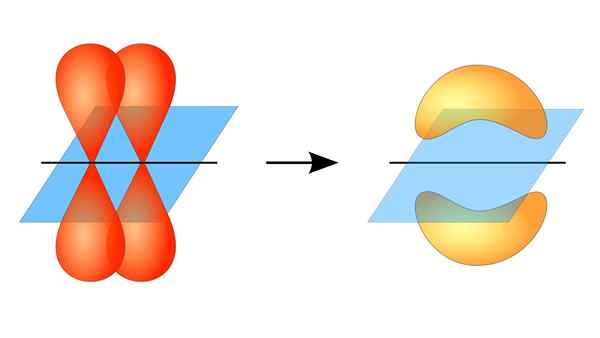
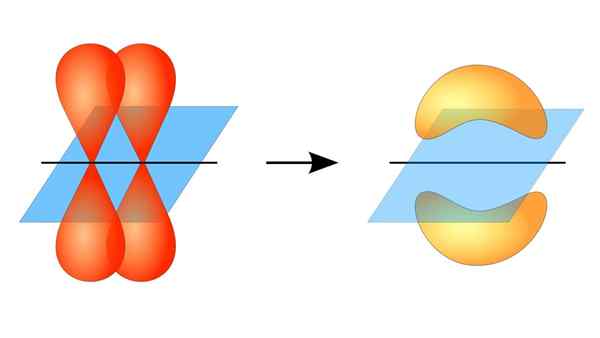 Dua orbital p membentuk pautan π
Dua orbital p membentuk pautan π Apa itu pautan pi?
A Pautan pi (π) Ia adalah jenis pautan kovalen yang dicirikan dengan menghalang pergerakan putaran bebas atom dan berasal di antara sepasang orbital atom tulen, antara keanehan lain. Terdapat pautan yang boleh dibentuk di antara atom oleh elektron mereka, yang membolehkan mereka membina struktur yang lebih besar dan lebih kompleks: molekul.
Pautan ini boleh menjadi pelbagai jenis, tetapi yang paling biasa dalam bidang pengajian ini adalah kovalen. Bon kovalen, juga dipanggil molekul, adalah sejenis pautan di mana atom -atom yang melibatkan pasangan elektron saham.
Ini boleh berlaku kerana keperluan atom mencari kestabilan, sehingga membentuk kebanyakan sebatian yang diketahui. Dalam pengertian ini, ikatan kovalen boleh menjadi mudah, berganda atau tiga, bergantung kepada konfigurasi orbital mereka dan jumlah pasangan elektron yang dikongsi antara atom yang terlibat.
Inilah sebabnya terdapat dua jenis ikatan kovalen yang terbentuk di antara atom berdasarkan orientasi orbital mereka: pautan sigma (σ) dan pautan pi (π) (π).
Adalah penting untuk membezakan kedua -dua pautan, kerana pautan sigma dibentangkan dalam kesatuan mudah dan PI dalam pelbagai kesatuan antara atom (dua atau lebih elektron dikongsi).
Bagaimana bentuk pautan pi?
Untuk menggambarkan pembentukan pautan PI, ia harus dibincangkan terlebih dahulu mengenai proses hibridisasi, kerana ia campur tangan dalam beberapa pautan penting.
Hibridisasi adalah proses di mana orbital elektronik hibrid terbentuk; iaitu, di mana orbital sub -peringkat atom s dan p boleh dicampur. Ini menyebabkan pembentukan SP, orbital SP2 dan sp3, yang dipanggil kacukan.
Boleh melayani anda: Reaksi boleh diterbalikkan: Ciri dan contohDalam pengertian ini, pembentukan pautan Pi berlaku berkat pertindihan beberapa lobus yang dimiliki oleh orbital atom pada pasangan lain yang ada di orbital yang merupakan sebahagian daripada atom lain.
Pertindihan orbital ini berlaku pada masa yang sama, jadi pengedaran elektronik tertumpu kebanyakannya di atas dan di bawah satah yang membentuk nukleus atom yang dikaitkan, dan menyebabkan ikatan Pi menjadi lebih lemah daripada ikatan sigma.
Apabila bercakap mengenai simetri orbital jenis kesatuan ini, harus disebutkan bahawa ia adalah sama dengan jenis orbital P selagi ia diperhatikan melalui paksi yang dibentuk oleh pautan. Di samping itu, kesatuan ini kebanyakannya dibentuk oleh orbital p.
Pembentukan ikatan Pi dalam spesies kimia yang berbeza
Oleh kerana ikatan PI sentiasa disertai dengan satu atau dua lagi pautan (satu sigma atau PI lain dan satu sigma), adalah relevan untuk mengetahui bahawa ikatan berganda yang terbentuk di antara dua atom karbon (yang dibentuk oleh ikatan sigma dan satu pi) mempunyai tenaga pautan yang lebih rendah daripada yang sepadan dengan dua kali hubungan sigma antara kedua -dua.
Ini dijelaskan oleh kestabilan pautan sigma, yang lebih besar daripada ikatan Pi kerana tumpang tindih orbital atom di dalamnya berlaku selari di kawasan di atas dan di bawah lobus, mengumpul pengedaran elektronik dengan cara yang lebih jauh nukleus.
Walaupun begitu, apabila pautan Pi dan Sigma digabungkan dengan pautan yang lebih kuat daripada pautan mudah dengan sendirinya, yang dapat disahkan dengan memerhatikan panjang pautan antara pelbagai atom dengan pautan mudah dan berganda.
Boleh melayani anda: oksida bukan logamTerdapat beberapa spesies kimia yang dikaji oleh tingkah laku luar biasa mereka, seperti sebatian koordinasi dengan elemen logam, di mana atom pusat hanya bersatu dengan ikatan pi.
Ciri -ciri pautan PI
Tidak membenarkan pergerakan putaran bebas atom
Ciri -ciri yang membezakan pautan PI dari jenis interaksi lain antara spesies atom diterangkan di bawah, bermula dengan fakta bahawa kesatuan ini tidak membenarkan pergerakan putaran bebas atom, seperti karbon. Atas sebab ini, jika terdapat putaran atom, pecah ikatan berlaku.
Bertindih antara orbital oleh dua kawasan selari
Begitu juga, dalam menghubungkan pertindihan antara orbital berlaku melalui dua kawasan selari, menjadikannya mempunyai penyebaran yang lebih besar daripada ikatan sigma dan itu, atas sebab ini, mereka lebih lemah.
Antara beberapa orbital atom tulen
Sebaliknya, seperti yang disebutkan di atas, pautan PI sentiasa dihasilkan di kalangan sepasang orbital atom tulen; Ini bermakna dihasilkan di antara orbital yang tidak mengalami proses hibridisasi, di mana ketumpatan elektron kebanyakannya tertumpu di atas dan di bawah satah yang dibentuk oleh kesatuan kovalen.
Dalam pengertian ini, lebih daripada satu pautan Pi dapat dibentangkan di kalangan beberapa atom, selalu disertai dengan pautan sigma (dalam ikatan berganda).

Begitu juga, anda boleh memberikan hubungan tiga antara dua atom bersebelahan, yang dibentuk oleh dua ikatan PI dalam kedudukan yang membentuk pesawat tegak lurus antara satu sama lain dan hubungan sigma antara kedua -dua atom.
Boleh melayani anda: asid humik: struktur, sifat, mendapatkan, menggunakanContoh pautan PI
Molekul etilena
Seperti yang dinyatakan sebelum ini, molekul yang dibentuk oleh atom bersatu oleh satu atau lebih bon PI sentiasa mempunyai pelbagai pautan; iaitu, berganda atau tiga.
Contohnya ialah molekul etilena (h2C = ch2), yang dibentuk oleh kesatuan berganda; Iaitu, ikatan PI dan satu sigma antara atom karbonnya, sebagai tambahan kepada ikatan sigma antara karbon dan hidrogen.
Molekul asetilena
Bagi bahagiannya, molekul asetilena (H-C≡C-H) mempunyai hubungan tiga antara atom karbonnya; Ia.
Benzena dan derivatif
Bon PI antara molekul kitaran juga dibentangkan, seperti benzena (c6H6) dan derivatifnya, yang menghasilkan kesannya yang dipanggil resonans, yang membolehkan ketumpatan elektronik untuk berhijrah antara atom dan pemberian, antara lain, kestabilan yang lebih besar untuk kompaun.
Dicarbon
Untuk mencontohkan pengecualian yang disebutkan sebelumnya, kes -kes molekul dicarbonal (c = c, di mana kedua -dua atom mempunyai sepasang elektron berpasangan) dan sebatian koordinasi yang dipanggil hexacarbonildihierro (diwakili sebagai iman2(Co)6, yang dibentuk hanya oleh pautan pi di kalangan atomnya).

