Pautan Jambatan Hidrogen
- 943
- 230
- Erick Krajcik
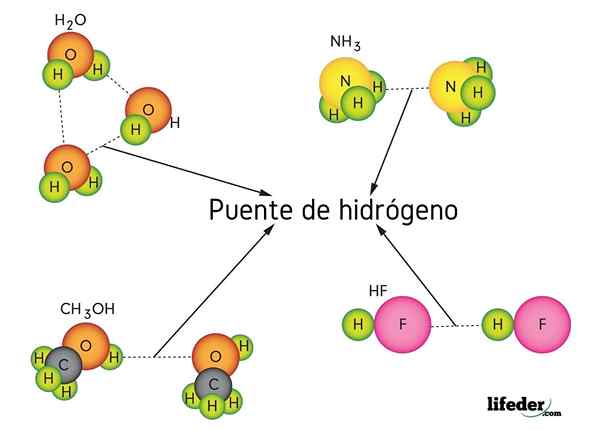
 Jambatan hidrogen di dalam air (h2O), metanol (CHO3OH), fluorida hidrogen (HF) dan ammonia (NH3)
Jambatan hidrogen di dalam air (h2O), metanol (CHO3OH), fluorida hidrogen (HF) dan ammonia (NH3) Apakah pautan jambatan hidrogen?
Ikatan Jambatan Hidrogen adalah jenis interaksi dipole-dipolo khas, yang dimiliki oleh daya van der Waals, di mana atom hidrogen bergabung dengan dua atau lebih molekul tanpa kovalen yang dikaitkan. Tidak ada perbincangan mengenai petak elektron, tetapi fenomena elektrostatik terutamanya.
Seperti namanya, hidrogen bertindak sebagai jambatan, jadi ia mestilah antara dua atom. Hidrogen dikaitkan (H-X) ke atom elektronegatif yang sangat. Ini mengakibatkan pembentukan jambatan hidrogen x ··· h-x.
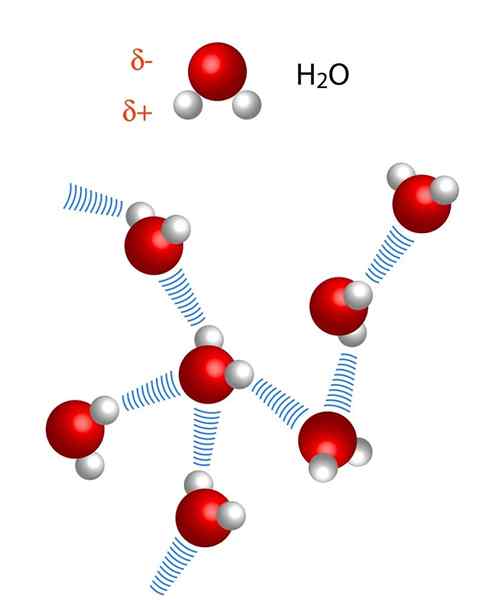
Perhatikan bahawa dalam perwakilan x ··· H-X, titik melambangkan jambatan hidrogen, sementara skrip mewakili ikatan kovalen antara h dan x. Yang berkata, mari kita lihat jambatan hidrogen antara dua molekul air, di mana x adalah atom oksigen: h2Atau ··· H-oh (imej yang lebih rendah).
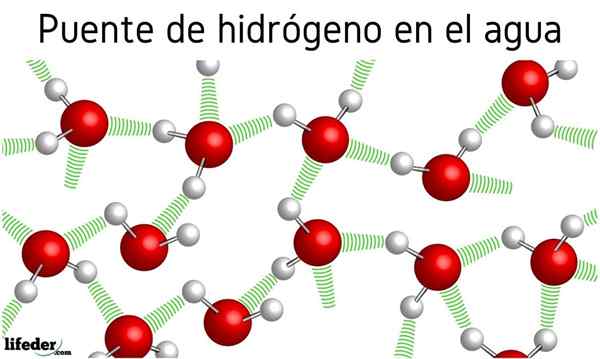
Dalam gambar di atas kita melihat bahawa tujuh molekul air tetap bersama -sama terima kasih kepada jambatan hidrogen mereka, diwakili oleh garis biru. Jambatan hidrogen sahaja tidak begitu kuat, tetapi apabila ada berbilion -bilion mereka, mereka memberikan perkara yang tidak normal dan tidak dijangka.
Ciri -ciri jambatan hidrogen
Komposisi
Jambatan hidrogen harus benar-benar diwakili sebagai X '··· H-X, di mana X adalah apa yang dikenali sebagai penderma jambatan hidrogen, kerana ia kovalen dikaitkan dengan hidrogen (ia memberikannya).
Sementara itu, x 'adalah penerima jambatan hidrogen, yang terdapat dalam molekul jiran (menerimanya). Oleh itu, kita mempunyai atom penderma (x), hidrogen (h) dan atom penerima (x ') yang menyusun jambatan hidrogen (X' ··· H-X).
Geometri
Apabila kita memikirkan jambatan, permukaan rata atau melengkung datang ke fikiran. Kerana diandaikan bahawa pautan tidak lengkung, kita akan mempunyai dua jarak: x ··· H dan H-X, yang membentuk jambatan hidrogen x ···.
Boleh melayani anda: Reaksi yang tidak dapat dipulihkan: Ciri dan ContohDi antara kedua -dua jarak ini terdapat sudut, yang sering 180 °; Iaitu, tiga atom jambatan kami terletak pada garis mendatar (atau menegak) yang sama.
Apabila sudut berbeza dari 180º, jambatan x ··· h-x tidak lagi lurus atau linear, tetapi memperoleh geometri lain.
Sebaliknya, jarak di jambatan hidrogen tidak sama. Jarak H-X lebih pendek daripada x ··· H, yang dapat dilihat dalam imej molekul air. Oleh itu, sebagai contoh, jarak H-X biasanya 110 petang (1 · 10-12m), manakala jarak yang lain x ··· h ialah 160 petang dan seterusnya.
Bersekutu
Ciri khas jambatan hidrogen adalah bahawa ia membolehkan molekul menjadi lebih berkaitan antara satu sama lain. Mereka tidak berjalan dari sisi ke yang lain mengabaikan satu sama lain. Oleh itu, ia menetapkan perintah seketika dalam payudara cecair; Dan dalam hal pepejal, mereka menyumbang kepada definisi kristal mereka.
Di mana kita melihat jambatan hidrogen kita dapat memikirkan persatuan dan, oleh itu, dalam urutan tertentu (walaupun dinamik dan berubah) ke skala molekul.
Tenaga
Memecahkan jambatan hidrogen tidak begitu sukar. Molekul air, sebagai contoh, berjalan dan mencipta setiap masa semasa menggerakkan. Tetapi memecahkan banyak daripada mereka pada masa yang sama akan menyiratkan gangguan molekul yang tidak berkesudahan. Kami bercakap tentang membekalkan tenaga sedemikian yang memecahkan tahi lalat hidrogen ini (6.02 · 1023 X ··· H-X).
Oleh itu, daya jambatan hidrogen berbeza -beza bergantung kepada identiti dan sifat molekul. Contohnya, daya jambatan hidrogen atau ··· H-O antara air dan alkohol adalah 5 kcal/mol: 5 kcal tenaga diperlukan untuk memecahkan tahi lalat jambatan hidrogen itu.
Boleh melayani anda: perubahan kimia: ciri, contoh, jenisContoh jambatan hidrogen
Air
Pada mulanya terdapat ceramah jambatan hidrogen antara molekul air, tetapi kesannya terhadap sifat mereka tidak disebutkan. Terima kasih kepada mereka air mendidih pada 100 ° C, meninggalkan titik mendidih molekul yang berkaitan seperti H2S, yang mendidih pada -60 ºC; atau h2Saya tahu, mendidih pada -41.25 ºC.
Perbezaan abysmal ini disebabkan oleh jambatan hidrogen air, yang juga menentukan sifat -sifat anomali mereka, seperti haba khusus mereka, kristal ais, pemalar dielektrik mereka, dan lain -lain.
Etanol
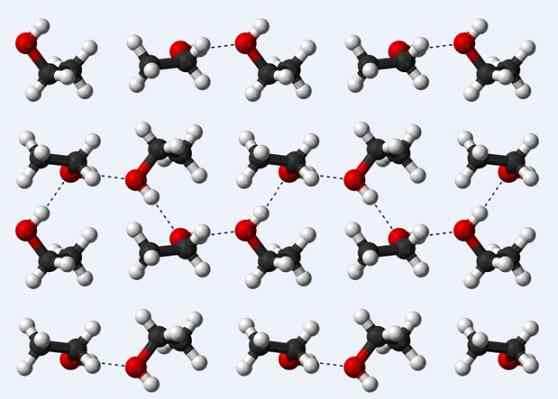 Jambatan hidrogen dalam kristal etanol
Jambatan hidrogen dalam kristal etanol Sekarang mari kita lihat jambatan hidrogen lain: yang antara molekul etanol, ch3Ch2Oh (di atas). Perhatikan bagaimana molekul ditampung3Ch2Oh sedemikian rupa sehingga jambatan hidrogen mereka ditubuhkan3Ch2Ho ··· Hoch2Ch3 (garis bertitik).
Walau bagaimanapun, molekul terlalu diperintahkan untuk mengandaikan bahawa kita bercakap tentang etanol cecair, tetapi sebaliknya membentuk kaca (etanol pepejal).
Jambatan hidrogen yang diterangkan untuk etanol adalah serupa dengan alkohol yang lain, dengan perbezaan bahawa kerangka berkarbonat mereka dapat menghalang kecekapan jambatan tersebut.
Asid asetik
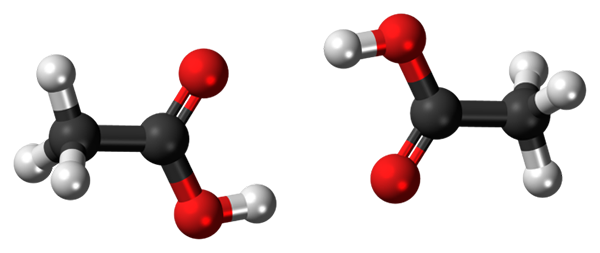 Jambatan hidrogen antara dua molekul asid asetik. Sumber: Jynto, CC0, melalui Wikimedia Commons
Jambatan hidrogen antara dua molekul asid asetik. Sumber: Jynto, CC0, melalui Wikimedia Commons Asid asetik, CHO3COOH, dapat menubuhkan dua jambatan hidrogen yang menyatukan dua molekul pada masa yang sama. Kerana mereka adalah dua molekul yang dikaitkan dengan jambatan hidrogen, kita bercakap mengenai dimer.
Perhatikan bahawa salah satu jambatan hidrogen ini ialah C = O ··· H-O dan O-H ··· O = C yang lain. Asid asetik membentangkan keanehan yang dalam fasa wap ia wujud seperti dimer ini.
Ia boleh melayani anda: asid mangan atau permanganikSelulosa
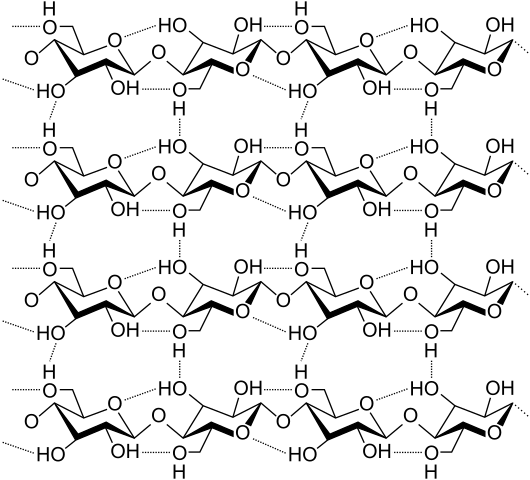 Jambatan hidrogen antara beberapa rantai selulosa. Sumber: Laghi.L, CC BY-SA 3.0, melalui Wikimedia Commons
Jambatan hidrogen antara beberapa rantai selulosa. Sumber: Laghi.L, CC BY-SA 3.0, melalui Wikimedia Commons Mari kita lihat jambatan hidrogen yang lebih pelbagai dan berganda. Selulosa, polimer semulajadi, terdiri daripada rantai yang terdiri daripada beberapa unit β-glukosa.
Setiap rantaian tetap ditetapkan kepada yang lain terima kasih kepada banyak jambatan hidrogen (imej unggul), yang mengukuhkan perpaduan antara rantai.
DNA
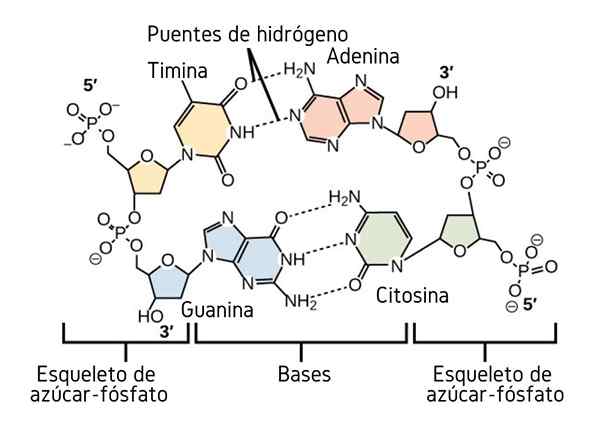 Jambatan hidrogen antara asas nitrogen DNA. Sumber: CNX OpenStax, CC oleh 4.0, melalui Wikimedia Commons
Jambatan hidrogen antara asas nitrogen DNA. Sumber: CNX OpenStax, CC oleh 4.0, melalui Wikimedia Commons Setakat ini kita telah melihat kesan bersekutu jambatan hidrogen untuk mengenakan pesanan antara molekul. Tetapi bagaimana dengan makromolekul? Dalam makromolekul, seperti DNA, kita dapati jambatan hidrogen dalaman atau intramolekul antara asas timin, adenine, guanine dan sitosin (di atas) (di atas).
Jambatan hidrogen intramolekul antara pasangan asas nitrogen ini, menjadikan molekul DNA memperoleh struktur kipas berganda, yang sesuai untuk replikasi. Sekiranya jambatan hidrogen ini dipecahkan oleh pemanasan, kipas berganda akan dibuka dalam dua segmen atau band individu.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Edward e. Ávila & asilé j. Blackberry. (2004). Jambatan hidrogen dan aplikasi aplikasinya. Universiti Los Andes, Fakulti Sains, Jabatan Kimia.
- Wikipedia. (2020). Ikatan hidrogen. Diperoleh dari: dalam.Wikipedia.org
- Pietri J. & Clark J. (21 Ogos 2020). Ikatan hidrogen. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Editor enyclopaedia Britannica. (2020). Ikatan hidrogen. Pulih dari: Britannica.com
- Helmestine, Anne Marie, Ph.D. (29 Oktober 2020). Apakah contoh ikatan hidrogen? Pulih dari: Thoughtco.com

