Penjelasan Imbangan Kimia, Faktor, Jenis, Contoh

- 1189
- 327
- Ms. Edgar Carroll
Dia keseimbangan kimia Ia adalah keadaan yang mencapai tindak balas kimia yang boleh diterbalikkan di mana tidak ada variasi kepekatan, atau reagen, atau produk yang terlibat dihasilkan. Ia dicirikan dengan dinamik dan tidak statik; iaitu, molekul atau atom terus bertindak balas, tetapi mengekalkan kepekatan yang sama pada masa itu.
Baki yang sama juga dibentangkan dalam perubahan fasa, walaupun tidak ada rehat pautan. Contohnya, cecair boleh seimbang dengan wapnya, dan juga sebagai pepejal. Begitu juga, pepejal menetapkan keseimbangan dengan air yang mengelilinginya apabila ia telah dicetuskan atau dikristalisasi.
 Dalam industri kimia, pengetahuan tentang keseimbangan kimia adalah penting untuk mendapatkan sintesis dengan hasil yang lebih baik. Sumber: Pxhere.
Dalam industri kimia, pengetahuan tentang keseimbangan kimia adalah penting untuk mendapatkan sintesis dengan hasil yang lebih baik. Sumber: Pxhere. Sebaik sahaja baki kimia ditubuhkan, tidak mungkin untuk mendapatkan lebih banyak perubahan atau tindak balas kecuali ia terganggu atau terjejas oleh tindakan luaran. Oleh itu, dalam sintesis produk, beberapa parameter seperti tekanan, jumlah atau suhu diubahsuai, supaya jumlah maksimum produk dihasilkan dalam keseimbangan.
Jika tidak, seimbang, jumlah produk akan menjadi tidak memuaskan; iaitu, akan ada prestasi reaksi yang lemah. Itulah sebabnya keseimbangan kimia adalah penting untuk industri kimia, dan secara umum untuk sebarang sintesis tanpa mengira skala.
Dalam keseimbangan kimia mungkin terdapat lebih banyak produk, atau lebih banyak reagen. Semuanya bergantung pada tempat baki dipindahkan. Mengambil kira beberapa faktor, anda boleh menggerakkan keseimbangan ke arah mana -mana dua arah anak panah berganda dalam reaksi yang boleh diterbalikkan.
[TOC]
Penjelasan mengenai keseimbangan kimia
Sebelum keseimbangan
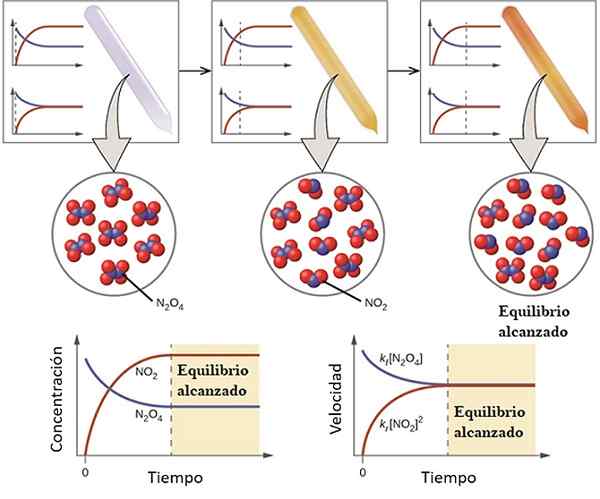 Contoh bagaimana reaksi menghampiri keseimbangannya. Sumber: OpenStax/CC oleh (https: // creativeCommons.Org/lesen/by/4.0)
Contoh bagaimana reaksi menghampiri keseimbangannya. Sumber: OpenStax/CC oleh (https: // creativeCommons.Org/lesen/by/4.0) Untuk memahami apa keseimbangan kimia yang dianggap sebagai tindak balas yang boleh diterbalikkan berikut:
N2Sama ada4(g) ⇌ Tidak2(g)
Gas n2Sama ada4 Tidak berwarna, sementara gas tidak2 membentangkan warna coklat atau coklat. Sekiranya jumlah n tertentu disuntik ke dalam botol kecil atau bekas2Sama ada4, Ini tidak berwarna sehingga baki ditetapkan.
Di sebelah kiri imej atas, dapat dilihat bahawa hampir semua molekul adalah n2Sama ada4 dan kepekatan tidak2 Ia adalah sifar.
Juga tunjukkan dua graf yang mewakili trend dalam keseimbangan, dengan garis putus -putus yang menunjuk kedudukan pada masa itu hanya n disuntik2Sama ada4. Grafik sepadan dengan kepekatan vs. Masa (tangan bawah) dan yang lain sepadan dengan graf pada kelajuan Vs. Masa (tangan ke kanan).
Kepekatan n2Sama ada4, [N2Sama ada4] (garis biru) secara beransur -ansur berkurangan, kerana sebahagian daripadanya akan memisahkan untuk menghasilkan molekul tidak2. Oleh itu, sebagai kepekatan tidak2, [Tidak2] (garis merah) sama dengan sifar pada mulanya, akan segera meningkat apabila n2Sama ada4 Berpisah.
Walau bagaimanapun, ia adalah tindak balas yang boleh diterbalikkan: sebahagian daripada molekul tiada2 Mereka akan bergabung untuk membentuk n2Sama ada4. Oleh itu, akan ada dua reaksi, langsung dan songsang, masing -masing dengan kelajuannya sendiri.
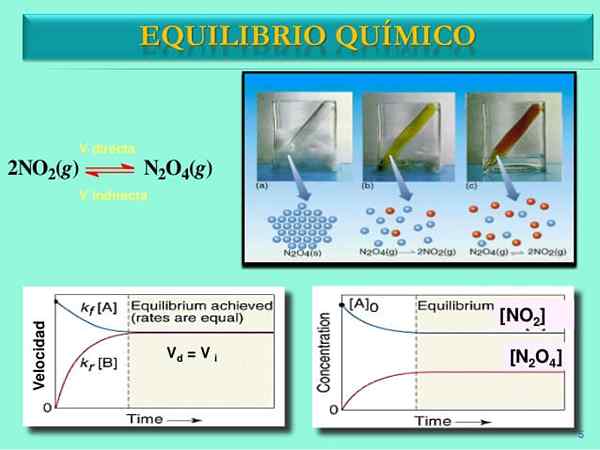 Sumber: Slideshare.jaring
Sumber: Slideshare.jaring Kelajuan tindak balas
Pada mulanya, kelajuan penggunaan n2Sama ada4 lebih besar daripada kelajuan penggunaan tidak2. Jelas, hanya mempunyai n2Sama ada4, beberapa molekul yang terbentuk tanpa2 Mereka hampir tidak dapat bertindak balas. Pada ketika ini, botol akan mula menyengat oren, kerana terdapat campuran n2Sama ada4 dan tidak2.
Sedikit demi sedikit, kerana terdapat lebih banyak molekul tidak2 Di jalan dan molekul N2Sama ada4 Mereka berpisah, kelajuan kedua -dua reaksi akan sepadan, walaupun kepekatan berbeza antara satu sama lain. Iaitu, tidak2] cenderung lebih besar daripada [n2Sama ada4], itulah sebabnya garis merah berada di atas garis kebiruan.
Boleh melayani anda: sifat fizikokimiaPerhatikan bahawa kelajuan menjadi dc/dt, iaitu, perubahan kepekatan berkenaan dengan masa. Itulah sebabnya kedua -dua c vs. t dan V Vs. t tidak sama.
Dalam keseimbangan
Sekali pasangan n2Sama ada4-Tidak2 Tetapkan keseimbangan, kelajuan kedua -dua reaksi akan dipadankan dan ungkapan matematik berikut akan diperolehi:
Vlangsung = k1[N2Sama ada4]
Vterbalik = k-1[Tidak2]2
Vlangsung = Vterbalik
k1[N2Sama ada4] = k-1[Tidak2]2
k1/k-1 = [Tidak2]2/ [N2Sama ada4]
KPers = [Tidak2]2/ [N2Sama ada4]
Pada ketika ini, jalan akan dicelup lebih daripada coklat, kerana baki lebih banyak dipindahkan ke arah pembentukan [tidak2]. Iaitu, kPers, Pemalar keseimbangan mestilah lebih besar daripada 1 dengan mengambil kira hubungan yang lebih tinggi, [tidak2]2/ [N2Sama ada4].
Dalam kepekatan keseimbangan [n2Sama ada4] dan tidak2] Mereka tetap malar, dengan kedua -dua reaksi berlaku pada kelajuan yang sama: sejumlah n hanya dipisahkan2Sama ada4, Jumlah yang sama akan dihasilkan dengan segera kerana reaksi sejumlah tidak2.
Atas sebab ini, dikatakan bahawa keseimbangan kimia dinamik: molekul n2Sama ada4 dan tidak2 Mereka masih mengambil bahagian dalam reaksi walaupun tidak ada perubahan dalam kepekatan mereka.
Dan menjadi kelajuan tindak balas yang sama untuk kedua -dua deria, garis merah dan kebiruan dalam grafik V Vs. t bermain di garis mendatar.
Keseimbangan keseimbangan
Pemalar keseimbangan untuk tindak balas sebelumnya akan selalu sama, pada suhu tertentu, tanpa mengira berapa n2Sama ada4 disuntik pada awal ke jalan. Ini akan jadi walaupun campuran n disuntik secara langsung2Sama ada4 dan tidak2, kemudian dibiarkan berehat sehingga baki mencapai.
Apabila keseimbangan dicapai dan kepekatan diukur [n2Sama ada4] dan tidak2], hubungan [tidak2]2/ [N2Sama ada4] akan memberikan yang sama kepada kPers Untuk reaksi ini. Semakin besarnya (keq >> 1), semakin banyak produk akan ada seimbang. Dan lebih kecil (keq << 1), más reactivos habrá en el equilibrio.
Konsentrasi [n2Sama ada4] dan tidak2] mereka tidak akan selalu. Sebagai contoh, jika jumlah kecil disuntik ke dalam botol, atau jika sebaliknya mereka disuntikkan torrents gas ini ke dalam reaktor, kuantiti akan berbeza -beza. Walau bagaimanapun, kPers Ia akan tetap sama selagi suhu adalah sama dalam kedua -dua proses.
KPers Ia terdedah kepada perubahan suhu: pada suhu yang lebih tinggi, nilai yang lebih besar akan. Iaitu, pada suhu yang lebih tinggi, seimbang ia akan cenderung kepada pembentukan lebih banyak produk. Ini begitu melainkan jika reaksi adalah eksotermik, seperti yang akan dijelaskan di bahagian berikut.
Faktor yang mempengaruhi keseimbangan kimia
Faktor yang mempengaruhi keseimbangan kimia dalam tindak balas yang boleh diterbalikkan ialah: kepekatan, tekanan dan suhu.
- Konsentrasi
Dalam tindak balas yang boleh diterbalikkan, menurut prinsip Le Chatlier, dengan meningkatkan kepekatan reagen akan ada anjakan keseimbangan kimia ke kanan, untuk meningkatkan kepekatan produk reaksi.
Sebaliknya, jika produk ditambah kepada tindak balas, baki kimia akan bergerak ke kiri, untuk meningkatkan kepekatan reagen. Jika tindak balas berikut diambil sebagai contoh:
C (s) +o2(g) ⇌ 2 co (g)
Dengan meningkatkan kepekatan reagen (C dan O2), Baki akan bergerak ke kanan, iaitu, ke arah pembentukan produk karbon monoksida (CO) (CO). Tetapi peningkatan kepekatan CA akan menghasilkan anjakan keseimbangan ke kiri, untuk meningkatkan kepekatan C dan O2.
Ia boleh melayani anda: Kumpulan Carbonyl: Ciri -ciri, Harta, Tatanama, Kereaktifan- Tekanan
Dalam tindak balas yang dibangunkan dalam fasa gas, variasi dalam jumlah atau dalam tekanan yang dikenakan ke atas gas yang terlibat di dalamnya, akan menghasilkan perubahan dalam keseimbangan, bergantung kepada bilangan tahi lalat reagen dan produk.
Jika komponen tindak balas (reagen dan produk) mempunyai perbezaan bilangan tahi lalat yang terlibat dalam tindak balas, contohnya, dimerisasi nitrogen dioksida (tidak2):
2 Tidak2(g) ⇌2Sama ada4(g)
Peningkatan tekanan yang dikenakan ke atas tindak balas dalam fasa gas, akibat penurunan atau tidak dari jumlah tindak balas, akan menyebabkan anjakan keseimbangan kimia ke sisi yang mempunyai mole gas yang kurang. Dalam contoh ini: Produk n2Sama ada4.
Sebaliknya, penurunan tekanan akan menghasilkan anjakan keseimbangan ke sisi tindak balas yang mempunyai bilangan mole gas terbesar. Dalam contoh yang diberikan, ia akan bergerak ke arah reagen (tidak2), Untuk mengatasi penurunan tekanan.
Sekiranya dalam reaksi fasa soda, tahi lalat reagen adalah sama dengan tahi lalat produk, perubahan tekanan tidak akan menjejaskan keseimbangan kimia.
- Suhu
Reaksi endotermik
Dalam tindak balas endotermik, haba boleh dianggap sebagai reagen, kerana bekalannya diperlukan untuk reaksi berlaku:
A +q ⇌ b
Q = Haba dibekalkan
Oleh itu, dalam tindak balas endotermik apabila suhu meningkat, baki akan bergerak ke kanan. Sementara itu, apabila suhu berkurangan, baki bergerak ke kiri.
Panas menjadi sebahagian daripada reagen, untuk memakannya untuk berubah menjadi b.
Reaksi eksotermik
Dalam tindak balas eksotermik, haba dihasilkan, ini menjadi produk reaksi:
A ⇌ B +Q
Dalam tindak balas eksotermik apabila suhu meningkat, baki akan bergerak ke kiri (reagen), kerana pengeluaran haba meningkat. Sementara itu, apabila suhu berkurangan, baki akan bergerak ke kanan (produk).
Haba menjadi sebahagian daripada produk, apabila suhu meningkat tidak perlu menyumbang lebih banyak haba ke persekitaran. Dan oleh itu, keseimbangan akan memanfaatkan haba tambahan untuk menghasilkan lebih banyak reagen; Dalam kes ini, lebih daripada.
Jenis keseimbangan kimia
Bergantung pada keadaan fizikal komponen tindak balas, keseimbangan kimia boleh menjadi homogen atau heterogen.
Keseimbangan homogen
Dalam jenis keseimbangan ini, semua Reagen dan produk mempunyai fasa atau status cecair yang sama. Sebagai contoh:
N2(g) +3 h2(g) ⇌ 2 nh3(g)
Inilah begitu2, seperti h2 dan NH3 Mereka adalah bahan gas.
Keseimbangan heterogen
Wujud ketika tidak semua Reagen dan produk mempunyai fasa atau keadaan fizikal yang sama. Sebagai contoh:
2 Nahco3(s) ⇌ na2Co3(s) +co2(g) +h2O (g)
Di sini kita mempunyai Nahco3 dan na2Co3 sebagai pepejal, dan co2 dan h2Atau sebagai gas atau wap.
Contoh keseimbangan kimia
Penyisihan asid asetik di dalam air
Asid asetik, CHO3COOH, memisahkan air yang mewujudkan keseimbangan:
Ch3COOH (AC) + H2Atau (l) ⇌ cho3COO-(Ac) + h3Sama ada+(Ac)
Tindak balas yang malar keseimbangan dipanggil pemalar keasidan.
IsomerisasiSama adan dari butana
Gas n-Butano boleh disusun mengikut reaksi yang boleh diterbalikkan berikut untuk menghasilkan isomer isomer:
Ch3Ch2Ch2Ch3(g) ⇌ cho3CH (Ch3)2(g)
Pembentukan oksida nitrik di atmosfera
Di atmosfera, oksida nitrat boleh dibentuk, walaupun sangat hampir, dari nitrogen dan oksigen udara:
N2(g) + atau2(g) ⇌ 2no (g)
Ia boleh melayani anda: Apakah miliequivalente? (Contoh pengiraan)KPers Dari reaksi ini adalah 2 · 10-31 pada 25 ºC, jadi jumlah yang tidak dapat dibentuk tidak akan dibentuk.
Tindak balasSama adaN dari perak dengan amonYoAc
Ion perak, AG+, Mereka boleh diselesaikan dengan ammonia mengikut reaksi yang boleh diterbalikkan berikut:
Ag+(Matahari) + 2nh3(L) ⇌ [Ag (NH3)2]+(matahari)
Latihan yang diselesaikan
Latihan 1
Apakah jenis keseimbangan kimia yang sepadan dengan tindak balas berikut?
2nocl (g) ⇌ 2no (g) + cl2(g)
Reaksi ini sepadan dengan keseimbangan homogen, kerana semua bahan yang terlibat, NOCL, NO dan CL2, Mereka adalah gas.
Latihan 2
Untuk tindak balas yang sama dari atas, apakah perubahan seimbang dapat dijangkakan jika tekanan tiba -tiba meningkat?
Mari mengira tahi lalat reagen:
2nocl
Kami mempunyai 2 tahi lalat NOCL. Sekarang mari kita beritahu tahi lalat produk:
2no + cl2
Kami mempunyai tiga tahi lalat: dua tidak, dan salah satu CL2. Terdapat lebih banyak tahi lalat gas di sisi produk. Oleh itu, peningkatan tekanan akan menyebabkan keseimbangan bergerak ke sebelah kiri, ke arah pembentukan NOCL. Dengan cara ini, sistem ini bertujuan untuk melembutkan kesan tekanan yang memihak kepada pembentukan NOCL dan bukannya NO dan Cl2.
Latihan 3
Untuk tindak balas yang sama dari atas, katakan bahawa jumlah CL yang besar tiba -tiba disuntik2. Apa yang akan berlaku untuk mengimbangi?
Apabila menambah Cl2 kepada reaktor atau bekas, kepekatannya semakin meningkat sebagai produk reaksi. Dan oleh itu, baki akan bergerak kembali ke kiri, untuk membentuk lebih banyak NOCL.
Latihan 4
Sekiranya pemisahan NOCL pada 227 ºC mempunyai 4 keseimbangan keseimbangan 4.5 · 10-4, Arah apakah baki yang dipindahkan?
Sekali lagi, menjadi kPers kurang dari 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, kerana ia dipindahkan ke kiri.
Latihan 5
Mengikut reaksi berikut dalam keseimbangan:
[CO (OH2)6]2+(Ac) +4cl-(Ac) +q ⇌ [cocl4]2-(AC) +6H2Atau (l)
Dan mengetahui bahawa kompleks [co (oh2)6]2+ Ia berwarna merah jambu, dan kompleksnya adalah [cocl4]2- Ini kebiruan, apa perubahan yang anda harapkan untuk melihat jika anda memanaskan bekas dengan [CO (oh2)6]2+? Apa yang anda harapkan untuk melihat jika selepas memanaskan bekas saya akan meletakkannya di bilik mandi dengan ais?
Tindak balasnya adalah endotermik, kerana ia menyerap haba itu sebagai reagen. Oleh itu, apabila memanaskan bekas dengan [CO (OH2)6]2+, Baki akan bergerak ke kanan, ke arah pembentukan [COCL4]2-. Perubahan warna merah jambu kebiruan akan berlaku.
Kemudian, jika bekas pewarna kebiruan dengan [COCL4]2- Ia diletakkan di bilik mandi dengan ais, reaksi kini akan bergerak ke kiri, ke arah pembentukan CO (oh2)6]2+:
[Cocl4]2-(AC) +6H2Atau (l) ⇌ [co (oh2)6]2+(Ac) +4cl-(Ac) +q
Ini kerana tindak balas terbalik adalah eksotermik, mempunyai haba yang sebagai produk. Oleh itu, apabila menyejukkan bekas dengan [COCL4]2- Biru, kompleks [co (oh (oh2)6]2+, Dan warna merah jambu akan muncul semula.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Persediaan Emedical. (s.F.). Jenis keseimbangan. Pulih dari: EmedicPrep.com
- Kimia Boundless Lumen. (s.F.). Faktor yang mengimbangi keseimbangan kimia. Pulih dari: kursus.Lumenning.com
- Wikipedia. (2020). Keseimbangan kimia. Diperoleh dari: dalam.Wikipedia.org
- Kimia Librettexts. (24 Mei 2020). Pengiraan Equiquibrium - Sub Illustrative Contoh. Pulih dari: chem.Libretxts.org
- Meyers Amy. (2020). Keseimbangan: Kimia dan Dinamik. Kajian. Pulih dari: belajar.com
- Helmestine, Anne Marie, Ph.D. (11 Februari 2020). Keseimbangan kimia dalam tindak balas kimia. Pulih dari: Thoughtco.com

