Struktur timah, sifat, mendapatkan, menggunakan

- 642
- 164
- Ismael Turner
Dia timah Ia adalah logam milik blok p dari jadual berkala, yang simbol kimianya adalah SN, dan yang terletak di Kumpulan 14, karbon. Walaupun menjadi logam yang digunakan secara meluas sepanjang kemanusiaan sejak zaman purba, kebenarannya adalah bahawa ia adalah logam langka di kerak bumi (2.3 ppm).
Ia adalah logam perak, lembut, mulur dan lembut. Ia mempunyai bilangan atom sebanyak 50, dan keadaan utama atau nombor pengoksidaannya ialah +2 (SN2+) dan +4 (sn4+), Sebagai sebatian timah (ii), seperti sncl2, Ejen pengurangan yang baik.
 Tin Alotropes. Sumber: Zinn_9.JPG: Dari: Pengguna: Tomihahndorf.Kerja Derivatif: MaterialScientist/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/2.0)
Tin Alotropes. Sumber: Zinn_9.JPG: Dari: Pengguna: Tomihahndorf.Kerja Derivatif: MaterialScientist/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/2.0) Timah mempunyai simbol sn, yang merupakan singkatan perkataan Latin "Stannum". Tin adalah tahan logam terhadap serangan air dan udara pada suhu bilik; Tetapi di udara panas membentuk timah dioksida, snam2.
Harta yang tahan terhadap kakisan, dan mempunyai titik lebur yang rendah, telah berkhidmat untuk mempunyai banyak aplikasi; seperti salutan permukaan logam dan kimpalan.
Timah mempunyai dua bentuk allotropik utama: bentuk β putih dan pepejal; dan konteks α, kelabu dan biasanya berdebu (lebih rapuh). Oleh itu, bentuk β adalah yang paling banyak digunakan dalam aplikasi timah.
Satu lagi harta penting timah adalah keupayaannya untuk menjadi sebahagian daripada aloi dengan beberapa logam, yang tertua adalah gangsa, aloi tembaga dan timah.
[TOC]
Penemuan
 Granul timah. Sumber: Nephronus, CC0, melalui Wikimedia Commons
Granul timah. Sumber: Nephronus, CC0, melalui Wikimedia Commons Tin adalah logam yang dikenali sejak zaman purba. Oleh itu, tidak diketahui siapa penemunya; Dan lebih kurang, tahun dan tempat penemuannya.
Gangsa adalah aloi tembaga dengan timah dan arsenik. Adalah mungkin bahawa penjelasan aloi ini adalah akibat dari fakta yang tidak beragama dan tidak disengajakan, sejak objek gangsa pertama - dalam Zaman Gangsa - dibentuk oleh tembaga dan hanya jejak arsenik.
Objek ini muncul di Timur Dekat di mana arsenik dikaitkan dengan tembaga. Tetapi sejak awal ketoksikan arsenik dibuktikan, mencapai penggantiannya2).
Orang Yunani Kuno memperoleh timah oleh perdagangan maritim dan merujuk kepada sumber timah mereka sebagai "kasiterida" yang bermaksud 'pulau timah'. Ada kemungkinan pulau -pulau ini terletak di Cornuelles, British atau Sepanyol, di mana terdapat deposit timah yang besar.
Ia boleh melayani anda: subsalicylate bismut: struktur, sifat, kegunaan, kesanStruktur timah kimia
Apabila terdapat dua alotrop: timah putih atau β-sn, dan timah kelabu atau α-sn, kita akan mempunyai dua struktur kristal. Β-SN tetragonal berpusat pada badan (BCT), yang mencirikan kebolehtelapan timah putih.
Sementara itu, struktur α-SN adalah berlian; iaitu, atom SN dihubungkan dengan membentuk jaring tetrahedra, tanpa kewujudan ikatan logam sama sekali.
Timah juga membentangkan dua alotrop lain di bawah keadaan tekanan yang berbeza (mengikut urutan GPA) dan suhu (di atas 161 ºC): σ-SN dan γ-SN.
Konfigurasi Elektronik
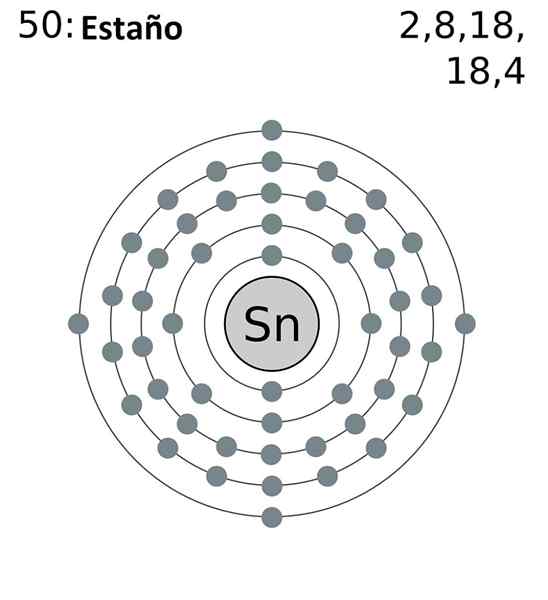
Konfigurasi elektronik disingkat timah adalah seperti berikut:
[KR] 4D10 5s2 5 p2
Menambah semua elektron Kami akan mempunyai sejumlah 14, nombor yang sama yang sesuai dengan kumpulan anda. Walau bagaimanapun, hanya elektron orbital 5s dan 5p adalah yang mengambil bahagian dalam tindak balas kimia timah, kerana 4D tidak tersedia secara bertenaga.
Sifat timah
Penampilan dan ciri fizikal
Tin adalah logam lembut, mulur dan mudah dibentuk, yang boleh menjadi sejuk dan berputar. Titik lebur yang rendah membolehkan mematuhi permukaan logam atau aloi seperti keluli, tembaga dan aloinya, melindungi mereka dari pengoksidaan.
Apabila sekeping timah dilipat, ia memotong, memancarkan bunyi ciri yang dikenali sebagai "timah timah", akibat penghancuran kristal.
Tin mempunyai dua bentuk allotropik: β dan α. Bentuk β sepadan dengan pepejal putih dan bertanggungjawab untuk aplikasi timah; Walaupun bentuk α adalah serbuk kelabu.
 Lokasi timah dalam jadual berkala. Sumber: Imej oleh Daniel Mayer atau GreatPatton dan dibebaskan di bawah terma FDL GNU
Lokasi timah dalam jadual berkala. Sumber: Imej oleh Daniel Mayer atau GreatPatton dan dibebaskan di bawah terma FDL GNU Bentuk β dibentangkan pada suhu di atas 13.2 ºC. Apabila suhu turun 13.2 ºC, perubahan timah dari bentuk β ke bentuk α. Fenomena ini tidak diingini dan dielakkan dengan menambahkan logam lain kepada timah, seperti antimoni atau bismut, yang menghalang perubahan ini dan memanjangkan hayatnya yang berguna.
Tin adalah superkonduktor pertama yang dikenali pada suhu di bawah 3.72 k.
Nombor atom
lima puluh
Jisim molar
118.71 g/mol
Takat lebur
231.93 ºC
Takat didih
2602 ºC
Ketumpatan
Alotropo β: 7.265 g/cm3
Alotropo α: 5.769 g/cm3
Keadaan pengoksidaan
Timah mempunyai pelbagai pengoksidaan: -4, -3, -2, -1, 0, +1, +2, +3, +4. Walau bagaimanapun, sebahagian besar sebatian mereka mempunyai timah dengan keadaan pengoksidaan +2 (SN2+) dan +4 (sn4+).
Boleh melayani anda: sebatian organikTenaga pengionan
Pertama: 708.6 kJ/mol
Kedua: 1411.8 kJ/mol
Ketiga: 2943.0 kJ/mol
Elektronegativiti
1.96 pada skala Pauling
Reaktiviti
Tin adalah tahan logam terhadap tindakan udara dan air pada suhu bilik, tetapi apabila ia dipanaskan di udara membentuk timah oksida (iv), snam2, yang lemah berasid. Ia diserang oleh asid dan alkali, dan dengan kehadiran oksigen boleh bertindak dalam beberapa kes sebagai pemangkin.
Memperoleh
 Mineral casiterite adalah sumber mineralogi timah utama. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)
Mineral casiterite adalah sumber mineralogi timah utama. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) Timah, dari sudut pandangan kejadiannya, adalah logam yang jarang berlaku, kerana ia mempunyai kelimpahan di kulit bumi hanya 2 ppm. Mineral Casiterite, mineral oksida timah, adalah satu -satunya sumber komersial timah.
Casiterite adalah mineral hitam yang terdapat di kawasan berlumpur di tebing sungai. Timah diekstrak dari casiterite dengan pemanasan sehingga 1370 ºC dengan arang batu atau kok untuk menghasilkan pengurangannya.
Timah yang dihasilkan adalah tidak suci, jadi ia dirawat dengan natrium hidroksida atau asid hidroklorik untuk solubilization timah. Kemudian, ini tertakluk kepada elektrolisis, menjadi anod timah dan katod besi. Tin disimpan di katod, dengan kesucian lebih daripada 90%.
Penggunaan/aplikasi
Perlindungan kakisan
Tin adalah logam tahan kakisan. Can atau timah yang dipandang adalah bekas keluli, ditutup dengan lapisan timah untuk mengelakkan pengoksidaan.
Tin telah digunakan untuk menyimpan makanan dan bahan lain, contohnya: lukisan, lacquers, pelarut, dll. Tetapi mereka kini digantikan oleh bekas aluminium atau plastik. Paip dan injap berlapis timah mengekalkan kesucian air dan minuman.
Aloi
 Kegunaan pertama untuk aloi timah adalah untuk mengeluarkan bekas atau perkakas seperti tin dan kendi pantri ini. Sumber: Pelayaran Butterfly - Serge Ouachée/CC oleh -SA (https: // creativeCommons.Org/lesen/by-sa/3.0)
Kegunaan pertama untuk aloi timah adalah untuk mengeluarkan bekas atau perkakas seperti tin dan kendi pantri ini. Sumber: Pelayaran Butterfly - Serge Ouachée/CC oleh -SA (https: // creativeCommons.Org/lesen/by-sa/3.0) Lelaki itu mula menggunakan gangsa selama lebih dari 5000 tahun. Gangsa adalah aloi tembaga dan timah yang digunakan dalam penjelasan alat, senjata, peralatan rumah tangga.
Dengan cara yang sama kulit, aloi yang pada mulanya timah dan plumbum, digunakan untuk membuat periuk, pinggan, dll. Tetapi disebabkan oleh ketoksikan, Peel kini dihasilkan dengan timah, antimoni dan aloi kobalt.
Ia boleh melayani anda: asid hypoyodous (HIO)Aloi Tin dan Lead mempunyai titik lebur yang rendah, harta yang telah membolehkan penggunaannya dalam kimpalan, teknik yang berfungsi untuk menyatukan kepingan yang terdapat dalam litar elektrik dan elektronik. Terdapat kereta di mana timah adalah aloi dengan besi, sementara ia digunakan dalam aloi aluminium, timah dan titanium kenderaan aeroangkasa.
Aloi Circonium, juga dipanggil zircaloys, digunakan dalam reaktor nuklear dan mempunyai sedikit timah.
 Sampel timah. Sumber: Ondřej Mangl, Domain Awam, melalui Wikimedia Commons
Sampel timah. Sumber: Ondřej Mangl, Domain Awam, melalui Wikimedia Commons Aloi perak dan timah telah digunakan dalam amalgam gigi.
Aloi kristal dengan elemen niobio adalah superkonduktor yang berfungsi pada suhu 18 k dan mengekalkan harta miliknya dalam medan magnet yang kuat.
Kaca
Timah digunakan dalam prosedur Pilkington untuk menghasilkan kaca tingkap. Kaca cair diletakkan di atas permukaan timah cair, memperoleh kaca permukaan rata dan licin. Teknik ini masih berjaya digunakan.
Garam timah disembur di kaca untuk mendapatkan lapisan kuasa konduktif, dapat digunakan untuk membuat panel pencahayaan dan cermin depan tanpa fros.
Sebatian timah
Klorida berdosa (SNCL2) Ia digunakan dalam timah tergalvani dan sebagai ejen pengurangan dalam pembuatan polimer dan pewarna. Fluorida Tin (SNF2) Ini adalah bahan aktif dalam pasta gigi.
Sementara itu, oksidanya adalah pemangkin berguna dalam proses perindustrian tertentu. Di samping itu, ia digunakan sebagai serbuk untuk menggilap keluli.
Sebatian timah organik digunakan sebagai biosida dan racun kulat, menjadi toksik kepada manusia. Penstabil timah organik digunakan untuk mengelakkan perubahan dalam polyvinyl chloride kerana pendedahan kepada cahaya dan panas.
Isñico klorida (SNCL4) digunakan sebagai penstabil minyak wangi dan sebagai bahan permulaan untuk garam timah yang lain.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Timah. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi (2020). Timah. Ringkasan Pubchem Comunund untuk CID 23974. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2020). Fakta elemen timah. Pulih dari: chemicool.com
- Editor enyclopaedia Britannica. (2020). Timah. Pulih dari: Britannica.com
- Bell, Terence. (26 Ogos, 2020). Sifat, pengeluaran, dan aplikasi timah. Pulih dari: Thoughtco.com
- Lentech b.V. (2020). Timah. Pulih dari: lentech.com
- Stephanie Pupas. (28 Julai 2015). Fakta mengenai timah. Pulih dari: Livescience.com
- Prosiding Persidangan AIP. (9 Februari 2018). Pemulihan timah dari sanga timah menggunakan kaedah elektrolisis. doi.org/10.1063/1.5024070

