Struktur protein ciri kuartal
- 4995
- 336
- Ms. Edgar Carroll
The Struktur Quaternary protein mentakrifkan hubungan spatial antara setiap subunit polipeptida yang dikaitkan dengan daya bukan kovalen. Dalam protein polimer, setiap rantai polipeptida yang membuatnya dipanggil subunit atau protomeres.
Protein boleh dibentuk oleh satu (monomerik), dua (dimérica), beberapa (oligomerik) atau banyak protomer (polimer). Protomer ini boleh mempunyai struktur molekul yang sama atau sangat berbeza di antara mereka. Dalam kes pertama dikatakan bahawa mereka adalah protein homotip dan dalam kes kedua, heterotipikal.
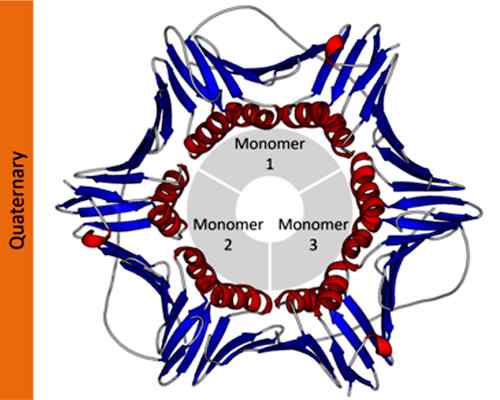
 Contoh Struktur Quaternary Protein Antigen Nuklear Sel Proliferasi. Diambil dan diedit dari: Thomas Shafee [CC oleh 4.0 (https: // creativeCommons.Org/lesen/by/4.0)].
Contoh Struktur Quaternary Protein Antigen Nuklear Sel Proliferasi. Diambil dan diedit dari: Thomas Shafee [CC oleh 4.0 (https: // creativeCommons.Org/lesen/by/4.0)]. Dalam notasi saintifik, ahli biokimia menggunakan huruf Yunani dengan subskrip untuk menggambarkan komposisi protom protein. Sebagai contoh, protein homotip tetramerik ditetapkan sebagai α4, Walaupun protein tetramerik yang dibentuk oleh dua dimer yang berbeza ditetapkan sebagai α2β2.
[TOC]
Struktur protein
Protein adalah molekul kompleks yang memperoleh konfigurasi tiga dimensi yang berbeza. Konfigurasi ini eksklusif untuk setiap protein dan membolehkan mereka melaksanakan fungsi yang sangat spesifik. Tahap organisasi struktur protein adalah yang berikut.
Struktur utama
Ia merujuk kepada urutan di mana asid amino yang berbeza dalam rantaian polipeptida diatur. Urutan ini diberikan oleh urutan DNA yang mengkodekan protein tersebut.
Struktur sekunder
Sebilangan besar protein bukan rantai panjang asid amino yang panjang, tetapi mempunyai kawasan yang kerap dilipat dalam bentuk kipas atau lembaran. Lipat ini adalah yang dipanggil struktur sekunder.
Struktur Tersier
Kawasan yang dilipat struktur sekunder boleh, seterusnya, melipat dan memasang dalam struktur yang lebih padat. Lipat terakhir ini adalah yang memberikan protein bentuk tiga dimensi.
Struktur Quaternary
Dalam protein yang dibentuk oleh lebih daripada satu subunit, struktur kuartal adalah hubungan spatial yang wujud di antara setiap subunit, yang dikaitkan dengan ikatan bukan kovalen.
Boleh melayani anda: bagaimana kulat bernafas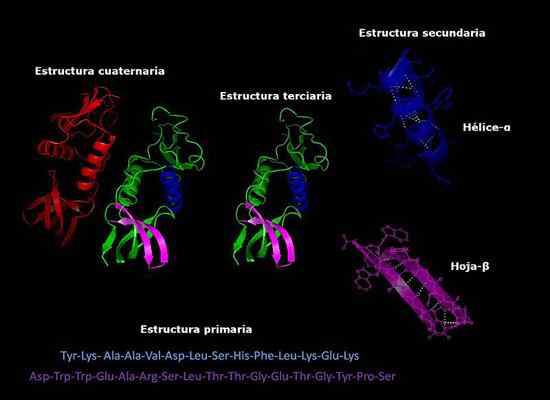 Struktur protein protein, menengah, menengah, tertiari dan kuartal, pengesahan tiga dimensi. Diambil dan diedit dari: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)].
Struktur protein protein, menengah, menengah, tertiari dan kuartal, pengesahan tiga dimensi. Diambil dan diedit dari: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Kestabilan struktur kuartal
Struktur protein tiga dimensi yang stabil oleh interaksi lemah atau tidak -kovalen. Walaupun pautan atau interaksi ini jauh lebih lemah daripada ikatan kovalen biasa, ini banyak dan kesan kumulatif mereka berkuasa. Seterusnya kita akan melihat beberapa interaksi yang paling biasa.
Interaksi hidrofobik
Beberapa asid amino mengandungi rantai sampingan hidrofobik. Apabila protein mempunyai asid amino ini, lipatan molekul memerintahkan rantai sisi ini ke dalam protein dan melindungi mereka dari air. Sifat rantai sampingan yang berbeza menyebabkan mereka menyumbang dengan cara yang berbeza dalam kesan hidrofobik.
Interaksi Van Der Waals
Interaksi ini berlaku apabila molekul atau atom yang tidak bersatu dengan pendekatan ikatan kovalen terlalu banyak di antara mereka, dan kerana itu orbital elektronik paling luar mereka mula bertindih.
Pada masa itu daya penolakan ditubuhkan di antara atom -atom yang tumbuh dengan pesat apabila pusat masing -masing menghampiri. Ini adalah "pasukan" van der Waals ".
Interaksi beban beban
Ia adalah interaksi elektrostatik yang berlaku di antara beberapa zarah yang dimuatkan. Dalam protein jenis interaksi ini berlaku, kedua -duanya disebabkan oleh caj elektrik bersih protein, dan beban individu ion yang terkandung di dalamnya. Interaksi jenis ini kadang -kadang dipanggil Puente Salino.
Ikatan hidrogen
Ikatan hidrogen ditubuhkan antara atom hidrogen yang dilampirkan, dengan cara.
Bon jenis ini sangat penting, kerana sifat -sifat banyak molekul, termasuk molekul air dan biologi, sebahagian besarnya disebabkan oleh ikatan hidrogen. Sifat saham ikatan kovalen (elektron dikongsi) dan juga interaksi bukan kovalen (interaksi kargo beban).
Boleh melayani anda: tanaman sementaraInteraksi Dipolos
Dalam molekul, termasuk protein, yang tidak menunjukkan beban bersih, pelupusan tidak seragam beban dalaman mereka boleh dikemukakan, dengan akhir yang sedikit lebih negatif daripada yang lain. Inilah yang dikenali sebagai dipole.
Keadaan molekul ini boleh kekal, tetapi ia juga boleh diinduksi. Dipolos boleh tertarik dengan ion atau dipoles lain. Sekiranya dipoles kekal, interaksi mempunyai ruang lingkup yang lebih besar daripada yang dibentangkan dengan dipoles yang diinduksi.
Sebagai tambahan kepada interaksi bukan -kovalen ini, beberapa protein oligomerik menstabilkan struktur kuarum mereka melalui jenis pautan kovalen, pautan disulfida. Ini ditubuhkan di antara kumpulan sulfhydrillo cysteons protomeres yang berbeza.
Bon Disulfuro juga membantu menstabilkan struktur sekunder protein, tetapi dalam kes ini, sisa cystein menghubungkan di dalam polipeptida yang sama (pautan disulfida intrapopolipeptide).
Interaksi antara protomer
Seperti yang dinyatakan sebelum ini, dalam protein yang terdiri daripada beberapa subunit atau protomer, subunit ini boleh sama (homotip) atau berbeza (heterotip).
Interaksi homotip
Subunit yang membentuk protein adalah rantai polipeptida asimetrik. Walau bagaimanapun, dalam interaksi homotip, subunit ini boleh dikaitkan dengan cara yang berbeza mencapai pelbagai jenis simetri.
Kumpulan yang berinteraksi dengan setiap protomere umumnya terletak di kedudukan yang berbeza, jadi mereka dipanggil interaksi heterolog. Interaksi heterolog antara subunit yang berbeza, kadang -kadang berlaku sedemikian rupa sehingga setiap subunit bengkok berkenaan dengan duluan, struktur heliks dan struktur heliks dapat dicapai.
Pada masa -masa lain, interaksi diberikan sedemikian rupa sehingga kumpulan subunit yang ditakrifkan disusun sekitar satu atau beberapa paksi simetri, dalam apa yang dikenali sebagai simetri kumpulan. Apabila terdapat beberapa paksi simetri, setiap subunit dipecahkan berkenaan dengan jirannya 360 °/N (di mana n mewakili bilangan paksi).
Ia boleh melayani anda: Flora dan Fauna Australia: Spesies WakilAntara jenis simetri yang diperoleh dengan cara ini adalah contohnya, helical, padu dan icosahedral.
Apabila dua subunit berinteraksi melalui paksi binari, setiap unit pecah 180 ° berkenaan dengan yang lain, di sekitar paksi itu. Simetri ini dikenali sebagai simetri c2. Di dalamnya, tapak interaksi di setiap subunit adalah sama; Dalam kes ini tidak ada perbincangan mengenai interaksi ahli heterologi, tetapi interaksi isolog.
Jika, sebaliknya, persatuan antara kedua -dua komponen dimer adalah ahli heterologi, maka dimer asimetrik akan diperolehi.
Interaksi heterotip
Tidak selalunya subunit yang berinteraksi dalam protein adalah sifat yang sama. Terdapat protein yang dibentuk oleh subunit dua belas atau lebih berbeza.
Interaksi yang mengekalkan kestabilan protein adalah sama seperti dalam interaksi homotypic, tetapi molekul sepenuhnya asimetrik biasanya diperoleh.
Hemoglobin, sebagai contoh, adalah penguji yang membentangkan dua pasang subunit yang berbeza (α2β2).
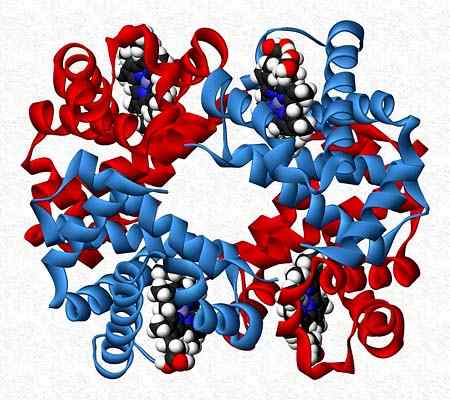 Struktur Hemoglobin Quaternary. Diambil dan diedit dari: Benjah-bmm27. Diubahsuai oleh Alejandro Porto. [CC0].
Struktur Hemoglobin Quaternary. Diambil dan diedit dari: Benjah-bmm27. Diubahsuai oleh Alejandro Porto. [CC0]. Rujukan
- C.K. Mathews, k.Dan. Van hold & k.G. Ahern (2002). Biokimery. Edisi ke -3. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, ms. Mayes, d.C. Granner & v.W. Rodwell (1996). Biokimer Harper. Appleton & Lange
- J.M. Berg, j.L. Tymoczko & l. Stryer (2002). Biokimery. Edisi ke -5. W. H. Freeman dan Syarikat.
- J. Koolman & k.-H. Roehm (2005). Atlas warna biokimia. Edisi ke -2. Thieme.
- Ke. Lehninger (1978). Biokimia. Edisi omega, s.Ke.
- L. Stryer (1995). Biokimery. W.H. Freeman dan Syarikat, New York.
- « Abad ke -19 dalam populasi Chile, masyarakat, ekonomi dan politik
- Ciri -ciri, struktur, fungsi dan kegunaan vimentin »

