Struktur sekunder ciri protein

- 2373
- 400
- Dallas Bernhard
The Struktur protein sekunder Ia adalah nama yang mentakrifkan penyesuaian dilipat secara tempatan dari beberapa bahagian rantai polipeptida. Struktur ini terdiri daripada beberapa corak yang diulangi secara berkala.
Terdapat banyak cara di mana rantai protein dilipat. Walau bagaimanapun, hanya beberapa bentuk ini yang sangat stabil. Secara semula jadi, bentuk yang paling kerap yang diperoleh oleh protein adalah kipas α serta lembaran β. Struktur ini dapat digambarkan oleh sudut pautan ψ (Psi), dan φ (Phi) sisa asid amino.
 Skim dan model bola dan rod alfa helix protein (struktur sekunder). Diambil dan diedit dari: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)].
Skim dan model bola dan rod alfa helix protein (struktur sekunder). Diambil dan diedit dari: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Interaksi yang ditubuhkan di antara rantai sisi sisa asid amino dapat membantu menstabilkan atau, sebaliknya, menjejaskan struktur protein sekunder. Struktur sekunder dapat dilihat dalam perlembagaan banyak protein berserabut.
[TOC]
Sejarah
Dalam dekad 30 -an abad yang lalu, William Atsbury, bekerja dengan x -rays, mendapati bahawa protein rambut, serta pancang porcospin, yang dimiliki dalam segmen struktur mereka yang diulangi secara kerap.
Berdasarkan hasil ini, dan dengan pengetahuan tentang kepentingan ikatan hidrogen dalam orientasi kumpulan kutub ikatan peptida, William Pauling dan kolaborator, akibatnya mereka menentukan secara hipotetis kemungkinan penyesuaian tetap yang dapat dimiliki oleh protein.
Pauling dan kolaboratornya, pada tahun 1950 -an, menubuhkan beberapa postulat yang perlu dipenuhi dalam hubungan rantaian polipeptida, termasuk, dan pada mulanya, bahawa dua atom tidak dapat mendekati satu sama lain pada jarak kurang dari jarak mereka dari masing Radio Van der Waals.
Mereka juga menunjukkan bahawa pautan bukan kovalen diperlukan untuk menstabilkan lipatan rantai.
Boleh melayani anda: pembiakan seksualBerdasarkan postulates dan pengetahuan terdahulu ini, dan menggunakan model molekul, mereka berjaya menggambarkan beberapa penyesuaian protein yang tetap, termasuk, yang kemudiannya menunjukkan bahawa mereka adalah sifat yang paling kerap, seperti kipas α dan lamina β β β.
Propeller α
Ia adalah struktur sekunder yang paling mudah, di mana rantai polipeptida disusun dalam bentuk yang digulung dan dipadatkan di sekitar paksi khayalan. Di samping itu, rantai sampingan setiap asid amino menonjol dari kerangka heliks ini.
Asid amino, dalam kes ini, diatur dengan cara yang mereka mempunyai sudut pautan ψ Dari -45 ° hingga -50 °, dan φ daripada -60 °. Sudut ini merujuk kepada hubungan antara karbon α dan oksigen karbonil dan ikatan antara nitrogen dan karbon α bagi setiap asid amino, masing -masing.
Di samping itu, saintis telah menentukan bahawa untuk setiap giliran α kipas, 3.6 sisa asid amino dibentangkan dan giliran ini sentiasa dextrogyry dalam protein. Di samping menjadi struktur yang paling mudah, kipas α adalah bentuk utama dalam α-queratinas dan kira-kira 25% asid amino protein globular mengamalkan struktur ini.
Kipas α stabil terima kasih kepada hakikat bahawa ia membentangkan banyak jambatan hidrogen. Oleh itu, tiga atau empat pautan jenis ini ditubuhkan pada setiap giliran kipas.
Di jambatan hidrogen, nitrogen ikatan peptida dan atom oksigen kumpulan karbonil asid amino berikutnya berinteraksi, ke arah sisi terminal amino rantai itu.
Para saintis telah menunjukkan bahawa kipas α boleh dibentuk dengan rantai polipeptida yang dibentuk oleh asid L- atau D-amino, dengan keadaan bahawa semua asid amino mempunyai konfigurasi stereoisomera yang sama. Di samping itu, asid l-eamino semulajadi boleh membentuk α droord dengan kedua-dua kanan dan kiri.
Boleh melayani anda: immunoglobulin dWalau bagaimanapun, tidak semua polipeptida dapat membentuk kipas α yang stabil, kerana struktur utama mereka mempengaruhi kestabilan ini. Rantai R dari beberapa asid amino dapat menjejaskan struktur, menghalang pembentukan kipas α.
Lembaran β
Dalam lembaran β, atau lembaran β yang dilipat, setiap sisa asid amino mempunyai putaran 180 ° berhubung dengan residu asid amino sebelumnya. Dengan cara ini, ia diperoleh sebagai hasil bahawa rangka rantai polipétid dilanjutkan dan dalam bentuk zigzag atau akordion.
Rantai polipeptida berbentuk kord boleh diletakkan bersebelahan antara satu sama lain dan menghasilkan jambatan hidrogen linear antara kedua -dua rantai.
Dua rantai polipeptida bersebelahan boleh diatur selari, iaitu, kedua -duanya boleh berorientasikan dalam arah amino - karboksil, membentuk lembaran β selari; o Mereka boleh terletak di arah yang bertentangan, kemudian membentuk lembaran β antiparalla.
Rantai sisi sisa asid amino bersebelahan menonjol dari kerangka rantai ke arah yang bertentangan, menimbulkan corak bergantian. Beberapa struktur protein mengehadkan jenis asid amino struktur β.
Sebagai contoh, dalam protein padat yang dibungkus, asid amino rantai pendek, seperti glisin dan alanine pada permukaan hubungan mereka lebih kerap.
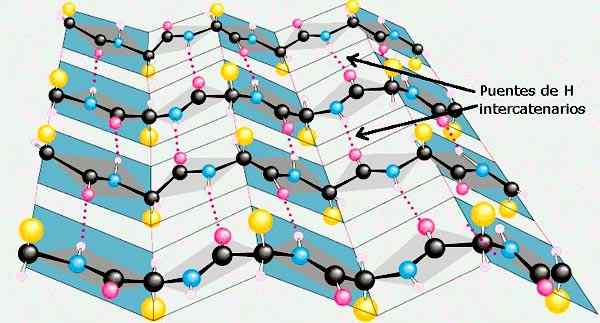 Lembaran β struktur sekunder protein. Diambil dan diedit dari: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)].
Lembaran β struktur sekunder protein. Diambil dan diedit dari: Preston Manor School + JFL [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Pengesahan struktur sekunder lain
Helix 310
Struktur ini dicirikan dengan menyampaikan 3 sisa asid amino setiap pusingan. Struktur ini telah diperhatikan dalam beberapa protein, tetapi tidak begitu kerap.
Helix π
Sementara itu, struktur ini mempunyai 4.4 sisa asid amino dari giliran lingkaran dan gelung pautan hidrogen 16 -elemen. Walaupun konfigurasi ini mungkin secara sterik, ia tidak pernah diperhatikan.
Boleh melayani anda: Agar kentang dextrose: asas, penyediaan dan penggunaanPenyebab yang mungkin ini boleh menjadi pusat berongga, terlalu besar untuk membolehkan prestasi pasukan van der Waals yang akan membantu menstabilkan struktur, dan bagaimanapun terlalu kecil untuk membolehkan laluan molekul air.
Struktur Superscundaria
Struktur supersecundary adalah kombinasi struktur sekunder α dan lembaran dilipat β β lembaran. Struktur ini boleh berlaku di banyak protein globular. Terdapat kemungkinan kombinasi yang mungkin, masing -masing mempunyai ciri -ciri tertentu.
Beberapa contoh struktur supersecundarias adalah: unit βαβ, di mana dua lembaran β selari dikaitkan dengan segmen kipas α; The unit αα, dicirikan oleh dua αices berturut -turut tetapi dipisahkan oleh segmen bukan helik, yang dikaitkan dengan keserasian rantai sampingannya.
Beberapa lembaran β boleh berundur dengan sendirinya memberikan konfigurasi Barrel β, manakala lembaran β antipaallala ditarik balik sama ada ia merupakan struktur supersecundaria yang dipanggil Kunci Yunani.
Rujukan
- C.K. Mathews, k.Dan. Van hold & k.G. Ahern (2002). Biokimery. Edisi ke -3. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, ms. Mayes, d.C. Granner & v.W. Rodwell (1996). Biokimer Harper. Appleton & Lange.
- J.M. Berg, j.L. Tymoczko & l. Stryer (2002). Biokimery. Edisi ke -5. W. H. Freeman dan Syarikat.
- J.Koolman & k.-H. Roehm (2005). Atlas warna biokimia. Edisi ke -2. Thieme.
- Ke. Lehninger (1978). Biokimia. Edisi omega, s.Ke.
- T. McKee & J.R. McKee (2003). Biokimia: Asas Molekul Kehidupan. 3Rd Edisi. The McGraw-Hiii Companies, Inc.

