Sejarah Eksperimen Rutherford, Keterangan dan Kesimpulan
- 1692
- 263
- Julius Dibbert
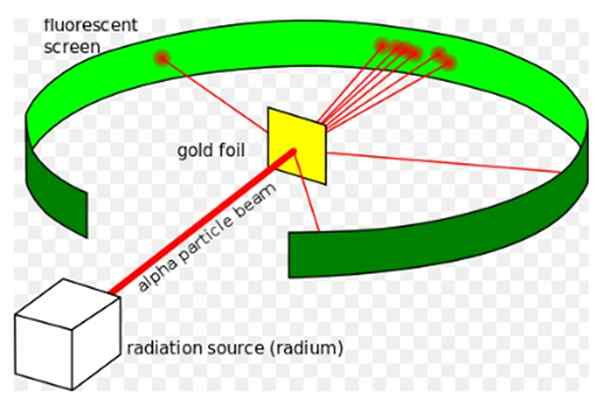
Dia Eksperimen Rutherford, Dijalankan antara tahun 1908 dan 1913, ia terdiri daripada membombardir lembaran emas nipis 0.0004 mm tebal, dengan zarah alfa dan menganalisis corak penyebaran yang zarah -zarah ini ditinggalkan pada skrin pendarfluor.
Sebenarnya, Rutherford menjalankan banyak eksperimen, menyempurnakan butiran lebih banyak lagi. Setelah menganalisis hasilnya dengan teliti, dua kesimpulan yang sangat penting telah diturunkan:
-Beban positif atom tertumpu di rantau yang dipanggil teras.
-Nukleus atom ini sangat kecil berbanding saiz atom.
 Rajah 1. Percubaan Rutherford. Sumber: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Rajah 1. Percubaan Rutherford. Sumber: Wikimedia Commons. Kurzon [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Ernest Rutherford (1871-1937) adalah seorang ahli fizik yang dilahirkan di New Zealand, yang bidang minatnya adalah radioaktif dan sifat perkara. Radioaktiviti adalah fenomena baru -baru ini ketika Rutherford memulakan eksperimennya, ia telah ditemui oleh Henri Becquerel pada tahun 1896.
Pada tahun 1907 Rutherford berpindah ke University of Manchester di England untuk mengkaji struktur atom, menggunakan zarah alfa ini sebagai probe untuk meneliti bahagian dalam struktur kecil seperti itu. Ahli fizik Hans Geiger dan Ernest Marsden mengiringi dia dalam tugas.
Mereka menempatkan harapan untuk melihat bagaimana zarah alfa, yang merupakan atom helium terionisasi berganda, berinteraksi dengan atom emas yang unik, untuk memastikan bahawa sisihan yang dialami hanya disebabkan oleh daya elektrik.
Walau bagaimanapun, sebahagian besar zarah alfa menyeberangi lembaran emas yang menderita hanya sisihan kecil.
Fakta ini dalam persetujuan keseluruhan dengan model atom Thomson, bagaimanapun, mengejutkan para penyelidik, peratusan kecil zarah alfa mengalami sisihan yang luar biasa.

Dan peratusan zarah yang lebih kecil kembali, melantun sepenuhnya ke belakang. Mengapa hasil yang tidak dijangka ini?
[TOC]
Penerangan dan Kesimpulan Percubaan
Malah, zarah alfa yang digunakan Rutherford sebagai siasatan, adalah nukleus helium, dan pada masa itu hanya diketahui bahawa zarah -zarah ini mempunyai caj positif. Hari ini diketahui bahawa zarah alfa terdiri daripada dua proton dan dua neutron.
Zarah alfa dan beta telah dikenal pasti oleh Rutherford sebagai dua jenis radiasi dari uranium. Zarah alfa, jauh lebih besar daripada elektron, mempunyai cas elektrik positif, sementara zarah beta boleh menjadi elektron atau positron.
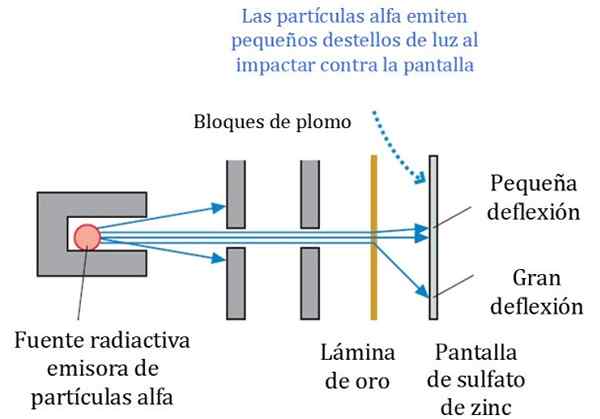 Rajah 2. Skim terperinci Rutherford, Geiger dan Marsden Eksperimen. Sumber: r. Knight. Fizik untuk saintis dan kejuruteraan: Pendekatan Strategi. Pearson.
Rajah 2. Skim terperinci Rutherford, Geiger dan Marsden Eksperimen. Sumber: r. Knight. Fizik untuk saintis dan kejuruteraan: Pendekatan Strategi. Pearson. Rajah 2 menunjukkan skema percubaan yang dipermudahkan. Rasuk zarah alfa berasal dari sumber radioaktif. Geiger dan Marsden menggunakan gas radon sebagai pemancar.
Blok plumbum digunakan untuk mengarahkan radiasi ke lembaran emas dan menghalang mereka daripada berhenti terus ke skrin pendarfluor. Lead adalah bahan yang menyerap radiasi.
Boleh melayani anda: centrioles: fungsi dan ciriKemudian rasuk yang diarahkan itu, dipengaruhi pada lembaran emas nipis dan sebahagian besar zarah mengikuti jalan mereka ke skrin sulfat zink pendarfluor, di mana mereka meninggalkan jejak cahaya kecil. Geiger bertanggungjawab mengira mereka satu persatu, walaupun mereka kemudian merancang peranti yang melakukannya.
Hakikat bahawa beberapa zarah mengalami pesongan kecil tidak mengejutkan Rutherford, Geiger dan Marsden. Lagipun, di atom terdapat caj positif dan negatif yang menghasilkan kekuatan pada zarah alfa, tetapi kerana atom adalah neutral, yang mereka sudah tahu, penyimpangan harus kecil.
Kejutan eksperimen adalah bahawa beberapa zarah positif telah melantun secara langsung.
Kesimpulan
Sekitar 1 dalam 8000 zarah alfa mengalami pesongan pada sudut lebih besar daripada 90º. Sedikit, tetapi cukup untuk mempersoalkan beberapa perkara.
Model atom di Boga adalah pudin Thomson, bekas profesor Rutherford di makmal Cavendish, tetapi dia tertanya -tanya apakah idea atom tanpa nukleus dan dengan elektron yang tertanam sebagai kismis, itu betul.
Kerana ternyata ini pesongan besar dari zarah alfa dan fakta bahawa beberapa dapat kembali, ia hanya dapat dijelaskan jika atom mempunyai teras kecil, berat dan positif. Rutherford mengandaikan bahawa hanya daya tarikan elektrik dan penolakan, seperti yang ditunjukkan oleh undang -undang Coulomb, bertanggungjawab terhadap sebarang penyelewengan.
Apabila beberapa zarah alfa secara langsung menghampiri nukleus dan kerana daya elektrik berbeza dengan persegi terbalik jarak, mereka merasakan penolakan yang menyebabkan mereka penyebaran sudut besar atau sisihan ke belakang.
Untuk memastikan, Geiger dan Marsden mengalami lembaran pengebom.
Apabila memperoleh hasil yang sama, Rutherford yakin bahawa beban positif dalam atom harus terletak di dalam nukleus, dan tidak tersebar dalam jumlah keseluruhannya, seperti yang dikatakan oleh Thomson dalam modelnya.
Sebaliknya, seperti sebahagian besar zarah alfa, ia berlaku tanpa menyimpang, teras harus sangat, sangat kecil berbanding dengan saiz atom. Walau bagaimanapun, nukleus ini terpaksa menumpukan sebahagian besar jisim atom.
Pengaruh dalam model atom
Hasilnya sangat terkejut dengan Rutherford, yang mengisytiharkan pada persidangan di Cambridge: "... ia seperti ketika anda menembak peluru meriam 15 -inci terhadap sekeping kertas sutera dan projektil melantun terus kepada anda dan memukul anda".
Boleh melayani anda: 10 fungsi rangka kerja teori siasatanOleh kerana keputusan ini tidak dapat dijelaskan oleh model atom Thomson, Rutherford mencadangkan bahawa atom itu dibentuk oleh nukleus, sangat kecil, sangat besar dan positif dimuatkan. Elektron tetap menggambarkan orbit di sekelilingnya, yang sistem miniatur solar.
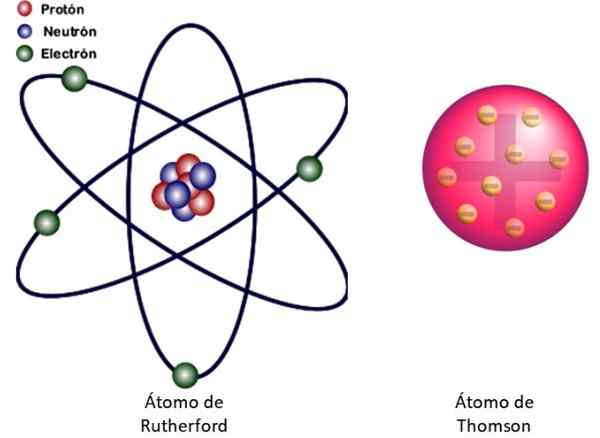 Rajah 3. Ke kiri model atom Rutherford dan di sebelah kanan model jenis Buddin Thomson. Sumber: Wikimedia Commons. Gambar kiri: JCYMC90 [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Rajah 3. Ke kiri model atom Rutherford dan di sebelah kanan model jenis Buddin Thomson. Sumber: Wikimedia Commons. Gambar kiri: JCYMC90 [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Ini adalah model nuklear atom yang ditunjukkan dalam Rajah 3 ke kiri. Sebagai elektron sangat, sangat kecil, ternyata atom hampir semuanya .. . kosong! Oleh itu, kebanyakan zarah alfa melintasi lembaran tanpa menyimpang sahaja.
Dan analogi dengan sistem suria kecil sangat berjaya. Nukleus atom memainkan peranan matahari, yang mengandungi hampir seluruh jisim ditambah beban positif. Elektron mengorbit di sekeliling mereka seperti planet dan membawa beban negatif. Set itu secara elektrik berkecuali.
Mengenai pengedaran elektron dalam atom, percubaan Rutherford tidak menunjukkan apa -apa. Boleh dianggap bahawa zarah alfa akan mempunyai beberapa interaksi dengan mereka, tetapi jisim elektron terlalu kecil dan tidak dapat mengalihkan zarah dengan ketara.
Kekurangan dalam model Rutherford
Masalah dengan model atom ini adalah tingkah laku elektron.
Jika ini tidak statik, tetapi mengorbit nukleus atom dalam orbit bulat atau elips, yang diarahkan oleh tarikan elektrik, mereka akan bergegas ke nukleus.
Ini kerana elektron dipercepatkan kehilangan tenaga, dan jika itu berlaku, ia akan menjadi keruntuhan atom dan perkara.
Nasib baik ini bukan apa yang berlaku. Terdapat jenis kestabilan dinamik yang mengelakkan keruntuhan. Model atom seterusnya, selepas Rutherford, adalah Bohr, yang memberikan beberapa jawapan kepada mengapa keruntuhan atom tidak berlaku.
Proton dan neutron
Rutherford terus melakukan eksperimen penyebaran. Antara tahun 1917 dan 1918, beliau dan pembantunya William Kay memilih bom.
Ia terkejut lagi, ketika mengesan nukleus hidrogen. Ini adalah persamaan tindak balas, transmutasi nuklear buatan pertama tidak pernah dicapai:
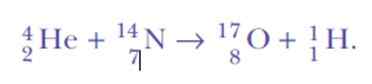 Nah, jika zarah alfa adalah nukleus helium, di mana nukleus hidrogen berasal dari?
Nah, jika zarah alfa adalah nukleus helium, di mana nukleus hidrogen berasal dari?
Jawapannya ialah: dari nitrogen yang sama. Rutherford telah ditugaskan untuk hidrogen atom nombor 1, kerana menjadi elemen paling mudah dari semua: teras positif dan elektron negatif.
Rutherford telah menemui zarah asas yang dipanggilnya proton, nama yang diperoleh dari perkataan Yunani ke Pertama. Dengan cara ini, proton adalah penyusun penting bagi setiap nukleus atom.
Boleh melayani anda: kelantanganKemudian, menjelang tahun 1920, Rutherford mencadangkan bahawa harus ada zarah neutral dan dengan jisim yang sangat mirip dengan proton. Dia memanggil zarah ini Neutron dan merupakan sebahagian daripada hampir semua atom yang diketahui. Fizik James Chadwick akhirnya mengenalinya pada tahun 1932.
Bagaimana model skala atom hidrogen?
Atom hidrogen adalah, seperti yang telah kita katakan, yang paling mudah dari semua. Walau bagaimanapun, tidak mudah untuk menghuraikan model untuk atom ini.
Penemuan berturut -turut menimbulkan fizik kuantum dan teori keseluruhan yang menggambarkan fenomena tahap atom. Semasa proses ini, model atom juga berkembang. Tetapi mari kita lihat persoalan saiz sedikit:
Atom hidrogen mempunyai nukleus yang terdiri daripada proton (positif) dan mempunyai elektron tunggal (negatif).
Radius atom hidrogen telah dianggarkan pada 2.1 x 10-10 m, sementara proton adalah 0.85 x 10 -lima belas m atau 0.85 femtometers. Nama unit kecil ini disebabkan oleh Enrico Fermi dan banyak digunakan ketika bekerja pada skala ini.
Nah, kota antara jejari atom dan nukleus adalah urutan 105 M, iaitu atom 100,000 kali lebih besar daripada nukleus!.
Walau bagaimanapun, kita harus ingat bahawa dalam model kontemporari, berdasarkan mekanik kuantum, elektron melibatkan nukleus dalam jenis awan yang dipanggil orbital (orbital bukan orbit) dan elektron, pada skala atom, tidak tepat waktu.
Sekiranya atom hidrogen melebar secara meluas - ke saiz medan bola sepak, maka nukleus yang terdiri daripada proton positif akan menjadi saiz semut di tengah lapangan, sementara elektron negatif akan menjadi seperti hantu, bertaburan di seluruh padang dan mengelilingi nukleus positif.
Model atom hari ini
Model atom "planet" ini sangat berakar dan imej yang kebanyakan orang mempunyai dari atom, kerana ia sangat mudah untuk digambarkan. Walau bagaimanapun, Ianya bukan Model yang diterima hari ini dalam bidang saintifik.
Model atom kontemporari berdasarkan mekanik kuantum. Dia menyatakan bahawa elektron dalam atom tidak sedikit titik dengan beban negatif yang mengikuti orbit yang tepat, seperti yang dibayangkan oleh Rutherford.
Sebaliknya, elektron adalah bertaburan Di kawasan, di sekitar nukleus positif, yang dipanggil orbital atom. Dari dia kita boleh tahu kebarangkalian untuk bertemu di satu negeri atau yang lain.
Walaupun begitu, model Rutherford bermakna kemajuan besar dalam pengetahuan struktur dalaman atom. Dan mereka menyerbu jalan bagi lebih banyak penyelidik untuk terus menyempurnakannya.
Rujukan
- Andriessen, m. 2001. Kursus HSC. Fizik 2. Sains Jacaranda HSC.
- Arfken, g. 1984. Fizik Universiti. Akhbar Akademik.
- Knight, r. 2017. Fizik untuk saintis dan kejuruteraan: Pendekatan Strategi. Pearson.
- Openlab Fizik. Eksperimen Rutherford-Geiger-Marsden. Pulih dari: Physicsopenlab.org.
- Rex, a. 2011. Asas Fizik. Pearson.
- Tyson, t. 2013. Eksperimen Penyebaran Rutherford. Pulih dari: 122.Fizik.Ucdavis.Edu.
- Xaktly. Eksperimen Rutherford. Pulih dari: xaktly.com.
- Wikipedia. Eksperimen Rutherford. Pulih dari: ia adalah.Wikipedia.org.
- « Ciri pemakanan autotroph, peringkat, jenis, contoh
- Biografi Anna Freud, Teori, Mekanisme Pertahanan, Berfungsi »

