Faktor Kampat Cara Mengira, Contoh dan Latihan
- 5062
- 835
- Mr. Tracy Parisian
Dia Faktor Kampat Z, o Faktor mampatan untuk gas, adalah nilai tanpa dimensi (tanpa unit) yang diperkenalkan sebagai pembetulan dalam persamaan status gas ideal. Dengan cara ini model matematik menyerupai tingkah laku gas yang diperhatikan lebih banyak.
Dalam gas yang ideal, persamaan negeri yang berkaitan dengan pembolehubah p (tekanan), v (volum) dan t (suhu) adalah: P.V sesuai = n.R.T dengan n = bilangan tahi lalat dan r = pemalar gas ideal. Menambah pembetulan faktor pemampatan z, persamaan ini berubah menjadi:
P.V = z.n.R.T
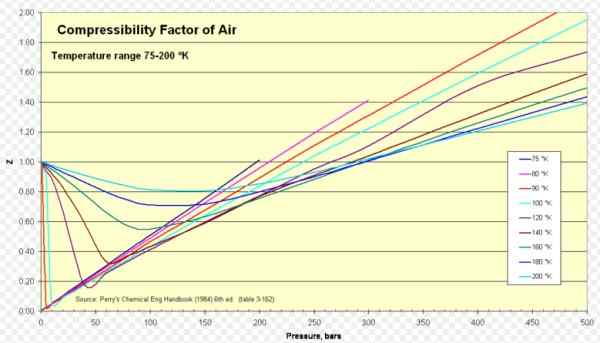
 Rajah 1. Faktor Kampat Udara. Sumber: Wikimedia Commons. https: // muat naik.Wikimedia.org/wikipedia/commons/8/84/mampatan_factor_of_air_75-200_k.Png.
Rajah 1. Faktor Kampat Udara. Sumber: Wikimedia Commons. https: // muat naik.Wikimedia.org/wikipedia/commons/8/84/mampatan_factor_of_air_75-200_k.Png. [TOC]
Cara Mengira Faktor Kampat?
Dengan mengambil kira bahawa jumlah molar adalah Vsejuk = V/n, Anda mempunyai jumlah molar sebenar:
P . Vnyata = Z. R. T → Z = PV nyata/Rt
Oleh kerana faktor mampatan z bergantung kepada keadaan gas, ia dinyatakan sebagai fungsi tekanan dan suhu:
Z = z (p, t)
Membandingkan dua persamaan pertama, diperhatikan bahawa jika bilangan tahi lalat N adalah sama dengan 1, jumlah molar gas sebenar berkaitan dengan gas ideal melalui:
Vnyata / Vsesuai = Z → v nyata = Z vsesuai
Apabila tekanan melebihi 3 atmosfera kebanyakan gas berhenti berkelakuan sebagai gas ideal dan jumlah sebenar berbeza dengan ketara dari ideal.
Ini menyedari dalam eksperimen ahli fizik Belanda Johannes van der Waals (1837-1923), yang menyebabkannya mencipta model yang lebih baik disesuaikan dengan hasil praktikal daripada persamaan gas ideal: persamaan negeri van der waals.
Boleh melayani anda: Natrium oksalat (Na2C2O4): Struktur, sifat, kegunaan, risikoContoh
Menurut persamaan P.Vnyata= Z.n.Rt, Untuk gas yang ideal, z = 1. Walau bagaimanapun, dalam gas sebenar, dengan meningkatkan tekanan juga nilai z. Ini masuk akal kerana pada molekul gas tekanan yang lebih besar mempunyai lebih banyak peluang untuk bertembung, oleh itu daya penolakan meningkat dan dengan itu jumlahnya.
Sebaliknya untuk mengurangkan tekanan, molekul bergerak dengan kebebasan yang lebih besar dan daya penolakan berkurangan. Oleh itu jumlah yang lebih rendah dijangka. Bagi suhu, apabila ia meningkat, z menurun.
Seperti yang diperhatikan oleh Van der Waals, di sekitar titik kritikal yang dipanggil, tingkah laku gas sangat dialihkan dari gas yang ideal.
Titik kritikal (tc, Pc) dari mana -mana bahan adalah tekanan dan nilai suhu yang menentukan tingkah laku mereka sebelum perubahan fasa:
-Tc Ia adalah suhu di atas yang gas yang dimaksudkan tidak dicairkan.
-Pc Adalah tekanan minimum yang diperlukan untuk mencairkan gas pada suhu tc
Setiap gas mempunyai titik kritikal tersendiri, bagaimanapun, menentukan suhu dan tekanan yang dikurangkan tr Dan pr seperti berikut:
Pr = P / pc
Vr = V /vc
Tr = T /tc
Diperhatikan bahawa gas terkurung dengan identik Vr dan Tr Menerapkan tekanan yang sama Pr. Atas sebab ini, jika z adalah grafik bergantung pada Pr hingga yang sama Tr, Setiap titik dalam lengkung itu adalah sama bagi mana -mana gas. Ini dipanggil Prinsip Negara yang Bersama.
Faktor mampat dalam gas ideal, udara, hidrogen dan air
Berikut adalah lengkung mampat untuk pelbagai gas pada suhu yang dikurangkan. Kemudian beberapa contoh z untuk beberapa gas dan prosedur untuk mencari z dengan menggunakan lengkung.
Boleh melayani anda: hidrogen: sejarah, struktur, sifat dan kegunaan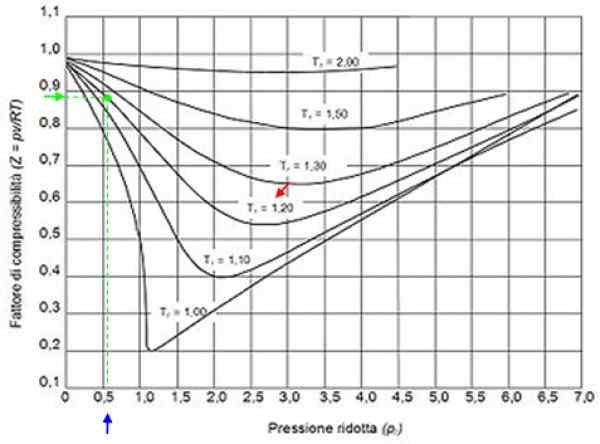 Rajah 2. Grafik faktor grafik untuk gas mengikut tekanan pengurangan. Sumber: Wikimedia Commons.
Rajah 2. Grafik faktor grafik untuk gas mengikut tekanan pengurangan. Sumber: Wikimedia Commons. Gas yang ideal
Gas ideal mempunyai z = 1, seperti yang dijelaskan pada awalnya.
Udara
Untuk udara z adalah kira -kira 1 dalam pelbagai suhu dan tekanan yang luas (lihat Rajah 1), di mana model gas ideal memberikan hasil yang sangat baik.
Hidrogen
Z> 1 untuk semua tekanan.
Air
Untuk mencari z air, nilai titik kritikal diperlukan. Titik kritikal air ialah: Pc = 22.09 mpa dan tc= 374.14 ° C (647.3 k). Sekali lagi perlu mengambil kira bahawa faktor kebolehmampatan z bergantung pada suhu dan tekanan.
Sebagai contoh, katakan anda ingin mencari z dari air pada 500 ºC dan 12 MPa. Kemudian yang pertama adalah untuk mengira suhu yang dikurangkan, yang mana darjah Celsius mesti diserahkan kepada Kelvin: 50 ºC = 773 K:
Tr = 773/647.3 = 1.2
Pr = 12/22.09 = 0.54
Dengan nilai -nilai ini kita cari dalam graf angka lengkung yang sepadan dengan tr = 1.2, ditunjukkan dengan anak panah merah. Kemudian kita melihat paksi mendatar nilai pr lebih dekat dengan 0.54, ditandai dengan warna biru. Sekarang kita melukis menegak sehingga memintas lengkung Tr = 1.2 dan akhirnya ia diproyeksikan dari titik itu ke paksi menegak, di mana kita membaca nilai anggaran z = 0.89.
Latihan yang diselesaikan
Latihan 1
Terdapat sampel gas pada suhu 350 K dan tekanan 12 atmosfera, dengan jumlah molar 12 % lebih tinggi daripada yang diramalkan oleh undang -undang gas ideal. Kira:
a) faktor mampatan z.
b) jumlah gas molar.
Boleh melayani anda: Reaksi yang tidak dapat dipulihkan: Ciri dan Contohc) Mengikut keputusan di atas, menunjukkan yang merupakan daya dominan dalam sampel gas ini.
Data: r = 0.082 l.ATM/mol.K
Penyelesaian kepada
Mengetahui bahawa v nyata adalah 12 % lebih tinggi daripada Vsesuai :
Vnyata = 1.12vsesuai
Z = v nyata / Vsesuai = 1.12
Penyelesaian b
P . Vnyata = Z. R. T → Vnyata = (1.12 x 0.082 x 350/12) l /mol = 2.14 l/mol.
Penyelesaian c
Daya penolakan adalah yang mendominasi, kerana jumlah sampel meningkat.
Latihan 2
Terdapat 10 tahi lalat etana yang terkurung dalam jumlah 4.86 L A 27 ºC. Cari tekanan yang dikenakan oleh Ethane dari:
a) model gas yang ideal
b) persamaan van der waals
c) Cari faktor mampatan dari hasil sebelumnya.
Data untuk etana
Koefisien van der Waals:
A = 5.489 DM6. Atm . mol-2 dan b = 0.06380 DM3. mol-1.
Tekanan kritikal: 49 atm. Suhu Kritikal: 305 K
Penyelesaian kepada
Suhu diserahkan kepada Kelvin: 27 º C = 27 +273 k = 300 k, juga ingat bahawa 1 liter = 1 l = 1 dm3.
Kemudian data yang disediakan dalam persamaan gas ideal diganti:
P.V = n.R.T → P = (10 x 0.082 x 300/4.86 l) atm = 50.6 atm
Penyelesaian b
Persamaan negeri van der Waals adalah:
Di mana a dan b adalah pekali yang diberikan oleh pernyataan. Semasa membersihkan p:
Penyelesaian c
Kami mengira tekanan dan suhu yang dikurangkan:
Pr = 35.2/49 = 0.72
Tr = 300/305 = 0.98 ≈ 1
Dengan nilai -nilai ini, nilai z dalam graf Rajah 2 dicari, mendapati bahawa z adalah kira -kira 0.7.
Rujukan
- Atkins, ms. 1999. Kimia Fizikal. Edisi Omega.
- Cengel, dan. 2012. Thermodynamics. 7ma Edisi. McGraw Hill.
- Engel, t. 2007. Pengenalan kepada fizikokimia: termodinamik. Pearson.
- Levine, i. 2014. Prinsip Fizik-Chemistry. 6th. Edisi. McGraw Hill.
- Wikipedia. Faktor Kampat. Diperoleh dari: dalam.Wikipedia.org.

