Ciri -ciri fenilalanin, fungsi, biosintesis, makanan
- 4439
- 1380
- Delbert Dare
The Phenylalanine (Phe, f) adalah salah satu daripada 9 asid amino penting, iaitu, ia tidak disintesis secara endogen oleh tubuh manusia. Di rantaian sampingannya, asid amino ini mempunyai sebatian aromatik bukan -polar yang mencirikannya.
Asid propionik phenylalanine, atau β-phenyl-α-amino pertama kali dikenal pasti pada tahun 1879 oleh saintis j. H. Schulze dan m. Barbieri dari tumbuhan dari keluarga Fabaceae yang dikenali sebagai Lupinus luteus atau "altramuz kuning".
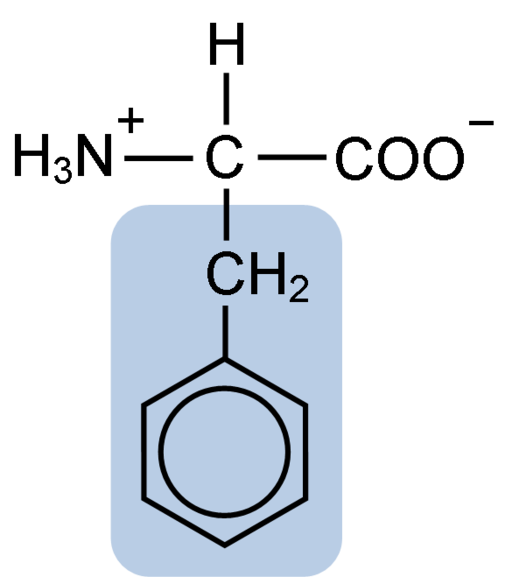
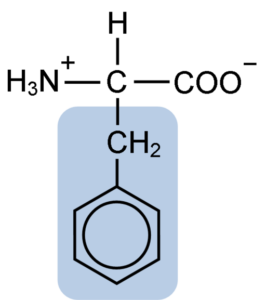 Struktur kimia phenylalanine asid amino (sumber: clavecin [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons)
Struktur kimia phenylalanine asid amino (sumber: clavecin [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons) Dipéptide L-Fenylalanin-l-aspartil dikenali sebagai Aspartame atau "Nutrasweet", yang merupakan pemanis yang dihasilkan secara sintetik dan digunakan secara meluas di restoran dan kedai kopi, biasanya untuk meminum minuman seperti kopi, teh, lemon dan lain-lain minuman.
Dalam buah-buahan dengan ciri-ciri yang dipanaskan, penukaran L-phenylalanine dalam ester fenolik seperti eugenol dan derivatif metilikalnya adalah apa yang menimbulkan bau bunga manis atau serupa dengan madu biasa pisang dan buah pisang apabila matang.
Bergantung pada bentuk, phenylalanine boleh mempunyai rasa yang berbeza. Contohnya, bentuk L-fenylalanine mempunyai aroma dan rasa manis, manakala D-Fenylalanine sedikit pahit dan biasanya too.
Oleh kerana ia mempunyai watak hidrofobik yang kuat, phenylalanine adalah salah satu unsur utama banyak resin, seperti polistirena. Resin ini, ketika bersentuhan dengan molekul air, membentuk struktur perlindungan atau liputan yang dikenali sebagai "clatrato".
Gen -gen yang menyandarkan laluan biosintesis fenilalanin digunakan oleh ahli botani sebagai jam tangan evolusi, kerana didapati bahawa ini berkaitan dengan kepelbagaian morfologi tumbuhan terestrial.
[TOC]
Ciri -ciri dan struktur
Saham fenilalanin dengan semua asid amino kumpulan karboksil (-COH), kumpulan amino (-NH2), dan atom hidrogen (-H) yang dilampirkan pada atom karbon pusat yang dikenali sebagai karbon α. Di samping itu, sudah tentu, ia mempunyai rantaian sampingan atau kumpulan r ciri.
Phenylalanine adalah salah satu daripada tiga asid amino yang mempunyai cincin aromatik atau benzena sebagai substituen dalam rantai sisi. Sebatian ini tidak kutub dan, oleh itu, sangat hidrofobik.
Asid amino yang dipersoalkan terutamanya hidrofobik, kerana, tidak seperti tirosin dan tryptophan (dua asid amino yang lain dengan cincin aromatik) tidak mempunyai kumpulan amino atau hidroksil yang bersatu dengan cincin benzenya.
Kumpulan fenilalanin aromatik, benzoik atau sandylalanine mempunyai struktur benzena biasa: cincin kitaran disusun oleh 6 atom karbon yang mempunyai resonans di antara mereka kerana kehadiran tiga ikatan berganda dan tiga ikatan mudah di dalamnya.
Tidak seperti Tyrosine dan Tryptophan, yang boleh memperoleh beban positif dan negatif, masing -masing, fenilalanin mengekalkan beban neutralnya, kerana cincin benzena tidak terionisasi dan banyak kumpulan karboksil dan amino meneutralkan antara satu sama lain.
Klasifikasi
Asid amino diklasifikasikan ke dalam kumpulan yang berlainan mengikut ciri -ciri yang mempunyai rantaian sampingan atau kumpulan R mereka, kerana mereka boleh bervariasi dalam saiz, struktur, kumpulan berfungsi dan bahkan dalam cas elektrik.
Seperti yang disebutkan, phenylalanine diklasifikasikan dalam kumpulan asid amino aromatik, bersama dengan tirosin dan tryptophan. Semua sebatian ini mempunyai cincin aromatik dalam struktur mereka, bagaimanapun, Tyrosine dan Tryptophan mempunyai kumpulan pengionan dalam substituen kumpulan R mereka.
Boleh melayani anda: spesiasi allopatric: konsep, proses dan contohCiri -ciri penyerapan cahaya protein pada panjang gelombang 280 nm disebabkan oleh kehadiran asid amino yang diklasifikasikan dalam kumpulan fenilalanin, kerana mereka mudah menyerap cahaya ultraviolet melalui cincin aromatik mereka.
Walau bagaimanapun, telah ditunjukkan bahawa fenilalanin menyerap dalam perkadaran yang jauh lebih rendah daripada tirosin dan tryptophan, jadi dalam analisis beberapa protein penyerapannya boleh diramalkan.
Stereokimia
Semua asid amino mempunyai karbon quiral pusat, yang mempunyai empat atom atau kumpulan bersatu dan, seperti yang telah dikatakan, atom ini dikenal pasti sebagai karbon α. Berdasarkan karbon ini, sekurang -kurangnya dua stereoisomer setiap asid amino boleh didapati.
Stereoisomer adalah molekul dengan imej specular, yang mempunyai formula molekul yang sama, tetapi itu tidak bertindih antara satu sama lain seperti, sebagai contoh, tangan dan kaki. Sebat.
Adalah penting untuk mengulas bahawa perbezaan antara bentuk D-phenylalanine dan L-fenylalanine adalah kunci untuk memahami metabolisme asid amino ini dalam badan vertebrata.
Bentuk L-phenylalanine dimetabolisme dan dieksploitasi untuk pembinaan protein sel, manakala D-fenylalanine telah dijumpai di dalam aliran darah sebagai agen perlindungan terhadap spesies oksigen reaktif (ROS).
Fungsi
Pada tahun 90 -an, difikirkan bahawa phenylalanine hanya dalam beberapa spesies tumbuhan. Walau bagaimanapun, hari ini diketahui bahawa ia terdapat di hampir semua domain hidrofobik protein, sebenarnya, fenilalanin adalah komponen utama spesies kimia aromatik protein.
Dalam tumbuhan, fenilalanin adalah komponen penting dari semua protein; Di samping itu, ia adalah salah satu prekursor metabolit sekunder seperti phenylpropanoids (yang merupakan sebahagian daripada pigmen) molekul pertahanan, flavonoid, biopolimer seperti lignin dan suberine, antara lain.
Phenylalanine adalah struktur asas untuk membentuk banyak molekul yang mengekalkan homeostasis neuron, antaranya peptida seperti vasopressin, melanotropin dan encephalin. Di samping itu, asid amino ini terlibat secara langsung dalam sintesis hormon adrenokortopik (ACTH).
Seperti kebanyakan asid amino protein, phenylalanine adalah sebahagian daripada kumpulan asid amino ketogenik dan glukogenik, kerana ia menyediakan kerangka karbon perantara kitaran Krebs, yang diperlukan untuk metabolisme tenaga sel dan badan.
Apabila berlebihan, phenylalanine diubah menjadi tirosin dan seterusnya menjadi fumarate, perantara kitaran Krebs.
Biosintesis
Phenylalanine adalah salah satu daripada beberapa asid amino yang tidak dapat disintesis oleh kebanyakan organisma vertebrata. Pada masa ini, hanya laluan biosintetik yang dikenali untuk asid amino ini dalam organisma prokariotik, dalam ragi, dalam tumbuh -tumbuhan dan dalam beberapa spesies kulat.
Gen yang bertanggungjawab untuk laluan sintesis sangat dipelihara antara tumbuhan dan mikroorganisma, oleh itu, biosintesis mempunyai langkah yang sama di hampir semua spesies. Walaupun beberapa enzim di laluan hadir di beberapa haiwan, bagaimanapun, ini tidak dapat mensintesisnya.
Biosintesis fenilalanin dalam tumbuh -tumbuhan
Dalam spesies tumbuhan, phenylalanine disintesis melalui laluan metabolik dalaman dalam kloroplas yang dikenali sebagai "laluan predetenate". Laluan ini berkaitan dengan metabolik dengan "Laluan Shikimato", melalui L-Arogenato, salah satu metabolit yang dihasilkan semasa yang terakhir.
Boleh melayani anda: topoisomerase: apa, ciri, fungsi, jenisEnzim inhydratasa iswood memangkinkan tindak balas tiga langkah, di mana ia mengubah cincin aromatik arogenat ke cincin benzenik fenilalanin.
Enzim ini memangkinkan transaminasi, dehidrasi dan decarn.
Predeneat di sebelah fenilpyruvat yang terkumpul di dalam (cahaya) dari kloroplas, boleh ditukar kepada phenylalanine oleh reaksi yang dikatalkan oleh enzim aminotransferase propenato, yang memindahkan kumpulan amino kepada phenylpyruvate sehingga ia diiktiraf oleh arogenate dan enzate deHrate. ke sintesis fenilalanin.
Dalam beberapa spesies Pseudomonas Laluan alternatif telah diterangkan kepada profenato, yang menggunakan enzim yang berbeza tetapi substratnya untuk sintesis fenilalanin juga predetenate dan arogenat.
Degradasi
Phenylalanine boleh dimetabolisme dengan pelbagai cara dari makanan. Walau bagaimanapun, jumlah kajian yang paling banyak memberi tumpuan kepada destinasi mereka pada sel -sel tisu saraf pusat dan tisu buah pinggang.
Hati adalah organ utama untuk degradasi atau katabolisme fenilalanin. Dalam hepatosit terdapat enzim yang dikenali sebagai fenilalanin hidroksilase, yang mampu mengubah fenilalanin ke dalam tirosin atau dalam sebatian L-3,4-dihydroxyphenylalanine (L-DOPA).
Kompaun L-Dopa adalah pendahulu untuk norepinephrine, epinefrin dan hormon dan peptida lain dengan aktiviti dalam sistem saraf.
Phenylalanine boleh dioksidakan dalam sel-sel otak dengan menggunakan enzim hidroksilase tyrosine, yang bertanggungjawab untuk memangkinkan penukaran fenilalanin ke dopakrom dengan kehadiran asid l-askorbik.
Sebelum ini ia dianggap bahawa hidroksilase hidroksilase hydroxylase hanya tyrosine, bagaimanapun, didapati bahawa fenilalanin dan tirosin hidroksy dalam perkadaran yang sama dan hidroksilasi fenilalanin menghalang hydroxylation dari tyrosine.
Pada masa ini diketahui bahawa perkadaran tinggi tirosin menghalang aktiviti enzimatik hidroksilase tyrosine, tetapi yang sama tidak benar untuk fenilalanin.
Makanan kaya dengan fenilalanin
Semua makanan protein mempunyai kandungan fenilalanin antara 400 dan 700 mg untuk bahagian makanan yang ditelan. Makanan seperti minyak kod, tuna segar, lobster, tiram dan bivalve lain, mengandungi lebih daripada 1.000 mg setiap bahagian makanan yang ditelan.
Daging lembu dan babi juga mempunyai tahap fenilalanin yang tinggi. Walau bagaimanapun, mereka tidak setinggi kepekatan yang terdapat pada haiwan laut. Contohnya, produk bacon, daging lembu, hati, ayam dan tenusu mempunyai antara 700 dan 900 mg fenilalanin dengan jatah makanan.
Kacang seperti kacang tanah dan kacang pelbagai jenis adalah makanan lain yang mempunyai jumlah fenilalanin yang baik. Biji -bijian seperti kacang soya, kacang ayam dan kekacang lain dapat memberikan antara 500 dan 700 mg fenilalanin dengan bahagian.
Sebagai sumber alternatif, phenylalanine boleh dimetabolisme dari aspartam.
Faedah pengambilan anda
Phenylalanine terdapat dalam semua makanan protein yang kita makan. Penggunaan harian minimum untuk orang dewasa dan saiz purata adalah sekitar 1000 mg, yang diperlukan untuk sintesis protein, hormon seperti dopamin, neurotransmitter yang berbeza, dll.
Ia dapat melayani anda: apakah kepelbagaian alam semulajadi?Penggunaan asid amino yang berlebihan ini ditetapkan untuk orang yang mengalami gangguan kemurungan, sakit sendi dan penyakit kulit, kerana penggunaannya meningkatkan sintesis protein dan menghantar biomolekul seperti epinefrin, norepinefrin dan dopamin.
Sesetengah kajian mencadangkan bahawa fenilalanin yang digunakan secara berlebihan tidak menghasilkan peningkatan yang ketara dalam mana -mana gangguan ini, tetapi penukaran mereka ke dalam tirosin, yang juga digunakan untuk sintesis molekul isyarat, dapat menjelaskan kesan positif pada isyarat sel dalam sistem saraf di dalam sistem saraf.
Dadah yang dirumuskan terhadap sembelit mempunyai nukleus yang berstruktur oleh phenylalanine, tirosin dan tryptophan. Umumnya ubat-ubatan ini mengandungi campuran tiga asid amino dalam bentuk mereka-.
Gangguan kekurangan
Tahap fenilalanin darah adalah penting untuk mengekalkan fungsi otak yang betul, kerana phenylalanine, tirosin dan tryptophan adalah substrat untuk pemasangan neurotransmiter yang berbeza.
Sesetengah gangguan berkaitan, sebaliknya, dengan defisit dalam metabolisme asid amino ini, yang menghasilkan lebihannya, bukannya kekurangan.
Phenylcetonuria, penyakit keturunan yang luar biasa pada wanita, mempengaruhi hidroksilasi hepatik fenilalanin dan menjadikan tahap plasma asid amino berlebihan, sehingga apoptosis neuron disebabkan dan mempengaruhi perkembangan normal otak.
Jika seorang wanita dengan phenylcetonuria menjadi hamil, janin dapat membentangkan apa yang dikenali sebagai "Hyperphenylalaninemia" Sindrom Fetal ".
Ini kerana janin mempunyai kepekatan fenilalanin yang tinggi dalam darah (hampir dua kali ganda piawaian), yang asalnya berkaitan dengan ketiadaan fenilalanin hidroksilase hepatik janin, yang tidak berkembang sehingga 26 minggu kehamilan.
Sindrom janin oleh hyperphenylalaninemia ibu, menghasilkan microcephaly janin, pengguguran berulang, penyakit jantung dan juga kecacatan buah pinggang.
Rujukan
- Biondi, r., Brancorsini, s., Poli, g., Egidi, m. G., Capodicasa, e., Bottiglieri, l.,... & micu, r. (2018). Pengesanan dan pemotongan radikal hidroksil melalui hidroksilasi D-phenylalanine dalam cecair manusia. Talanta, 181, 172-181
- Cho, m. H., Korea, o. R., Yang, h., Bedgar, d. L., Laskar, d. D., Anterola, a. M.,... & kang, c. (2007). Biosintesis Phenylalanine dalam Arabidopsis Thalian Pengenalpastian dan ciri -ciri dehydratas argenat. Jurnal Kimia Biologi, 282 (42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, m. H. (2007). Sintesis dan fungsi tyrosine, phenylalanine, dan cathocholamine di otak. Jurnal Pemakanan, 137 (6), 1539S-1547S.
- Hou, j., Vázquez-González, m., Fadeev, m., Liu, x., Lavi, r., & Willner, i. (2018). Pengoksidaan yang dipangkin dan electrocatalyzed L-tyrosine dan L-phenylalanine kepada dopachrome oleh nanozim. Surat Nano, 18 (6), 4015-4022.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Prinsip Biokimia Lehninger. Macmillan.
- Perkins, r., & Vaida, v. (2017). Phenylalanine meningkatkan kebolehtelapan membran. Jurnal Persatuan Kimia Amerika, 139 (41), 14388-14391.
- Plimmer, r. H. Ke. (1912). Perlembagaan Kimia Protein (Vol. 1). Longmans, Hijau.
- Tensley, g. (2018). HealthLine. Diperoleh pada 5 September 2018, dari www.HealthLine.com/pemakanan/phenylalanine
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie, ke. R. (2013). Biosintesis shikimate dan phenylalanine dalam keturunan hijau. Frontiers in Plant Science, 4, 62.
- « Ciri -ciri isoleucine, fungsi, biosintesis, makanan
- Ciri -ciri Depan Kebangsaan, Objektif, Presiden »

