Ciri -ciri isoleucine, fungsi, biosintesis, makanan
- 3132
- 35
- Delbert Dare
The isoleucine (Ile, i) adalah salah satu daripada 22 asid amino yang hadir sebagai sebahagian daripada protein. Memandangkan hakikat bahawa tubuh manusia, seperti beberapa mamalia lain, tidak dapat mensintesisnya, isoleucine adalah antara 9 asid amino penting yang mesti diperolehi dengan diet.
Asid amino ini diasingkan untuk kali pertama pada tahun 1903 oleh saintis f. Ehrlich dari unsur nitrogen bit atau molase bit. Seterusnya, penulis yang sama memisahkan isoleucine dari produk penguraian fibrin dan protein lain.
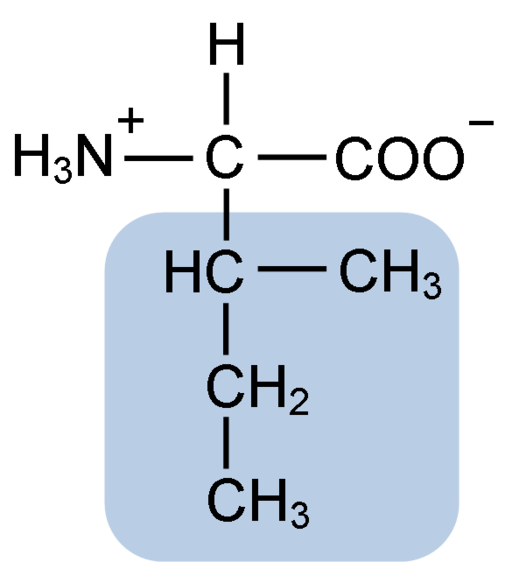
 Struktur kimia asid amino isoleucine (sumber: clavecin [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons)
Struktur kimia asid amino isoleucine (sumber: clavecin [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons) Ia adalah asid amino bukan -polar yang terdapat di kebanyakan protein sel organisma hidup, di samping itu, ia adalah sebahagian daripada asid amino rantaian bercabang BCAAS (dari Bahasa Inggeris BRanched CHain KeSaya tidak KeCIDS), Bersama Leucina dan Valina.
Ia mempunyai fungsi dalam penubuhan struktur tertiari banyak protein dan, di samping itu, mengambil bahagian dalam pembentukan pelbagai prekursor metabolik yang berkaitan dengan metabolisme tenaga selular.
[TOC]
Ciri -ciri
Isoleucine diklasifikasikan dalam kumpulan asid amino bukan -polar dengan kumpulan atau rantai sifat aifatik, iaitu, dengan rantai hidrokarbon hidrokarbon.
Oleh kerana ciri -ciri ini, asid amino kumpulan ini seperti alanine, valina dan leucina cenderung tetap dekat antara satu sama lain, yang menyumbang kepada penstabilan protein yang merupakan sebahagian daripada interaksi hidrofobik.
Asid amino bukan -polar ini beratnya kira -kira 131 g/mol dan terdapat dalam protein dalam perkadaran hampir 6%, sering "dikebumikan" di tengah -tengahnya (terima kasih kepada kualiti hidrofobiknya).
Struktur
Isoleucine adalah asid α-amino yang, seperti asid amino yang lain, mempunyai atom karbon pusat yang dipanggil α (yang kiral), yang mana empat kumpulan yang berlainan disatukan: atom hidrogen, kumpulan amino (-NH2), a Kumpulan Carboxyl (-COH) dan rantai sampingan atau R Grupo.
Kumpulan Isoleucine R terdiri daripada hidrokarbon bercabang sederhana 4 atom karbon (-CH3-CH2-CH (CH3)) di mana rantainya juga ada atom karbon quiral.
Oleh kerana ciri ini, isoleucine mempunyai empat cara yang mungkin: dua daripadanya adalah isomer optik yang dikenali sebagai L-isoleucine dan D-isoleucine dan dua yang lain adalah diastereoisomeres L-isoleucine. Bentuk utama dalam protein adalah l-isoleucine.
Formula molekul isoleucine adalah C6H13NO2 dan nama kimianya ialah α-amino-β-metyl-β-ethylpropionic atau 2-amino-3-metil pentatonik asid atau asid asid asid asid atau asid asidik.
Fungsi
Isoleucine mempunyai pelbagai fungsi fisiologi pada haiwan, termasuk
- Penyembuhan luka
- Detoksifikasi sisa nitrogen
- Rangsangan fungsi imun dan
- Promosi rembesan hormon yang berbeza.
Ia dianggap sebagai asid amino glikogenik, kerana ia berfungsi sebagai molekul prekursor untuk sintesis perantara kitaran asid sitrus (kitaran Krebs) yang kemudiannya menyumbang kepada pembentukan glukosa dalam hati.
Atas sebab ini, dipercayai bahawa isoleucine mengambil bahagian dalam peraturan tahap glukosa plasma, yang mempunyai implikasi penting dari sudut pandangan tenaga badan.
Isoleucine menyumbang kepada laluan sintesis glutamin dan alanine, yang memihak kepada keseimbangan antara asid amino rantai bercabang.
Dalam bidang klinikal, sesetengah penulis menunjukkan bahawa peningkatan kepekatan isoleucine, leucine, tirosin dan valin boleh menjadi penanda ciri sel -sel yang terjejas tumor, diikuti dengan peningkatan tahap glutamin.
Fungsi lain
Penyelidikan saintifik yang berbeza telah menunjukkan bahawa isoleucine diperlukan untuk sintesis hemoglobin, protein yang bertanggungjawab untuk mengangkut oksigen dalam darah banyak haiwan.
Di samping itu, asid amino ini mengaktifkan kemasukan nutrien ke dalam sel; Beberapa kajian mendedahkan bahawa semasa puasa yang berpanjangan ia dapat menggantikan glukosa sebagai sumber tenaga dan, sebagai tambahan, ia adalah asid amino ketogenik.
Ia boleh melayani anda: Garis Masa BiologiAsid amino ketogenik adalah mereka yang rangka karbon boleh disimpan seperti asid lemak atau karbohidrat, sehingga mereka bekerja di rizab tenaga.
Isoleucine dan asid amino rantai bercabang lain (sebagai tambahan kepada faktor pertumbuhan dan keadaan persekitaran) bekerja pada pengaktifan laluan isyarat putih atau sasaran rapamycin, mTOR (dari Bahasa Inggeris mTuranistik TArget Sama adaF RApamycin).
Laluan ini merupakan laluan isyarat penting dalam eukariota yang mampu mengawal pertumbuhan sel dan metabolisme, serta sintesis protein dan peristiwa autophagy. Di samping itu, ia mengawal kemajuan penuaan dan beberapa patologi seperti kanser atau diabetes.
Biosintesis
Manusia dan haiwan lain tidak dapat mensintesis isoleucine, tetapi ini adalah sebahagian daripada protein sel berkat pengambilalihan mereka dari makanan yang kita makan setiap hari.
Tumbuh -tumbuhan, kulat dan kebanyakan mikroorganisma dapat mensintesis asid amino ini dari laluan yang agak kompleks yang biasanya saling berkaitan dengan asid amino lain juga dianggap penting untuk manusia.
Sebagai contoh, ada cara untuk menghasilkan isoleucine, lisin, methionine dan treonine dari aspartat.
Dalam bakteria, khususnya, isoleucine dihasilkan dari asid amino treonine, melalui piruvat, melalui laluan yang membayangkan pemeluwapan 2 karbon piruvat dengan molekul α-ecthobutirate yang berasal dari treonine.
Reaksi bermula dengan tindakan enzim dehidratase, yang memangkinkan dehidrasi treonin untuk menghasilkan α-ecotobutirate dan ammonium (NH3). Seterusnya, enzim yang sama yang mengambil bahagian dalam biosintesis valin menyumbang kepada langkah -langkah
- Transaminasi
- Decarboxylation oksidatif ketoacid yang sepadan dan
- Dehidrogenasi.
Dalam jenis mikroorganisma ini, sintesis asid amino seperti lisin, methionine, treonine dan isoleucine sangat diselaraskan dan dikawal selia, terutamanya oleh maklum balas negatif, di mana produk reaksi menghalang aktiviti enzim yang terlibat.
Walaupun isoleucine, seperti leucine dan valine, adalah asid amino penting bagi manusia, enzim aminotransfera yang terdapat dalam tisu badan dapat menukarkannya secara terbalik kepada α-zo-stoats yang sepadan, yang akhirnya dapat menggantikannya dalam diet.
Degradasi
Sebagai sebahagian besar asid amino yang diketahui dalam alam semula jadi, isoleucine dapat direndahkan untuk membentuk perantara dari laluan metabolik yang berlainan, di antaranya kitaran Krebs (yang memberikan jumlah terbesar koenzim yang beroperasi untuk pengeluaran tenaga atau untuk biosintesis sebatian lain ).
Kedua-dua isoleucine dan tryptophan, lisin, phenylalanine, tirosin, treonine dan leucine boleh digunakan untuk menghasilkan asetil-CoA, perantara metabolik utama untuk pelbagai reaksi sel.
Tidak seperti asid amino lain, asid amino rantai bercabang (leucine, isoleucine dan valine) tidak terdegradasi di hati, tetapi dioksidakan sebagai bahan api dalam otot, otak, buah pinggang dan tisu adiposa.
Organ-organ dan tisu-tisu ini boleh menggunakan asid amino ini berkat kehadiran enzim aminotransferase yang mampu bertindak pada ketiga-tiga dan menghasilkan asid amino mereka yang sepadan.
Sebaik sahaja derivatif asid amino yang teroksida ini dihasilkan, kompleks enzimatik α-zo-ketoasid memangkinkan decarboxylation oksidatif mereka, di mana ia mengeluarkan molekul karbon dioksida (CO2) dan menghasilkan derivatif acyl-coa asid amino yang dipersoalkan.
Patologi yang berkaitan dengan metabolisme isoleucine
Kecacatan dalam metabolisme isoleucine dan asid amino lain boleh menyebabkan kepelbagaian patologi aneh dan kompleks seperti penyakit ""Maple Syrup Urine"(Air kencing dengan sirap arce) atau ketoaciduria rantai bercabang.
Seperti namanya, penyakit ini dicirikan oleh aroma tersendiri dari air kencing pesakit yang menderita, sebagai tambahan kepada muntah, sawan, keterlambatan mental dan kematian pramatang.
Ia perlu dilakukan, khususnya, dengan kesilapan dalam kompleks enzimatik α-cethoacid dehydrogenase, supaya asid amino rantai bercabang seperti isoleucine dan derivatif teroksida dikeluarkan dalam air kencing.
Boleh melayani anda: tafonomi: sejarah, pemeliharaan dan perubahan fosilBersama -sama, patologi yang berkaitan dengan katabolisme asid amino rantai bercabang seperti isoleucine dikenali sebagai acidurias organik, walaupun yang berkaitan secara langsung dengan asid amino ini agak jarang.
Makanan yang kaya dengan isoleucine
Asid amino ini banyak di dalam tisu otot haiwan, sehingga daging asal binatang seperti lembu, daging babi, ikan dan lain -lain yang serupa seperti kambing, ayam, ayam belanda, rusa, antara lain, mereka kaya dengan yang sama.
Ia juga terdapat dalam tenusu dan derivatifnya seperti keju. Ia berada dalam telur dan juga dalam pelbagai jenis biji dan kacang, sebagai bahagian penting protein yang membentuknya.
Ia banyak terdapat dalam kacang soya dan kacang polong, serta dalam ekstrak ragi yang digunakan dengan pelbagai tujuan makanan.
Tahap plasma isoleucine untuk manusia dewasa adalah antara 30 dan 108 μmol/L, untuk kanak -kanak dan orang muda antara umur 2 dan 18 tahun adalah antara 22 dan 107 μmol/L dan untuk bayi antara 0 dan 2 tahun antara 26 dan 86 μmol/l.
Data -data ini mencadangkan bahawa penggunaan makanan kaya dalam asid amino ini dan lain -lain yang berkaitan adalah perlu untuk penyelenggaraan banyak fungsi fisiologi organisma, kerana manusia tidak dapat mensintesisnya daripada Novo.
Faedah pengambilan anda
Suplemen pemakanan dengan isoleucine biasanya mengandungi asid amino penting lain rantai bercabang seperti valine atau leucine atau lain -lain.
Antara contoh penggunaan isoleucine yang paling biasa adalah suplemen pemakanan yang digunakan oleh atlet untuk meningkatkan peratusan jisim otot atau sintesis protein. Walau bagaimanapun, asas saintifik di mana amalan -amalan ini disokong sentiasa dibincangkan, dan hasilnya tidak dijamin sepenuhnya.
Isoleucine, bagaimanapun, digunakan untuk mengatasi kesan metabolik kekurangan vitamin (pelagra) ciri -ciri pesakit yang mempunyai makanan sorgum dan jagung yang kaya, yang merupakan makanan dengan kandungan leucine yang tinggi, yang dapat mempengaruhi metabolisme tryptophan dan asid nikotinik dalam Humans.
Kesan pelagra pada tikus eksperimen, misalnya, melibatkan kelewatan pertumbuhan, yang diatasi dengan suplemen isoleucine.
- Dalam industri pengeluaran haiwan
Di kawasan pengeluaran haiwan, asid amino seperti lisin, treonin, methionine dan isoleucine telah digunakan dalam ujian perintis untuk makan babi yang tumbuh dalam keadaan terkawal.
Isoleucine, khususnya, seolah -olah mempunyai kesan pada asimilasi nitrogen, walaupun ia tidak menyumbang kepada berat badan haiwan ladang ini.
- Dalam beberapa keadaan klinikal
Beberapa penerbitan mencadangkan bahawa isoleucine dapat mengurangkan tahap glukosa plasma, jadi pengambilan mereka disyorkan pada pesakit yang mengalami gangguan seperti diabetes atau kadar pengeluaran insulin yang rendah.
Jangkitan virus
Suplemen isooleucine telah terbukti berguna pada pesakit yang dijangkiti rotavirus yang menyebabkan penyakit seperti gastroenteritis dan cirit -birit pada kanak -kanak kecil dan haiwan muda lain.
Kajian baru -baru ini menyimpulkan bahawa penggunaan asid amino ini oleh haiwan eksperimen dengan ciri -ciri yang disebutkan di atas (dijangkiti rotavirus) membantu dalam pertumbuhan dan prestasi sistem imun semula jadi berkat pengaktifan laluan isyarat PRR atau reseptor dengan pengiktirafan pengiktirafan pengiktirafan Corak.
Gangguan kekurangan
Kekurangan isoleucine boleh membawa masalah dalam penglihatan, kulit (seperti dermatitis) dan usus (terbukti sebagai cirit -birit dan manifestasi gastrointestinal lain))).
Memandangkan hakikat bahawa ia adalah asid amino penting untuk pembentukan dan sintesis hemoglobin, serta untuk pertumbuhan semula erythrocytes (sel darah), kekurangan yang teruk dalam isoleucine boleh membawa kesan fisiologi yang serius, terutama yang berkaitan dengan anemia dan hematologi lain penyakit.
Boleh melayani anda: Pengguna TersierIni telah ditunjukkan secara eksperimen dalam tikus "normal" yang mana diet miskin telah disediakan dalam isoleucine ini, yang berakhir dengan perkembangan lukisan anemia penting.
Walau bagaimanapun, isoleucine mengambil bahagian dalam pembentukan hemoglobin hanya pada bayi, kerana protein manusia dewasa tidak mempunyai jumlah penting asid amino tersebut; Ini bermakna kekurangan isoleucine lebih jelas semasa peringkat pertama pembangunan.
Rujukan
- Aders plimmer, r. (1908). Perlembagaan kimia protein. Saya pergi. London, UK: Longmans, Green, dan Co.
- Aders plimmer, r. (1908). Perlembagaan kimia protein. Bahagian II. London, UK: Longmans, Green, dan Co.
- Barret, g., & Elmore, D. (2004). Asid amino dan peptida. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, m., & Gibson, k. (Sembilan belas sembilan puluh enam). Panduan Doktor untuk Diagnosis Makmal Penyakit Metabolik (Edisi ke -2.).
- Bradford, h. (1931). Sejarah penemuan asid amino. Ii. Kajian semula asid amino yang diterangkan sejak tahun 1931 sebagai komponen protein asli. Kemajuan dalam kimia protein, 81-171.
- Campos-Ferraz, ms. L., Bozza, t., Nicastro, h., & Bot, ke. H. (2013). Kesan yang berbeza dari leucine atau campuran asid aminino bercabang (leucine, isoleucine, dan valine) suplemen terhadap rintangan terhadap keletihan, dan degradasi otot dan hati-glikogen, dalam tikus tikus terlatih. Pemakanan, 29(11-12), 1388-1394.
- Champe, ms., & Harvey, r. (2003). Asid amino asid amino. Dalam Ulasan Illustrated Lippincott: Biokimia (Edisi ke -3., ms. 1-12). Lippincott.
- Chandran, k., & Damodaran, m. (1951). Amino-asid dan protein dalam pembentukan hemoglobin 2. Isoleucine. Jurnal Biokimia, 49, 393-398.
- Chung, a. S., & Rasuk, r. M. (1974). Lysine, threonine, methionine dan isoleucine suplemen barli Peace River untuk tumbuh babi. Anjing. J. Anim. Sci., 436, 429-436.
- Dejong, c., Meijerink, w., Van Berlo, C., Deutz, n., & Soeter, p. (Sembilan belas sembilan puluh enam). Plasma isoleucine yang tertutup selepas pendarahan gastrointal atas manusia. Usus, 39, 13-17.
- Edsall, J. (1960). Asid aminino, protein dan biokimia kanser (Vol. 241). London: Akademik Press, Inc.
- Britannica Encyclopaedia. (2012). Diperoleh pada 30 Ogos 2019, dari https: // www.Britannica.com/sains/isoleucine
- Gelfand, r., Hendler, r., & Sherwin, r. (1979). Karbohidrat pemakanan dan metabolisme protein tertelan. Lancet, 65-68.
- Hudson, b. (1992). Biokimia Protein Makanan. Springer-Science+Media Perniagaan, B.V.
- Knerr, i., Vockley, J., & Gibson, k. M. (2014). Gangguan Leucine, Isoleucine, dan Metabolisme Valine. Dalam n. Blau (ed.), Panduan doktor untuk diagnosis, rawatan, dan susulan penyakit metabolik yang diwarisi (ms. 103-141).
- Korman, s. H. (2006). Kesalahan Degradasi Isoleucine: Ulasan. Genetik molekul dan metabolisme, 89(4), 289-299.
- Krishnaswamy, k., & Gpalan, c. (1971). Kesan Isoleucine pada Kulit dan Electroencephalogram di Pelagra. Lancet, 1167-1169.
- Martin, r. Dan., & Kirk, k. (2007). Pengangkutan isoleucine nutrien esensial dalam erythrocytes manusia yang dijangkiti dengan parasit malaria plasmodium falciparum. Darah, 109(5), 2217-2224.
- Pusat Kebangsaan Maklumat Bioteknologi. Pangkalan data PUBCHEM. L-isoleucine, CID = 6306, https: // pubchem.NCBI.NLM.NIH.Gov/compund/l-isoleucine (diakses pada Ogos. 31, 2019)
- Nuttall, f. Q., Schweim, k., & Gannon, m. C. (2008). Kesan isoleucine yang diberikan secara lisan dengan dan tanpa glukosa pada kepekatan insulin, glukagon dan glukosa dalam subjek bukan diabetes. E-Journal European of Nutrition dan Metabolisme Klinikal, 3(4), 152-158.
- Van Berlo, C. L. H., Van de Bogaard, ke. Dan. J. M., Van der Heijden, m. Ke. H., Van Eijk, h. M. H., Janssen, m. Ke., Bost, m. C. F., & Soeter, p. B. (1989). Adalah pembebasan ammonia incredase selepas pendarahan di saluran pencernaan yang mengakui ketiadaan isoleucine dalam hemoglobin sepenuhnya? Kajian dalam babi. Hepatologi, 10(3), 315-323.
- Vickery, h. B., & Schmidt, c. L. Ke. (1931). Sejarah penemuan asid amino. Ulasan Kimia, 9(2), 169-318.
- Wolfe, r. R. (2017). Amin rantaian bercabang dan sintesis protein otot pada manusia: mitos atau realiti? Jurnal Persatuan Pemakanan Sukan Antarabangsa, 14(1), 1-7.
- Wu, g. (2009). Asid Aminino: Metabolisme, Fungsi, dan Pemakanan. Asid Aminino, 37(1), 1-17.
- « Sejarah Ekologi Perindustrian, Objektif, Contoh
- Ciri -ciri fenilalanin, fungsi, biosintesis, makanan »

