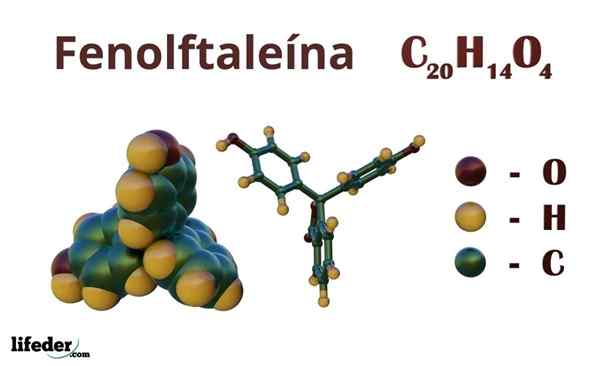
Phenolphthalein (C20H14O4)
- 3546
- 527
- Miss Elmer Hagenes
Apa itu phenolphthalein?
The Phenolphthalein Ia adalah pewarna organik, yang seterusnya merupakan asid diprotik yang lemah, digunakan dalam banyak penentuan volumetrik sebagai penunjuk asid. Iaitu, jika ia adalah asid diprotik, dalam larutan anda boleh kehilangan dua ion+, Dan menjadi penunjuk, anda mesti mempunyai harta yang berwarna -warni dalam julat pH yang dinilai.
Dalam medium asas (ph> 8) phenolphthalein berwarna merah jambu, yang boleh dipergiatkan kepada merah violet. Untuk digunakan sebagai penunjuk asid, anda tidak boleh bertindak balas dengan lebih cepat dengan oh- persekitaran yang dianalisis untuk ditentukan.
Di samping itu, kerana ia adalah asid yang sangat lemah, kehadiran kumpulan -cooh dikesampingkan dan, oleh itu, sumber proton asid adalah dua kumpulan OH yang dikaitkan dengan dua cincin aromatik.
Formula
Phenolphthalein adalah sebatian organik yang formula kimia yang terkondensasi ialah Cdua puluhH14Sama ada4. Walaupun mungkin tidak mencukupi untuk mengetahui kumpulan organik mana yang dimiliki, dari formula anda dapat mengira ketidakpastian, untuk mula menjelaskan kerangka anda.
Struktur kimia
 Struktur phenolphthalein
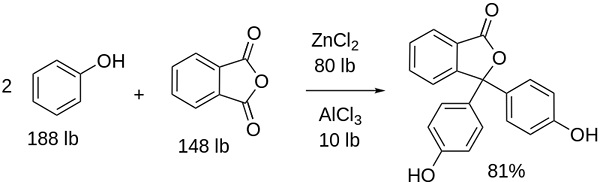
Struktur phenolphthalein Struktur phenolphthalein dinamik, yang bermaksud bahawa ia mengalami perubahan bergantung pada pH persekitarannya. Dalam imej unggul struktur phenolphthalein dalam julat 0 digambarkan Ia adalah cincin pentagonal yang menderita pengubahsuaian terbesar. Sebagai contoh, dalam medium asas, apabila salah satu kumpulan OH cincin fenolik, beban negatif mereka (-o-) tertarik dengan cincin aromatik, "membuka" cincin pentagonal dalam susunan baru pautannya. Di sini, beban negatif baru terletak di kumpulan -coo-, yang "keluar" dari cincin pentagonal. Kemudian, setelah meningkatkan asas medium, kumpulan OH kedua cincin fenolik dan beban yang dihasilkan menghancurkan sepanjang struktur molekul memakannya. Imej inferior meringkaskan hasil daripada dua orang yang tidak menentu dalam medium asas. Struktur ini bertanggungjawab untuk pewarna merah jambu yang biasa phenolphthalein. Elektron yang "perjalanan" melalui sistem π konjugasi (diwakili dengan ikatan resonan berganda) menyerap dalam spektrum yang kelihatan, khususnya kepada panjang gelombang warna kuning, mencerminkan warna merah jambu yang mencapai mata pemutar. Phenolphthalein mempunyai empat struktur. Dua sebelumnya adalah yang paling penting dalam istilah praktikal dan diwakili disingkat sebagai: h2Masuk dan masuk2-. Phenolphthalein digunakan dalam analisis kimia sebagai penunjuk visual dalam menentukan titik kesetaraan dalam tindak balas peneutralan atau darjah asid-asas. Reagen untuk penilaian asid ini disediakan pada 1 % dibubarkan dalam alkohol 90 %. Phenolphthalein membentangkan 4 negeri: Tingkah laku ini telah membolehkan penggunaan phenolphthalein sebagai petunjuk pengkarbonan konkrit, yang mengubah pH ke nilai antara 8.5 hingga 9. Juga, perubahan pewarnaan sangat mendadak; iaitu anion di2- merah jambu dihasilkan dengan kelajuan tinggi. Akibatnya, ini membolehkan anda menjadi calon sebagai penunjuk dalam banyak penentuan volumetrik; Sebagai contoh, asid lemah (asid asetik) atau kuat (asid hidroklorik). Phenolphthalein digunakan sebagai ejen pencahayaan. Walau bagaimanapun, terdapat kesusasteraan saintifik indikatif bahawa beberapa julap yang mengandungi phenolphthalein sebagai prinsip aktif - yang bertindak menghalang penyerapan air dan elektrolit dalam usus besar yang menggalakkan pemindahan - boleh memberi kesan negatif. Penggunaan ubat -ubatan yang berpanjangan yang mengandungi phenolphthalein dikaitkan dengan pengeluaran beberapa gangguan dalam fungsi usus, pankreatitis dan juga kanser, yang dihasilkan terutamanya pada wanita dan model haiwan yang digunakan untuk kajian farmakologi ini. Phenolphthalein yang diubahsuai secara kimia, dan kemudian mengubahnya menjadi keadaan yang dikurangkan, digunakan sebagai reagen dalam ujian forensik yang membolehkan menentukan kehadiran hemoglobin dalam sampel (ujian kastle-meyer), yang tidak konklusif kerana kehadiran positif palsu. Ia dibentuk oleh pemeluwapan anhydride phthalic dengan fenol, dengan kehadiran asid sulfurik pekat, dan campuran aluminium dan zink klorida sebagai pemangkin reaksi: Penggantian elektrofilik aromatik adalah mekanisme yang mengawal reaksi ini. Apa yang terdiri daripada? Cincin fenolik (molekul kiri) dimuatkan secara negatif terima kasih kepada atom oksigen yang kaya dengan elektron, yang mampu membuat pasangan bebas mereka bergerak "litar elektronik" cincin. Sebaliknya, karbon kumpulan c = o anhydrid phthalic. Cincin fenolik, kaya dengan elektron, menyerang karbon miskin ini dalam elektron, menggabungkan cincin pertama ke dalam struktur. Serangan ini berlaku secara sengaja di hujung karbon yang dikaitkan dengan kumpulan OH; Ini adalah kedudukannya -untuk. Begitu juga untuk cincin kedua: ia menyerang karbon yang sama dan dari ini molekul air yang dihasilkan dikeluarkan terima kasih kepada medium berasid. Dengan cara ini, phenolphthalein tidak lebih daripada molekul anhydride phthalic yang telah menggabungkan dua cincin fenolik ke dalam salah satu kumpulan karbonillus (C = O). Penampilan fizikalnya adalah pepejal putih dengan kristal triklinik, sering agglomerated atau dalam bentuk jarum rhombic. Ia adalah tandas, lebih padat daripada air cair (1,277 g/ml pada 32 ºC), dan sangat sedikit tidak menentu (dianggarkan tekanan stim: 6.7 x 10-13 mmhg). Ia sangat larut dalam air (400 mg/l), tetapi sangat larut dalam alkohol dan eter. Atas sebab ini, disarankan untuk mencairkannya di etanol sebelum digunakan. Tidak larut dalam pelarut aromatik seperti benzena dan toluena, atau dalam hidrokarbon alifatik seperti n-heksana. Ditemui pada 262.5 ºC dan cecair mempunyai titik mendidih 557.8 ± 50.0 ºC ke tekanan atmosfera. Nilai -nilai ini menunjukkan interaksi intermolecular yang kuat. Ini disebabkan oleh jambatan hidrogen, serta interaksi depan antara cincin. PKAnya adalah 9.7 hingga 25 ºC. Ini diterjemahkan ke dalam trend yang sangat rendah untuk memisahkan diri dalam medium berair: H2Dalam (ac) + 2h2Atau (l) dalam2-(Ac) + 2h3Sama ada+ Ini adalah keseimbangan berair. Walau bagaimanapun, peningkatan ion OH- Dalam penyelesaian jumlah h sekarang berkurangan3Sama ada+. Akibatnya, baki bergerak ke kanan, untuk menghasilkan lebih banyak h3Sama ada+. Dengan cara ini kerugian awalnya diberi ganjaran. Oleh kerana lebih banyak asas ditambah, baki terus bergerak ke kanan, dan sebagainya sehingga tidak ada spesies h2Dalam. Pada ketika ini, spesies di2- Rosado warna penyelesaiannya. Akhir.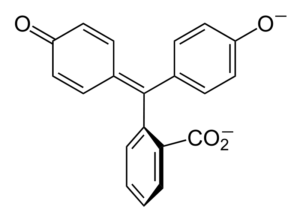
Penggunaan/aplikasi phenolphthalein
 Menambah larutan alkali kepada larutan neutral dengan penunjuk phenolphthalein
Menambah larutan alkali kepada larutan neutral dengan penunjuk phenolphthalein Fungsi penunjuk
Kegunaan dalam Perubatan
Sintesis Phenolphthalein
Sifat phenolphthalein
Rujukan