Struktur, Ciri -ciri Kalsium Fluorida (CAF2), Kegunaan, Kegunaan

- 1492
- 295
- Delbert Dare
Dia Kalsium fluorida Ia adalah pepejal bukan organik yang dibentuk oleh atom kalsium (Ca) dan dua atom fluorin (F). Formula kimianya adalah kafe2 Dan ia adalah pepejal berwarna kelabu kristal.
Secara semula jadi ia terdapat di bijih fluorit atau fluorin spatter. Ia wujud secara semula jadi dalam tulang dan gigi. Mineral Fluorit adalah sumber utama yang digunakan untuk mendapatkan sebatian fluorin yang lain.
 CAF Calcium Fluoride2 pepejal. W: Pengguna: Walkerma pada bulan Jun 2005. Sumber: Wikimedia Commons.
CAF Calcium Fluoride2 pepejal. W: Pengguna: Walkerma pada bulan Jun 2005. Sumber: Wikimedia Commons. Di samping itu kopi2 Ia digunakan untuk pencegahan karies di gigi, jadi ia ditambah kepada bahan yang digunakan oleh doktor gigi untuk menyembuhkan mereka. Malah, fluorida kalsium juga ditambah kepada air minuman (air yang boleh diminum) supaya populasi mendapat faedah ketika meminum dan memberus gigi gigi.
Caf2 Ia digunakan dalam kristal besar dalam peralatan optik dan kamera. Ia juga digunakan dalam peranti kecil yang berfungsi untuk mengesan berapa banyak seseorang yang terdedah kepada radioaktiviti.
[TOC]
Struktur
CAF Calcium Fluoride2 Ia adalah sebatian ionik yang dibentuk oleh kation kalsium CA2+ dan dua fluoride f anities-. Walau bagaimanapun, beberapa sumber maklumat menunjukkan bahawa pautan mereka mempunyai watak kovalen tertentu.
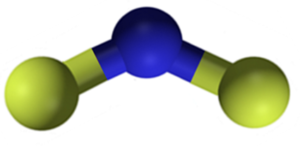 Struktur fluorida kalsium CAF2. Biru: Kalsium; Fluorin kuning. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Struktur fluorida kalsium CAF2. Biru: Kalsium; Fluorin kuning. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Nomenclature
Kalsium fluorida
Sifat
Keadaan fizikal
Mewarna pepejal hingga putih kelabu dengan struktur kristal padu.
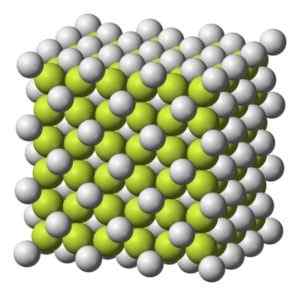 Struktur kopi kristal padu2. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons.
Struktur kopi kristal padu2. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons. Berat molekul
78.07 g/mol
Takat lebur
1418 ºC
Takat didih
2533 ºC
Ketumpatan
3.18 g/cm3 pada 20 ° C.
Indeks refraktif
1,4328
Kelarutan
Tidak larut dalam air pada 20 ° C. Hampir tidak larut pada 25 ° C: 0.002 g/100 ml air. Sedikit larut asid.
Sifat kimia
Sifat pengoksidaan atau pengurangannya sangat lemah, bagaimanapun, reaksi ini boleh berlaku. Walaupun, biasanya, dalam sangat sedikit kes.
Ia tidak aktif dengan sebatian kimia organik dan banyak asid, termasuk asid fluorhoric HF. Ia larut perlahan dalam asid nitrik3.
Boleh melayani anda: Eksperimen Millikan: Prosedur, Penjelasan, KepentinganIa tidak mudah terbakar. Tidak bertindak balas dengan cepat dengan udara atau air.
Oleh kerana sedikit pertalian untuk air, walaupun ia terdedah kepada peratusan kelembapan yang tinggi, ia tidak menjejaskannya walaupun selama sebulan pada suhu bilik biasa.
Di hadapan kelembapan dinding kristal mereka perlahan dibubarkan pada suhu melebihi 600 ° C. Dalam persekitaran kering, ia boleh digunakan sehingga kira -kira 1000 ° C tanpa terjejas.
Kehadiran dalam alam
CAF Calcium Fluoride2 Ia secara semula jadi dijumpai dalam bijih fluorit atau fluorida spatter.
Walaupun kopi2 Murni tidak berwarna, mineral fluorit sering diwarnai oleh kehadiran elektron yang terperangkap dalam "lubang" struktur kristal.
Mineral ini sangat dihargai kerana kecerahan dan pelbagai warna (warna ungu, biru, hijau, kuning, tidak berwarna, coklat, merah jambu, hitam dan merah jingga). Dikatakan sebagai "mineral paling berwarna di dunia".
 Fluorit lombong di Perancis. Toulouse Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Fluorit lombong di Perancis. Toulouse Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. Fluorit (kristal biru) dari Muzium Semula Jadi Milan. Giovanni dall'orto [cc by-sa 2.5 Ia (https: // creativeCommons.Org/lesen/by-sa/2.5/IT/Ikatan.dalam)]. Sumber: Wikimedia Commons.
Fluorit (kristal biru) dari Muzium Semula Jadi Milan. Giovanni dall'orto [cc by-sa 2.5 Ia (https: // creativeCommons.Org/lesen/by-sa/2.5/IT/Ikatan.dalam)]. Sumber: Wikimedia Commons. Fluorit lombong di England. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Fluorit lombong di England. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Fluorit lombong di Perancis. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Fluorit lombong di Perancis. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
 Fluorit lombong di AS. Pengarang: Oliveira Jurema. Sumber: Wikimedia Commons.
Fluorit lombong di AS. Pengarang: Oliveira Jurema. Sumber: Wikimedia Commons. Kalsium fluorida juga terdapat dalam tulang dalam kuantiti antara 0.2 dan 0.65%, dan juga dalam enamel gigi dalam 0.33-0.59%.
Aplikasi
- Dalam mendapatkan sebatian fluorida
Fluorita Caf2 Ia adalah sumber asas atau majoriti fluorida di seluruh dunia. Ia adalah bahan mentah untuk menyediakan hampir semua sebatian fluorin.
Yang paling penting ialah asid fluorhorhoric HF, dari mana sebatian fluorked yang lain disediakan. Ion fluorida f- Ia dibebaskan dari mineral dengan reaksi ini dengan asid sulfurik pekat h2SW4:
Dapat melayani anda: isomeriaCaf2 (pepejal) + h2SW4 (cecair) → kes4 (pepejal) + 2 hf (gas)
- Dalam penjagaan gigi
CAF Calcium Fluoride2 Ia adalah ejen pencegahan karies. Ia digunakan untuk menembusi perairan yang boleh diminum (perairan yang boleh diminum) dengan matlamat itu.
Di samping itu, kepekatan fluorida rendah f f- (dari urutan 0.1 bahagian per juta) yang digunakan dalam pasta gigi dan cuci mulut telah menunjukkan kesan positif yang mendalam terhadap penjagaan gigi pencegahan karies.
 Fluorida Kalsium Membantu Pencegahan Karies. Pengarang: Annalize Batista. Sumber: Pixabay.
Fluorida Kalsium Membantu Pencegahan Karies. Pengarang: Annalize Batista. Sumber: Pixabay. Nanopartikel CAF2 lebih berkesan
Walaupun fluorida digunakan dalam pasta gigi dan bilas, kepekatan kalsium (Ca) yang rendah dalam air liur menyebabkan deposit kopi tidak terbentuk2 dalam gigi dengan cara yang paling berkesan.
Itulah sebabnya cara mendapatkan debu kopi telah dirancang2 sebagai nanopartikel.
Untuk ini pengering digunakan oleh Rocío (dari Bahasa Inggeris Penyemburan semburan) Di mana dua penyelesaian (salah satu CA (OH) kalsium hidroksida2 dan salah satu ammonium fluorida NH4F) Mereka bercampur semasa mereka disembur dalam kamera dengan aliran udara panas.
Maka reaksi berikut berlaku:
CA (oh)2 + NH4F → CAF2 (pepejal) + NH4Oh
NH4Oh volatilisasi sebagai NH3 dan h2O dan nanopartikel CAF kekal2.
Ini mempunyai kereaktifan yang tinggi dan kelarutan yang lebih besar, yang menjadikannya lebih berkesan untuk seineralisasi gigi dan sebagai anticari.
- Dalam kanta untuk peralatan optik
Fluorida Kalsium digunakan untuk membina elemen optik seperti prisma dan spektrofotometer cahaya inframerah dan ultraviolet (UV).
Peranti ini membolehkan mengukur jumlah cahaya yang diserap oleh bahan apabila ia melaluinya.
Caf2 Ia telus di kawasan-kawasan spektrum cahaya, mempunyai indeks pembiasan yang sangat rendah dan membolehkan untuk mendapatkan resolusi yang lebih efisien daripada NaCl dalam selang 1500-4000 cm-1.
Boleh melayani anda: ParamagnetismeTerima kasih kepada kestabilan kimianya dapat menyokong keadaan buruk sehingga unsur -unsur optik kafe2 Mereka tidak diserang. Ia juga mempunyai kekerasan yang tinggi.
Dalam kamera
Beberapa pengeluar kamera menggunakan kanta kopi2 buatan kristal untuk mengurangkan penyebaran cahaya dan mencapai pembetulan warna penyimpangan warna yang sangat baik.
 Beberapa kamera mempunyai kanta fluorida kalsium CAF2 Untuk mengurangkan penyimpangan warna. Bill Ebbesen [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]. Sumber: Wikimedia Commons.
Beberapa kamera mempunyai kanta fluorida kalsium CAF2 Untuk mengurangkan penyimpangan warna. Bill Ebbesen [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]. Sumber: Wikimedia Commons. - Dalam industri metalurgi
Caf2 Ia digunakan sebagai ejen pengasas dalam industri metalurgi, kerana ia adalah sumber kalsium yang tidak larut dalam air dan oleh itu berkesan dalam aplikasi sensitif oksigen.
Ia digunakan untuk mencairkan dan memproses besi dan keluli. Ini berdasarkan fakta bahawa ia mempunyai titik lebur yang serupa dengan besi dan juga bahawa ia dapat membubarkan oksida dan logam.
- Dalam pengesan radioaktiviti atau sinaran berbahaya
Caf2 Ia adalah bahan termoluminescent. Ini bermaksud bahawa ia dapat menyerap radiasi dalam elektron struktur kristalnya dan kemudian apabila dipanaskan untuk melepaskannya dalam bentuk cahaya.
Lampu yang dipancarkan ini dapat diukur dengan isyarat elektrik. Isyarat ini berkadar dengan jumlah radiasi yang diterima oleh bahan. Bermaksud bahawa semakin besar jumlah radiasi, semakin besar jumlah cahaya yang akan dipancarkan kemudian ketika dipanaskan.
Oleh itu kafe2 Ia digunakan dalam dua orang yang dipanggil secara peribadi, yang digunakan oleh orang yang terdedah kepada radiasi berbahaya dan anda ingin tahu berapa banyak radiasi yang mereka terima dalam tempoh masa.
- Kegunaan lain
- Ia digunakan sebagai pemangkin dalam tindak balas kimia dehidrasi dan dehidrogenasi untuk sintesis sebatian organik.
- Ia digunakan dalam elektrod alkali kimpalan. Kimpalan yang lebih kuat diperoleh daripada dengan elektrod asid. Elektrod ini berguna dalam pembuatan kapal dan bekas keluli tekanan tinggi.
- Sebagai makanan tambahan dalam kuantiti yang sangat rendah (ppm atau bahagian per juta).
 Lelaki kimpalan. Elektrod dengan kopi fluorida kalsium2 Mereka membentuk kimpalan yang lebih kuat. William m. Plat jr. [Domain awam]. Sumber: Wikimedia Commons.
Lelaki kimpalan. Elektrod dengan kopi fluorida kalsium2 Mereka membentuk kimpalan yang lebih kuat. William m. Plat jr. [Domain awam]. Sumber: Wikimedia Commons. Rujukan
- Pirmradian, m. dan Hooshmand, t. (2019). Remineralisasi dan keupayaan antibakteria nanocomposites berasaskan resin. Sintesis dan pencirian kalsium fluorida (CAF2). Dalam aplikasi bahan nanokomposit dalam pergigian. Pulih dari Scientedirect.com.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Kalsium fluorida. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Weman, k. (2012). Kimpalan Manual Arka Logam (MMA) dengan elektrod bersalut. Dalam Buku Panduan Proses Kimpalan (edisi kedua). Pulih dari Scientedirect.com.
- Hanning, m. dan Hanning, c. (2013). Nanobiomaterials dalam Pergigian Pencegahan. Kalsium fluorida nanosized. Dalam nanobiomaterials dalam pergigian klinikal. Pulih dari Scientedirect.com.
- Ropp, r.C. (2013). Kumpulan 17 (H, F, CL, BR, I) Sebatian Bumi Alkali. Kalsium fluorida. Dalam ensiklopedia sebatian bumi alkali. Pulih dari Scientedirect.com.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Valkovic, v. (2000). Pengukuran radioaktiviti. Dalam radioaktiviti di alam sekitar. Pengesan Themoluminescent (TLDS). Pulih dari Scientedirect.com.
- « Struktur, sifat, menggunakan, menggunakan, menggunakan, menggunakan
- Struktur, sifat silikon oksida (SiO2), penggunaan, mendapatkan »

