Struktur, sifat silikon oksida (SiO2), penggunaan, mendapatkan

- 5066
- 266
- Ms. Micheal Rippin
Dia silikon oksida Ia adalah pepejal bukan organik yang dibentuk oleh kesatuan atom silikon dan dua oksigen. Formula kimianya adalah sio2. Kompaun semulajadi ini juga dipanggil silikon atau silikon dioksida.
SIO2 Ia adalah mineral yang paling banyak di kerak bumi, kerana pasir terdiri daripada silika. Menurut strukturnya, silika boleh menjadi kristal atau amorf. Ia tidak larut dalam air, tetapi larut dalam alkali dan asid fluorhoric HF.
 Pasir adalah sumber silikon dioksida sio2. ರವಿಮುಂ [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Pasir adalah sumber silikon dioksida sio2. ರವಿಮುಂ [cc by-sa 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. SIO2 Ia juga terdapat dalam struktur tumbuhan, bakteria dan kulat tertentu. Juga dalam kerangka organisma laut. Di samping pasir, terdapat juga jenis batu lain yang silika.
Silika mempunyai penggunaan yang sangat meluas memenuhi pelbagai fungsi. Penggunaan yang paling meluas adalah seperti bahan penapisan cecair seperti minyak dan produk minyak, minuman seperti bir dan wain, serta jus buah.
Tetapi ia mempunyai banyak aplikasi lain. Salah satu yang paling berguna dan penting adalah dalam pembuatan kaca bioaktif, yang membolehkan "perancah" di mana sel -sel tulang tumbuh untuk menghasilkan bahagian tulang yang hilang akibat kemalangan atau penyakit.
[TOC]
Struktur
Silicio sio dioksida2 Ia adalah molekul tiga -atom, di mana atom silikon dikaitkan dengan dua atom oksigen dengan ikatan kovalen.
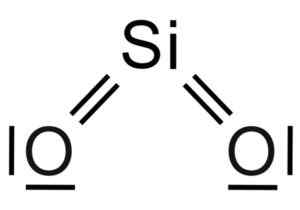 Struktur kimia molekul SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Struktur kimia molekul SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Unit struktur silika pepejal seperti itu adalah tetrahedron di mana atom silikon dikelilingi oleh 4 atom oksigen.
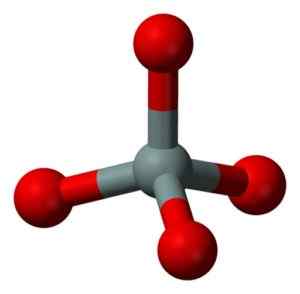 Unit struktur silika pepejal: kelabu = silikon, merah = oksigen. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons.
Unit struktur silika pepejal: kelabu = silikon, merah = oksigen. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons. Tetrahedra mengikat antara satu sama lain berkongsi atom oksigen dari simpul bersebelahan.
Itulah sebabnya atom silikon berkongsi separuh setiap 4 atom oksigen dan ini menerangkan nisbah dalam sebatian 1 atom silikon pada 2 atom oksigen (SIO2).
 Tetrahedra berkongsi oksigen di SIO2. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons.
Tetrahedra berkongsi oksigen di SIO2. Benjah-bmm27 [domain awam]. Sumber: Wikimedia Commons. Sebatian SIO2 Mereka dibahagikan kepada dua kumpulan: silika kristal dan silika amorf.
Sebatian silika kristal mempunyai struktur dengan corak silikon dan oksigen berulang.
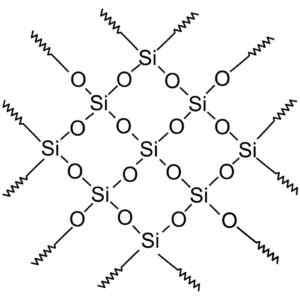 Silika kristal mempunyai unit berulang. Wersję Rastrową Wykonał użytkownik Polskiego Projektu Wikipedii: Polyimerek, Zwekoryzował: Krzysztof Zajączkowski [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Sumber: Wikimedia Commons.
Silika kristal mempunyai unit berulang. Wersję Rastrową Wykonał użytkownik Polskiego Projektu Wikipedii: Polyimerek, Zwekoryzował: Krzysztof Zajączkowski [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Sumber: Wikimedia Commons. Semua kristal silika boleh dianggap sebagai molekul gergasi di mana rangkaian kristal sangat kuat. Tetrahedra boleh dikaitkan dengan pelbagai cara, menimbulkan pelbagai bentuk kristal.
Boleh melayani anda: Bravais Networks: Konsep, Ciri, Contoh, LatihanDalam silika amorf, strukturnya dikaitkan secara rawak, tanpa mengikuti corak biasa antara molekul dan ini dalam hubungan spatial yang berbeza antara satu sama lain.
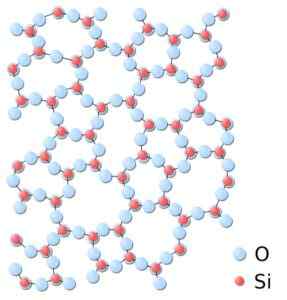 Dalam silika amorf, kesatuan tidak berulang -ulang atau seragam. Silika.SVG: *Silika.JPG: Dalam: Pengguna: JDrewittDerivevative Work: Matt [Domain Awam]. Sumber: Wikimedia Commons.
Dalam silika amorf, kesatuan tidak berulang -ulang atau seragam. Silika.SVG: *Silika.JPG: Dalam: Pengguna: JDrewittDerivevative Work: Matt [Domain Awam]. Sumber: Wikimedia Commons. Nomenclature
-Silikon oksida
-Silikon dioksida
-Silika
-Kuarza
-Tridimita
-Cristobalita
-Dioxosilano
Sifat
Keadaan fizikal
Warna tidak berwarna ke kelabu.
 Sampel SIO2 Murni. Lhchem [cc by-sa 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons.
Sampel SIO2 Murni. Lhchem [cc by-sa 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]. Sumber: Wikimedia Commons. Berat molekul
60,084 g/mol
Takat lebur
1713 ºC
Takat didih
2230 ºC
Ketumpatan
2,17-2,32 g/cm3
Kelarutan
Tidak larut dalam air. Silika amorf boleh larut dalam alkali, terutamanya jika dibahagikan dengan halus. Larut dalam asid fluorhorhoric hf.
Silika amorf kurang hidrofilik, iaitu, kurang berkaitan dengan air daripada kristal.
Sifat kimia
SIO2 o Silika pada dasarnya tidak aktif dengan kebanyakan bahan, ia sangat sedikit reaktif.
Menentang serangan klorin cl2, Bromo Br2, Hidrogen h2 dan kebanyakan asid pada suhu bilik atau sedikit lebih tinggi. Diserang oleh fluorin f2, Asid fluorhorhoric HF dan alkali seperti natrium karbonat2Co3.
SIO2 Ia boleh digabungkan dengan elemen logam dan oksida untuk membentuk silikat. Sekiranya silika cair dengan karbonat logam alkali pada kira -kira 1300 ° C, silikat alkali diperoleh dan Co2.
Ia bukan bahan api. Ia mempunyai kekonduksian terma yang rendah.
Kehadiran dalam alam
Sumber silika utama di alam adalah pasir.
SIO2 o Silika adalah dalam bentuk tiga jenis kristal: kuarza (yang paling stabil), tridimita dan cristobalita. Amorfant untuk Silika adalah Agata, Jaspe dan ónice. Opal adalah silika terhidrat amorf.
Terdapat juga silika biogenik yang dipanggil, iaitu, yang dihasilkan oleh organisma hidup. Sumber jenis silika ini adalah bakteria, kulat, diatom, span laut dan tumbuh -tumbuhan.
Bahagian cerah dan keras buluh dan jerami mengandungi silika, dan kerangka beberapa organisma laut juga mempunyai sebahagian besar silika; Walau bagaimanapun, yang paling penting adalah diatomator.
Tanah diatomea adalah produk geologi organisma uniselular yang rosak (alga).
Boleh melayani anda: Debu kosmikJenis silika semulajadi lain
Secara semula jadi terdapat juga jenis berikut:
- Silikan vitreous yang kaca gunung berapi
- Milleritas yang kaca semulajadi yang dihasilkan oleh gabungan bahan siliceous di bawah kesan meteorit
- Silika cair yang dipanaskan silika ke fasa cecair dan disejukkan tanpa membenarkan kristal
Memperoleh
Silika dari arena diperoleh terus dari kuari.
 Arena Quarry di California. Ruff Tux Cream Puff [CC0]. Sumber: Wikimedia Commons.
Arena Quarry di California. Ruff Tux Cream Puff [CC0]. Sumber: Wikimedia Commons. Diatomit atau diatom juga diperoleh dengan cara ini, menggunakan jengkaut dan peralatan yang serupa.
Silika amorf disediakan berdasarkan larutan silikat logam alkali berair (seperti natrium NA) dengan peneutralan dengan asid, seperti asid sulfurik H2SW4, Asid hidroklorik HCL atau karbon dioksida2.
Sekiranya pH terakhir larutan adalah neutral atau alkali, silika yang dicetuskan diperolehi. Sekiranya pH adalah asid, silika gel diperolehi.
Silika pyrogenic disediakan oleh pembakaran sebatian silikon yang tidak menentu, biasanya silikon sicl tetrachloride4. Silika yang dicetuskan diperoleh dari larutan silikat berair yang asid ditambah.
Silika koloid adalah penyebaran stabil zarah koloid silika amorf dalam larutan berair.
Aplikasi
Dalam beberapa aplikasi
Silika atau Sio2 Ia mempunyai pelbagai fungsi, contohnya ia berfungsi sebagai kasar, penyerap, antiapelmazante, disumbat, membatalkan dan memihak kepada penggantungan bahan -bahan lain, di antara banyak cara pekerjaan lain.
Ia digunakan sebagai contoh:
-Dalam kaca, keramik, refraktori, kasar dan larut pembuatan kaca
-Pembatalan dan penyucian minyak dan produk minyak
-Dalam acuan untuk Foundry
-Sebagai antiapelmazante serbuk dari semua jenis
-Sebagai antispumant
-Untuk menapis cecair seperti pelarut basuh kering, air kolam renang dan air kumbahan perbandaran dan perindustrian
-Dalam pembuatan penebat haba, batu bata api dan bahan pembungkusan yang tahan terhadap api dan asid
-Seperti mengisi pembuatan kertas dan kad, untuk menjadikannya lebih tahan
-Seperti yang dipenuhi dengan lukisan untuk meningkatkan aliran dan warna
-Dalam bahan untuk menggilap logam dan kayu, kerana mereka memberi mereka abrasiveness
-Dalam makmal analisis kimia dalam kromatografi dan sebagai penyerap
-Sebagai antiapelmazante insektisida dan formula agrokimia, untuk membantu mengisar racun perosak dan sebagai pembawa kompaun aktif
-Sebagai sokongan pemangkin
-Seperti mengisi untuk mengukuhkan getah sintetik dan karet
Boleh melayani anda: Gelombang membujur: ciri, perbezaan, contoh-Sebagai pembawa cecair dalam makanan haiwan
-Dalam dakwat cetak
-Sebagai pengertian dan penyerap, dalam bentuk gel silika
-Sebagai bahan tambahan dalam simen
-Sebagai pasir haiwan peliharaan
-Dalam penebat mikroelektronik
-Dalam suis termoptik
 Gel silika. Kenpei [cc by-sa 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Sumber: Wikimedia Commons.
Gel silika. Kenpei [cc by-sa 3.0 (http: // creativeCommons.Org/lesen/by-sa/3.0/]]. Sumber: Wikimedia Commons. Dalam industri makanan
Silika amorf dimasukkan ke dalam pelbagai produk makanan sebagai bahan langsung pelbagai fungsi dalam pelbagai jenis makanan. Anda tidak boleh melebihi 2% makanan siap.
Sebagai contoh, ia berfungsi sebagai antiapelmazante (untuk mengelakkan makanan tertentu daripada melekat), sebagai penstabil dalam pengeluaran bir, sebagai antiprecipitator, untuk menapis wain, bir dan jus buah atau sayur -sayuran.
 Pasukan untuk penapisan wain dengan diatom (SIO2). Fabio Ingroso [CC oleh 2.0 (https: // creativeCommons.Org/lesen/by/2.0)]. Sumber: Wikimedia Commons.
Pasukan untuk penapisan wain dengan diatom (SIO2). Fabio Ingroso [CC oleh 2.0 (https: // creativeCommons.Org/lesen/by/2.0)]. Sumber: Wikimedia Commons. Ia berfungsi sebagai penyerap cecair dalam beberapa makanan dan komponen mikrokapsul untuk minyak perisa.
Di samping itu SIO2 Amorfus digunakan melalui proses khas di permukaan plastik artikel untuk mengemas makanan, bertindak sebagai penghalang.
Dalam industri farmaseutikal
Ia ditambah sebagai agen antiapelmazante, penebalan, gelling dan sebagai excipient, iaitu, sebagai pembantu membentuk beberapa ubat dan vitamin.
Dalam industri kosmetik dan penjagaan peribadi
Ia digunakan dalam pelbagai produk: dalam serbuk muka, bayang -bayang mata, eyeliner mata, lipstik, pewarna, tempat perlindungan solek, talcos, serbuk kaki, pewarna rambut dan peluntur dan peluntur.
Juga dalam minyak dan garam mandi, mandi buih, tangan dan krim badan.
Juga dalam krim penghidratan malam, kecerahan dan cat kuku.
Dalam aplikasi terapeutik
SIO2 Ia terdapat dalam kaca bioaktif atau biovidrios yang ciri utamanya adalah bahawa mereka boleh bertindak balas secara kimia dengan persekitaran biologi yang mengelilingi mereka, membentuk hubungan yang kuat dan tahan lama dengan tisu hidup.
Bahan jenis ini berfungsi untuk menjadikan pengganti tulang seperti wajah, seperti "perancah" di mana sel tulang akan tumbuh. Mereka telah menunjukkan biokompatibiliti yang baik dengan kedua -dua tulang dan tisu lembut.
Biovidrios ini akan membolehkan untuk memulihkan tulang dari muka kepada orang yang telah kehilangannya secara tidak sengaja atau penyakit.
Risiko
Zarah silika yang sangat nipis boleh digantung di udara dan membentuk serbuk bukan explosive. Tetapi debu ini dapat merengsakan kulit dan mata. Penyedutannya menyebabkan kerengsaan saluran pernafasan.
Di samping itu, penyedutan habuk silika menghasilkan kerosakan panjang paru -paru, yang dipanggil silicosis.
Rujukan
- Atau.S. Perpustakaan Perubatan Negara. (2019). Silikon dioksida. Pulih dari pubchem.NCBI.NLM.NIH.Gov.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.
- Da Silva, m.R. et al. (2017). Teknik Pengekstrakan Hijau. Sorbnts berasaskan silika. Dalam memahami kimia analisis. Pulih dari Scientedirect.com.
- Ylänen, h. (editor). (2018). Gelas bioaktif: Bahan, Hartanah dan Aplikasi (Edisi Kedua). Elsevier. Pulih dari buku.Google.co.Pergi.
- Windholz, m. et al. (editor) (1983) Indeks Merck. Ensiklopedia bahan kimia, drarug dan biologi. Edisi Kesepuluh. Merck & Co., INC.
- Mäkinen, j. Dan suni, t. (2015). Wafer filem tebal. Dalam Buku Panduan Silicon berasaskan Bahan dan Teknologi (Edisi Kedua). Pulih dari Scientedirect.com.
- SILLETO, l. et al. (2010). Suis thermo-optik. Silicon Nanocrystals. Pulih dari Scientedirect.com.
- « Struktur, Ciri -ciri Kalsium Fluorida (CAF2), Kegunaan, Kegunaan
- 275 piropos untuk lelaki romantis dan seksi »

