Struktur fluorida magnesium, sifat, sintesis, kegunaan
- 3755
- 162
- Erick Krajcik
Dia Magnesium fluorida Ia adalah garam bukan organik yang tidak berwarna yang formula kimianya adalah mgf₂. Terdapat di alam semulajadi sebagai mineral Sealíta. Ia mempunyai titik gabungan yang sangat tinggi dan sangat larut dalam air. Ia agak tidak aktif, kerana, sebagai contoh, tindak balasnya terhadap asid sulfurik adalah perlahan dan tidak lengkap dan menahan hidrolisis dengan asid fluorhoric (HF) hingga 750ºC.
Ia adalah sebatian yang sedikit terjejas oleh sinaran tenaga yang tinggi. Di samping itu, ia mempunyai indeks pembiasan yang rendah, rintangan kakisan yang tinggi, kestabilan terma yang baik, kekerasan yang ketara dan sifat penghantaran cahaya yang sangat baik, UV (Ultraviolet) dan IR (Inframerah).

Ciri -ciri ini mempunyai prestasi yang sangat baik dalam bidang optik dan, di samping itu, mereka menjadikannya bahan yang berguna seperti sokongan pemangkin, elemen salutan, kanta anti -reflex dan tingkap untuk penghantaran inframerah, antara aplikasi lain.
[TOC]
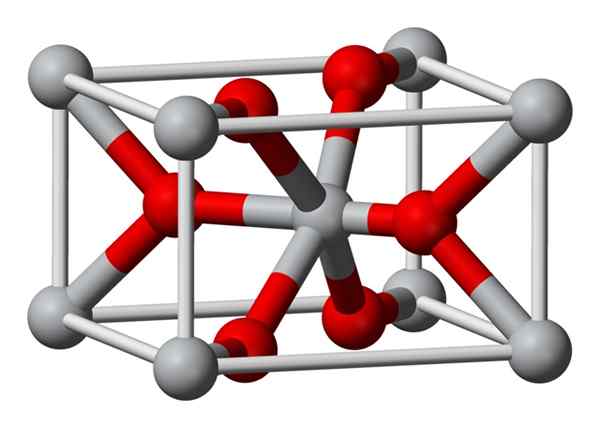
Struktur
Struktur kristal fluorida magnesium yang disediakan secara kimia adalah jenis yang sama dengan mineral semula jadi sellaíta. Mengkristal dalam kelas dipiramidal sistem tetragonal.
Ion magnesium (mg2+) terletak di berpusatkan ruang berpusatkan tetragonal, manakala ion fluorida (f-) didapati dalam satah yang sama jiran mereka Mg2+ dan dikaitkan dengan ini, dikelompokkan secara berpasangan dengan setiap pasangan. Jarak antara Mg2+ dan F-ion adalah 2.07 Å (angstroms) (2.07 × 10-10m).
Koordinasi kristalnya ialah 6: 3. Ini bermakna setiap ion Mg2+ dikelilingi oleh 6 ion f- dan setiap ion f-, pada gilirannya, dikelilingi oleh 3 mg2+ 5 ion.
Strukturnya sangat serupa dengan mineral Rutilo, yang merupakan bentuk semula jadi titanium dioksida (TiO2), yang mana ia mempunyai beberapa sifat crystographic yang sama.
Semasa mendapatkannya, fluorida magnesium tidak mendakan dalam bentuk pepejal amorf, kerana Mg2+ dan F-ion tidak cenderung membentuk kompleks polimer dalam larutan.
Sifat
Sangat menarik untuk menekankan bahawa magnesium fluorida adalah bahan birrefringent. Ini adalah harta optik yang membolehkan anda membentangkan sinar cahaya insiden menjadi dua sinaran berasingan yang tersebar di pelbagai gelombang dan panjang gelombang.
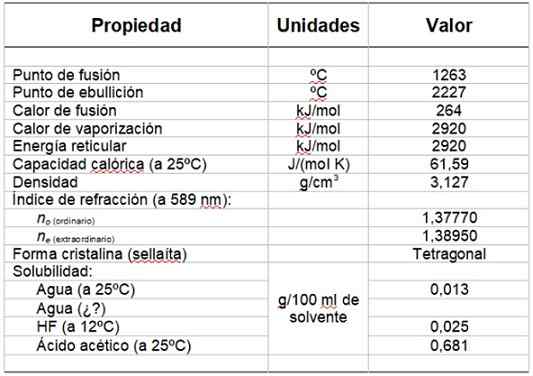
Boleh melayani anda: kumpulan hidroksilJadual 1 menunjukkan beberapa sifatnya.
Jadual 1. Ciri -ciri fizikal dan kimia fluorida magnesium.
Sintesis dan penyediaan
Ia boleh disediakan dalam beberapa cara, di antaranya yang berikut dapat disebutkan:
1-kerana tindak balas antara magnesium oksida (MGO) atau magnesium karbonat (MGCO3) dengan asid fluorida (HF) 2:
MGO + 2 HF MGF2 + H2O
MGCO3 + 2 HF MGF2 + CO2 + H2O
2-untuk tindak balas antara magnesium karbonat dan ammonium bifluoruro (NH4HF2), kedua-duanya dalam keadaan pepejal, pada suhu antara 150 dan 400ºC2:
150-400ºC
MGCO3 + NH4HF2 MGF2 + NH3 + CO2 + H2O
3-Calento Penyelesaian berair magnesium karbonat dan ammonium fluorida (NH4F) dengan kehadiran ammonium hidroksida (NH4OH) pada 60ºC 2:
60ºC, NH4OH
MGCO3 + 3 NH4F NH4MGF3 + (NH4) 2CO3
Mendeskit ammonium dan magnesium fluorida (NH4MGF3) kemudian dipanaskan hingga 620ºC selama 4 jam untuk mendapatkan fluorida magnesium:
620ºC
NH4MGF3 MGF2 + NH3 + HF
4-sebagai hasil sampingan mendapatkan berilium (be) dan uranium (u). Fluorida elemen yang dikehendaki dengan magnesium logam dipanaskan dalam periuk lebur MGF2 2 yang dicatatkan:
BEF2 + MG BE + MGF2
5-Hacing React Magnesium Chloride (MGCL2) dengan ammonium fluorida (NH4F) dalam larutan akueus pada suhu bilik 3:
25ºC, H2O
MGCL2 + 2 NH4F MGF2 + 2NH4CL
Oleh kerana kaedah penyediaan MGF2 mahal, terdapat percubaan untuk mendapatkannya lebih ekonomi, di antaranya kaedah menghasilkannya dari air laut.
Boleh melayani anda: Kalsium hidrida (CAH2): Hartanah, kereaktifan dan kegunaanIni dicirikan dengan menambahkan ion fluorida yang cukup (F-) ke air laut, yang mempunyai kepekatan magnesium yang banyak (Mg2+), sehingga memihak kepada pemendakan Mgf2.
Kristal fluorida magnesium optik diperolehi dengan tekanan panas dari mgf2 berkualiti tinggi, diperolehi, sebagai contoh, oleh kaedah NH4HF2.
Terdapat banyak teknik untuk menyediakan bahan fluorida magnesium, seperti pertumbuhan kaca tunggal, sintering (pemadatan hingga acuan atau bentuk) tanpa tekanan, panas dan sintering ditekan dengan gelombang mikro.
Aplikasi
Optik
Kristal MGF2 sesuai untuk aplikasi optik kerana mereka telus dari rantau UV ke rantau purata IR 2,10.
Sebagai filem lengai digunakan untuk mengubah sifat transmisi cahaya bahan optik dan elektronik. Salah satu aplikasi utama adalah dalam optik VUV untuk teknologi penerokaan ruang angkasa.
Kerana sifat birrefringencynya, bahan ini berguna dalam optik polarisasi, dalam tingkap laser dan prisma ecimer (jenis laser ultraviolet yang digunakan dalam pembedahan okular).
Harus diingat bahawa fluorida magnesium yang digunakan dalam pembuatan bahan optik filem nipis mestilah bebas daripada kekotoran atau sebatian yang merupakan sumber oksida, seperti air (H2O), ion hidroksida (OH-), ion karbonat (CO3 = ), Ion sulfat (SO4 =), dan serupa 12.
Pemangkinan atau percepatan reaksi
MGF2 telah berjaya digunakan sebagai sokongan pemangkin untuk reaksi penghapusan klorin dan penambahan hidrogen di CFC (chlorofluorocarbons), penyejuk yang terkenal dan penyejuk aerosol, dan bertanggungjawab terhadap kerosakan pada lapisan ozon atmosfera.
Sebatian yang dihasilkan, HFC (Hydrofluorocarbones) dan HCFC (Hydrochlorofluorocarbones), tidak membentangkan kesan berbahaya ini ke atmosfera 5.
Ia juga berguna sebagai sokongan untuk pemangkin untuk hidrodesulfration (penghapusan sulfur) sebatian organik.
Boleh melayani anda: keseimbangan kimia: penjelasan, faktor, jenis, contohKegunaan lain
Bahan yang dihasilkan oleh grafit, fluorin dan interleave.
Euttik yang dibentuk oleh NAF dan MGF2 membentangkan sifat penyimpanan tenaga dalam haba laten, jadi ia telah dipertimbangkan untuk digunakan dalam sistem tenaga solar.
Di kawasan biokimia, magnesium fluorida, bersama -sama dengan fluorida logam lain, digunakan untuk menghalang tindak balas pemindahan fosforil dalam enzim.
Baru -baru ini, nanopartikel MGF2 telah berjaya diuji sebagai vektor penempatan dadah dalam sel sakit untuk rawatan kanser.
Rujukan
- Buckley, h.Dan. dan Vernon, w.S. (1925) xciv. Struktur kristal fluorida magnesium. Siri Majalah Philosophical 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Ensiklopedia Teknologi Kimia, Jilid 11, Edisi Kelima, John Wiley & Sons. ISBN 0-471-52680-0 (v.sebelas).
- Peng, Minhong; Cao, weiping; dan lagu, Jinhong. (2015). Penyediaan seramik lutin MGF2 dengan sintering menekan panas. Jurnal Wuhan University of Technology-Mater: SCI. Ed. Vol. 30 tidak. 4.
- Tidak, и.C. (2011). Fluoride magnesium. Sumber: Kerja Sendiri.
- Wojciechowska, Maria; Zielinski, Michal; dan Piettowski, Mariusz. (2003). Mgf2 sebagai sokongan pemangkin yang tidak konfvensi. Jurnal Kimia Fluorin, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluoride magnesium (mgf2). Berunding pada 07/12/2019 di: Korth.dari
- Sevonkaev, Igor dan Matijevic, Egon. (2009). Pembentukan zarah fluorida magnesium dari morfologi yang berbeza. Langmuu 2009, 25 (18), 10534-10539.
- Tidak, и.C. (2013). Fluoride magnesium. Sumber: Kerja Sendiri.
- Tao Qin, Peng Zhang dan Weiwei Qin. (2017). Kaedah novel untuk mensintesis sfera fluorida magnesium kos rendah dari air laut. Seramik Antarabangsa 43 (2017) 14481-14483.
- Ensiklopedia Kimia Perindustrian Ullmann (1996) Edisi Kelima. Jilid A11. VCH Verlagsgellschaft MBH. New York. ISBN 0-89573-161-4.
- NASA (2013). Jurutera Memeriksa Cermin Utama Teleskop Angkasa Hubble 8109563. Sumber: Campurkan.MSFC.periuk.Gov

