Fluorida Potassium (KF)
- 2662
- 166
- Ms. Micheal Rippin
 Struktur fluorida kalium. Sumber: Benjah-bmm27, Wikimedia Commons
Struktur fluorida kalium. Sumber: Benjah-bmm27, Wikimedia Commons Apa itu kalium fluorida?Dia Potassium fluoride Ia adalah halogenida tak organik yang terdiri daripada garam yang terbentuk antara logam dan halogen. Formula kimianya adalah kf, yang bermaksud bahawa bagi setiap kation k+ Ada f- rakan sejawat. Interaksi adalah elektrostatik, dan akibatnya tidak ada pautan kovalen k-f.
Garam ini dicirikan oleh kelarutan yang melampau di dalam air, jadi ia membentuk hidrat, menyerap kelembapan dan sedap. Oleh itu, sangat mudah untuk menyediakan penyelesaian berair, yang berfungsi sebagai sumber anion fluorida untuk semua sintesis di mana ia diinginkan untuk memasukkannya ke dalam beberapa struktur.
KI dihasilkan dengan bertindak balas kalium karbonat dengan asid fluorhorhoric, menghasilkan kalium bifluoride (KHF2), yang, disebabkan oleh penguraian haba, akhirnya menyebabkan fluorida kalium.
Struktur fluorida kalium
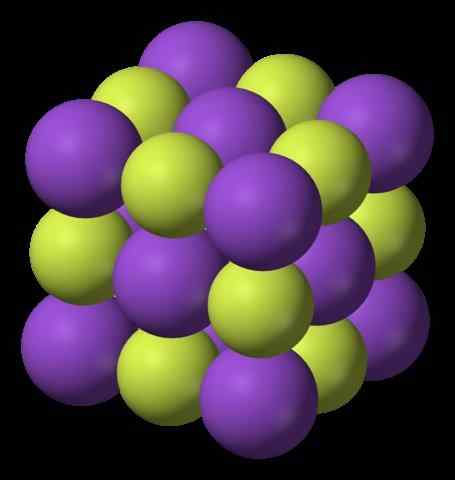
Imej atas menunjukkan struktur fluorida kalium. Lingkaran ungu mewakili kation k+, Manakala sfera kekuningan mewakili anion f-.
Perhatikan bahawa susunannya adalah padu dan sepadan dengan struktur garam Gema, sangat mirip dengan natrium klorida. Semua sfera dikelilingi oleh enam jiran, yang membentuk kf octahedron6 atau FK6, iaitu, masing -masing k+ Ia dikelilingi oleh enam f-, Dan perkara yang sama berlaku untuk sebaliknya.
Sebelum ini disebutkan bahawa KF adalah hygroscopic dan, oleh itu, menyerap kelembapan alam sekitar. Oleh itu, pengaturan yang ditunjukkan akan sesuai dengan bentuk anhydrous (tanpa air) dan bukan kepada hidratnya, yang menyerap begitu banyak air yang bahkan solubilize dan "cair" (delicuescence).
Boleh melayani anda: neon: sejarah, sifat, struktur, risiko, kegunaanMenghidrat
Struktur kristal hidrat menjadi kurang mudah. Kerana sekarang molekul air campur tangan terus ke dalam pengaturan dan berinteraksi dengan kim+ dan f-. Salah satu hidrat yang paling stabil ialah KF · 2H2O y kf · 4h2Sama ada.
Dalam kedua -dua menghidrat octahedra yang baru disebutkan cacat kerana molekul air. Ini disebabkan terutamanya oleh jambatan hidrogen antara f- dan h₂o (f--Hoh). Kajian kristalografi telah menentukan bahawa, walaupun ini, kedua -dua ion terus mengekalkan bilangan jiran yang sama.
Akibatnya, struktur padu asal untuk fluorur kalium anhydrous.
Anhydros berkongsi delicuest.
Sifat fluorida kalium
- Berat molekul: 58,097 g/mol.
- Penampilan fizikal (warna): Kristal padu putih atau debu kristal yang lebih baik.
- Rasa: rasa garam akut.
- Takat didih: 2.741 ° F pada 760 mmHg (1502 ° C). Dalam keadaan cair ia menjadi konduktor elektrik, walaupun anion f mungkin- Jangan bekerjasama dalam tahap yang sama untuk memandu sebagai k+.
- Takat lebur: 1.576 ° F; 858 ° C; 1131 K (kf anhidro). Ini menunjukkan hubungan ioniknya yang kuat.
- Kelarutan: Larut dalam hf, tetapi tidak larut dalam alkohol. Ini menunjukkan bahawa jambatan hidrogen antara fluorida dan alkohol, f--Hor, mereka tidak memihak kepada proses solvation terhadap pembubaran rangkaian kristalnya.
- Kelarutan air: anhydrous 92 g/100 ml (18 ° C); 102 g/100 ml (25 ° C); Dihydrared 349.3 g/100 ml (18 ° C). Iaitu, kerana KF terhidrasi, ia menjadi lebih larut dalam air.
- Ketumpatan: 2.48 g/cm3.
- Tekanan wap: 100 kPa (750 mm Hg) pada 1.499 ° C.
- Penguraian: Apabila dia dipanaskan untuk penguraian, dia mengeluarkan asap toksik dari kalium oksida dan fluorida hidrogen.
- Tindakan Kakisan: Larutan berair menghancurkan kaca dan porselin.
- Titik kilat: Ia bukan bahan mudah terbakar
- Indeks Pembiasan Eksperimen (ηD): 1.363.
- Kestabilan: stabil jika ia dilindungi dari kelembapan, kerana sebaliknya pepejal dibubarkan. Tidak serasi dengan asid dan asas yang kuat.
Kegunaan fluorida kalium
- Laraskan pH: Penyelesaian fluorida kalium berair digunakan dalam aplikasi dan proses perindustrian. Sebagai contoh, penyelesaian KF membenarkan pH diselaraskan dalam pembuatan yang dijalankan dalam pemprosesan tekstil dan kemudahan dobi (mereka kira -kira nilai 7).
- Sumber fluorin: Kalium fluorida adalah, selepas fluorida hidrogen, sumber utama mendapatkan fluorida. Elemen ini digunakan dalam loji nuklear dan dalam pengeluaran sebatian bukan organik dan organik, ada yang menggunakan penggunaan seperti penggabungan mereka dalam dentifriques.
- Sintesis fluorocarbone: Fluorida kalium boleh digunakan dalam sintesis fluorbone atau fluorcarbide dari klorokarbon, dengan menggunakan reaksi finkeistein. Dalam tindak balas ini, etilena glikol dan dimetilsulfoksida digunakan sebagai pelarut.
- Fluorination: Seperti sumber fluorin di mana ia terletak di dalam air, dari penyelesaian mereka, mereka dapat mensintesis fluorida kompleks, iaitu, mereka dimasukkan dengan F- kepada struktur. Contohnya adalah dalam persamaan kimia berikut:
Mnbr2(ac) + 3kf (ac) => kmnf3(s) + 2kbr (ac)
- Kemudian mendahului fluorida bercampur KMNF3. Oleh itu, f boleh ditambah- menjadi sebahagian daripada garam logam kompleks. Sebagai tambahan kepada mangan, fluorida logam lain boleh tergesa -gesa: KCOF3, Kfef3, Knif3, KCF3 dan kznf3.
- Begitu juga, fluorida boleh dimasukkan secara kovalen ke dalam cincin aromatik, mensintesis organisasi.
- Beberapa: KF digunakan sebagai bahan pertengahan atau kasar untuk sintesis sebatian yang digunakan terutamanya dalam produk agrokimia atau racun perosak.
- Di samping itu, ia digunakan sebagai ejen pengasas kimpalan.
Rujukan
- Potassium fluoride. Pulih dari buku kimia.com.
- Potassium fluoride. Pulih dari pubchem.NCBI.NLM.NIH.Gov.

