Kalsium fosfat (CA3 (PO4) 2)

- 1745
- 53
- Clarence Greenholt DDS
Dia Kalsium fosfat Ia adalah garam tak organik dan tertiari yang formula kimia adalah ca3(PO4)2. Formula menetapkan bahawa komposisi garam ini adalah 3: 2 untuk kalsium dan fosfat,. Ini dapat dilihat secara langsung dalam imej yang lebih rendah, di mana kation ditunjukkan2+ dan anion po43-. Untuk setiap tiga ca2+ Terdapat dua PO43- Berinteraksi dengan mereka.
Sebaliknya, kalsium fosfat merujuk kepada satu siri garam yang berbeza -beza bergantung kepada nisbah Ca/P, serta tahap penghidratan dan pH. Malah, terdapat banyak jenis fosfat kalsium yang wujud dan boleh disintesis. Walau bagaimanapun, berikutan surat itu, tatanama, kalsium fosfat hanya merujuk kepada tricycal, yang disebutkan di atas.
 Perkadaran dan ion dalam fosfat tricycal. Sumber: Richard-59 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], dari Wikimedia Commons
Perkadaran dan ion dalam fosfat tricycal. Sumber: Richard-59 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], dari Wikimedia Commons Semua fosfat kalsium, termasuk CA3(PO4)2, Mereka adalah pepejal putih dengan nada kelabu yang sedikit. Mereka boleh berbutir, halus, kristal, dan mempunyai saiz zarah yang berada di sekitar mikrometer; Dan juga nanopartikel fosfat ini telah disediakan, dengan mana bahan biokompatibel untuk tulang direka.
Biokompatibiliti ini adalah kerana garam ini terdapat di gigi dan dalam akaun pendek dalam tisu tulang mamalia. Contohnya, hydroxyapatite adalah kalsium fosfat kristal, yang seterusnya berinteraksi dengan fasa amorf garam yang sama.
Ini bermakna terdapat fosfat calcios amorf dan kristal. Atas sebab itu, tidak menghairankan kepelbagaian dan pelbagai pilihan apabila mensintesis bahan berdasarkan kalsium fosfat; Bahan di mana sifatnya setiap hari adalah penyelidik yang lebih berminat di seluruh dunia untuk memberi tumpuan kepada pemulihan tulang.
Struktur kalsium fosfat
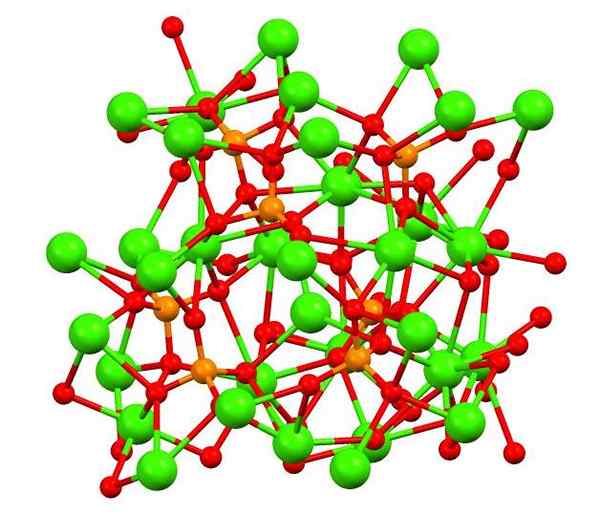 Kalsium fosfat dalam mineral whitlockita. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons
Kalsium fosfat dalam mineral whitlockita. Sumber: Smokefoot [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)], dari Wikimedia Commons Imej atas menunjukkan struktur fosfat calic tribasic dalam mineral whitlockita aneh, yang boleh mengandungi magnesium dan besi sebagai kekotoran.
Walaupun pada pandangan pertama ia mungkin kelihatan rumit, perlu menjelaskan bahawa model menganggap interaksi kovalen antara atom oksigen fosfat dan pusat logam kalsium.
Boleh melayani anda: Beryllium Hydride (Beh2)Sebagai perwakilan, bagaimanapun, adalah sah, interaksi adalah elektrostatik; iaitu,2+ Rasa tarikan untuk PO43- (AC2+- O-PO33-). Dengan ini, difahami mengapa dalam kalsium imej (sfera hijau) dikelilingi oleh atom oksigen yang dikenakan negatif (sfera merah).
Apabila terdapat banyak ion, susunan simetri atau corak tidak dapat dilihat. Ca3(PO4)2 mengamalkan pada suhu rendah (t<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(PO4)2 (β-TCP, untuk akronim dalam bahasa Inggeris).
Pada suhu tinggi, sebaliknya, ia menjadi polimorf α-CA3(PO4)2 (α-TCP), yang sel unitnya sepadan dengan sistem kristal monoklinik. Pada suhu yang lebih tinggi, polimorf α'-ca juga boleh dibentuk3(PO4)2, yang merupakan struktur kristal heksagon.
Kalsium fosfat amorf
Struktur kristal untuk kalsium fosfat telah disebutkan, yang dijangka dari garam. Walau bagaimanapun, ini mampu dipaparkan.
Apabila ini berlaku, dikatakan bahawa kalsium fosfat mempunyai struktur amorf (ACP, Kalsium fosfat amorf). Beberapa penulis menunjuk kepada jenis struktur ini yang bertanggungjawab terhadap sifat biologi CA3(PO4)2 Dalam tisu tulang, pembaikan dan biomimetisasi mungkin.
Selebihnya keluarga
Kalsium fosfat sebenarnya adalah keluarga sebatian bukan organik, yang seterusnya dapat berinteraksi dengan matriks organik.
Fosfat lain diperoleh "hanya" mengubah anion yang mengiringi kalsium (PO43-, HPO42-, H2PO4-, Oh-), seperti jenis kekotoran dalam pepejal. Oleh itu, sehingga sebelas kalsium atau lebih banyak fosfat, masing -masing dengan struktur dan sifat mereka sendiri, boleh berasal secara semula jadi atau buatan.
Sesetengah fosfat dan struktur dan formula kimia masing -masing akan disebutkan di bawah:
-Hidrogen Dihydro Calcium Phosphate, CAHPO4∙ 2h2O: Monoclinic.
Boleh melayani anda: ammonium oxalate-Dihydrogen monohydrated kalsium fosfat, CA (H (H2PO4)2∙ h2O: Triclinic.
-Anhydrous dease fosfat, ca (h2PO4)2: Triclinic.
-Hidrogen Octacalcic Phosphate (OCP), CA8H2(PO4)6: Triclinic. Ia adalah pendahulu dalam sintesis hidroksiapatit.
-Hydroxyapatite, ca5(PO4)3OH: Hexagonal.
Sifat fizikal dan kimia
Nama
-Kalsium fosfat
-Tricalcium fosfat
-Triccal diphosphate
Berat molekul
310.74 g/mol.
Penerangan fizikal
Ia adalah pepejal putih.
Rasa
Tidak sedap.
Takat lebur
1670 ºK (1391 ºC).
Kelarutan
-Praktikal tidak larut dalam air.
-Tidak larut dalam etanol.
-Larut dalam asid hidroklorik dan asid nitrik yang dicairkan.
Ketumpatan
3.14 g/cm3.
Indeks refraktif
1,629
Entalpi latihan standard
4126 kcal/mol.
Suhu penyimpanan
2-8 ºC.
Ph
6-8 dalam penggantungan berair 50 g/l kalsium fosfat.
Latihan
Kalsium dan hidrogen nitrat ammonium fosfat
Terdapat banyak kaedah untuk menghasilkan atau membentuk kalsium fosfat. Salah satu daripada mereka terdiri daripada campuran dua garam, CA (tidak3)2∙ 4h2Atau, dan (NH4)2HPO4, sebelum ini dibubarkan dalam alkohol dan air mutlak. Satu garam menyumbang kalsium, dan fosfat lain.
Dari campuran ini, ACP mendahului, yang kemudian mengalami pemanasan dalam ketuhar pada 800 ° C dan selama 2 jam. Hasil daripada prosedur ini, β-CA diperoleh3(PO4)2. Mengawal suhu, pergolakan dan masa hubungan dengan berhati -hati, pembentukan nanokrist boleh berlaku.
Untuk membentuk polimorf α-CA3(PO4)2 Adalah perlu untuk memanaskan fosfat melebihi 1000 ° C. Pemanasan ini dilakukan dengan kehadiran ion logam lain, yang menstabilkan polimorf ini cukup supaya ia dapat digunakan pada suhu bilik; iaitu, ia kekal dalam keadaan sasaran yang stabil.
Kalsium hidroksida dan asid fosforik
Kalsium fosfat juga boleh dibentuk dengan mencampurkan larutan asid hidroksida dan fosforik kalsium, penetapan asid-asas yang berlaku. Selepas setengah hari pematangan dalam semangat ibu, dan penapisan mereka, mencuci, mengeringkan dan diayak, habuk granular fosfat amorf, ACP diperolehi.
Produk reaksi ACP ini suhu tinggi, berubah mengikut persamaan kimia berikut:
2ca9(HPO4) (Po4)5(Oh) => 2ca9(Ms2Sama ada7)0.5(PO4)5(Oh) + h2O (A T = 446.60 ° C)
2ca9(Ms2Sama ada7)0.5(PO4)5(Oh) => 3ca3(PO4)2 + 0.5h2O (A T = 748.56 ° C)
Boleh melayani anda: selenium: sejarah, sifat, struktur, mendapatkan, kegunaanDengan cara ini β-CA diperoleh3(PO4)2, Polimorf yang paling biasa dan stabil.
Aplikasi
Dalam tisu tulang
Ca3(PO4)2 Ia adalah penyusun abu abu tulang yang tidak organik. Ini adalah komponen pemindahan pengganti tulang, ini dijelaskan oleh persamaan kimianya dengan mineral yang hadir di tulang.
Biomaterials dari kalsium fosfat digunakan untuk membetulkan kecacatan tulang dan meliputi prostesis logam. Kalsium fosfat didepositkan ke atasnya, mengasingkannya dari persekitaran dan melambatkan proses kakisan titanium.
Sememi bioceramic
Simen kalsium fosfat (CPC) adalah bioceramic lain yang digunakan dalam pembaikan tisu tulang. Ia dihuraikan dengan mencampurkan habuk pelbagai jenis fosfat kalsium dengan air, membentuk tampal. Pasta boleh disuntik atau diselaraskan ke kecacatan tulang atau rongga.
Semen dibentuk, secara beransur -ansur diserap semula dan digantikan oleh tulang yang baru terbentuk.
Doktor
-Ca3(PO4)2 Ia adalah garam asas, jadi ia digunakan sebagai antacid untuk meneutralkan keasidan perut berlebihan dan meningkatkan pH. Dalam pasta gigi membekalkan sumber kalsium dan fosfat untuk memudahkan proses remineralisasi gigi dan hemostasis tulang.
-Ia juga digunakan sebagai suplemen pemakanan, walaupun cara yang paling menjimatkan untuk membekalkan kalsium adalah dengan menggunakan karbonat dan sitratnya.
-Kalsium fosfat boleh digunakan dalam rawatan Tethany, hipokalkemia laten dan terapi penyelenggaraan. Di samping itu, ia berguna dalam suplemen kalsium semasa kehamilan dan penyusuan susu ibu.
-Ia digunakan dalam rawatan pencemaran dengan radio isotopos radioaktif (RA-226) dan strontium (SR-90). Kalsium fosfat menghalang penyerapan isotopo radioaktif dalam saluran pencernaan, dengan itu mengehadkan kerosakan yang disebabkan oleh mereka.
Yang lain
-Kalsium fosfat digunakan sebagai makanan untuk burung. Di samping itu, ia digunakan dalam pasta pergigian dalam kawalan tartar.
-Ia digunakan sebagai ejen anti -gomerant, contohnya untuk mengelakkan garam meja daripada menjadi kompak.
-Ia berfungsi sebagai ejen pemutihan tepung. Sementara itu, dalam mentega Cochino menghalang pewarnaan yang tidak diingini dan meningkatkan keadaan menggoreng.
Rujukan
- Kalsium fosfat. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Kalsium fosfat. Sains Langsung. Diperoleh dari: Scientedirect.com

