Sejarah fosforus, sifat, struktur, memperoleh, menggunakan

- 5011
- 1316
- Julius Dibbert
Dia perlawanan Ia adalah elemen bukan logam yang diwakili oleh simbol kimia p dan mempunyai nombor atom 15. Ia membentangkan tiga bentuk allotropik utama: fosforus putih, merah dan hitam. Fosforus putih adalah fosforus, terbakar secara spontan apabila terdedah kepada udara dan juga sangat beracun.
Fosforus putih pada suhu 250 ° C menjadi fosforus merah; bentuk polimer, tidak larut dan tidak terbakar di udara. Pada suhu tinggi dan tekanan, serta di hadapan atau tidak pemangkin, fosforus hitam diperolehi, yang menyerupai grafit dan merupakan konduktor elektrik yang baik.
 Fosforus putih disimpan dalam botol dengan air. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Fosforus putih disimpan dalam botol dengan air. Sumber: w. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Fosforus diasingkan untuk kali pertama oleh H. Jenama, pada tahun 1669. Untuk melakukan ini, air kencing digunakan sebagai sumber elemen ini. Pada tahun 1770, w. Scheele mendapati bahawa dia juga boleh melindungi fosforus tulang.
Seterusnya, disebabkan penciptaan ketuhar elektrik oleh j. Burgess Readman (1800), batu fosfat menjadi sumber utama pengeluaran fosforus dari bijih fluoroapatite, yang hadir di dalamnya.
Fosforus adalah dua belas unsur yang lebih banyak dari kerak bumi, dan mewakili 0.1% dari beratnya. Di samping itu, ia adalah elemen keenam yang banyak dalam tubuh manusia; Terutamanya tertumpu dalam tulang dalam bentuk hidroksilapatit.
Oleh itu, ia merupakan elemen penting untuk makhluk hidup, menjadi salah satu daripada tiga nutrien utama tumbuhan. Fosforus adalah sebahagian daripada struktur kimia asid nukleik; sebatian penyimpanan tenaga (ATP), koenzim; dan secara umum, sebatian metabolisme.
[TOC]
Sejarah
- Penemuan
Dalam air kencing
 Joseph Wright dari lukisan derby di mana penemuan fosforus menggambarkan. Sumber: Joseph Wright dari Derby [Domain Awam]
Joseph Wright dari lukisan derby di mana penemuan fosforus menggambarkan. Sumber: Joseph Wright dari Derby [Domain Awam] Fosforus diasingkan oleh jenama Henning pada tahun 1669, menjadi manusia pertama yang mengasingkan elemen. Jenama adalah alkimia Jerman dari Hamburg dan berjaya mendapatkan sebatian fosforus dari air kencing. Untuk melakukan ini, dia mengumpulkan air kencing sebanyak 50 baldi dan membenarkannya menguraikan.
Jenama kemudian menguap air kencing dan memperoleh sisa hitam, yang dikekalkan selama beberapa bulan. Ke pasir tambahan ini dan menghangatkannya, menguruskan untuk menghapuskan gas dan minyak. Akhirnya, dia memperoleh pepejal putih yang bersinar dalam gelap dengan warna hijau, yang dipanggil "api sejuk".
Istilah 'fosforus', secara kebetulan berasal dari perkataan Yunani "fosforos" yang bermaksud pembawa cahaya.
Jenama tidak menerbitkan hasil eksperimennya dan menjualnya kepada beberapa ahli alkimia, termasuk: Johann Kraft, Kunckel Lowenstern dan Wilhelm Leibniz. Mungkin, sesetengah daripada mereka melaporkan kerja jenama ke Akademi Sains Paris, dengan itu menyebarkan siasatan mereka.
Walau bagaimanapun, jenama tidak benar -benar mengasingkan fosforus, tetapi natrium fosfat ammoniacal [NH (NH (NH4) Po4]. Pada tahun 1680, Robert Boyle memperbaiki prosedur jenama, di mana dia dapat memperoleh bentuk fosforus alotropik (p4).
Di tulang
Johan Gottlieb Gahn dan Carl Wihelm Scheele ditubuhkan pada tahun 1769 bahawa sebatian fosforus, kalsium fosfat, berada di tulang. Tulang -tulang yang tidak berkesudahan itu tertakluk kepada proses pencernaan dengan asid kuat, seperti asid sulfurik.
Kemudian produk pencernaan dipanaskan dalam bekas keluli dengan arang batu dan arang batu, sehingga memperoleh fosforus putih dengan penyulingan dalam retort. Tulang adalah sumber utama yang memperoleh fosforus hingga 1840, ketika mereka digantikan untuk tujuan ini oleh guano.
Di guano
Guano adalah campuran burung burung dan penguraian produk mereka. Ia digunakan sebagai sumber fosforus dan baja pada abad ke -19.
- Pembangunan Perindustrian
Batu fosfat digunakan pada tahun 1850 sebagai sumber fosforus. Ini, bersama -sama dengan ciptaan ketuhar elektrik untuk mengikat batu oleh James Burges Readman (1888), membuat batu fosfatik bahan mentah utama pengeluaran fosforus dan baja.
Pada tahun 1819, kilang -kilang Cerrillas ditubuhkan, memulakan pembangunan perindustrian fosforus.
Sifat fizikal dan kimia
Penampilan
Bergantung pada bentuk allotropik, ia boleh berwarna putih, tertutup putih, kuning, merah, merah, ungu atau hitam.
Berat atom
30,973 u
Nombor atom (z)
lima belas
Takat lebur
Fosforus putih: 44.15 ºC
Fosforus Merah: ~ 590 ºC
Takat didih
Fosforus putih: 280.5 ºC
Ketumpatan (suhu ambien)
Putih: 1,823 g/cm3
Merah: 2.2-2,34 g/cm3
Violet: 2.36 g/cm3
Hitam: 2.69 g/cm3
Haba Fusion
Fosforus putih: 0.66 kJ/mol
Haba pengewapan
Fosforus putih: 51.9 kJ/mol
Kapasiti kalori molar
Fosforus putih: 23,824 j/(mol.K)
Keadaan pengoksidaan
-3, -2, -1, +1, +2, +3, +4 dan +5
Bergantung pada elektronegativiti unsur -unsur yang mana fosforus dapat menunjukkan keadaan pengoksidaan +3 atau -3. Fosforus, tidak seperti nitrogen, cenderung bertindak balas dengan lebih baik dengan keadaan pengoksidaan +5; Ini adalah kes fosforus pentoksida (p2Sama ada5 atau p25+Sama ada52+).
Boleh melayani anda: Bahan larutElektronegativiti
2,19 pada skala Pauling
Tenaga pengionan
-Pertama: 1.101 kJ/mol
-Kedua: 2.190.7 kJ/mol
-Ketiga: 2.914 kJ/mol
Kekonduksian terma
Fosforus putih: 0.236 w/(m · k)
Fosforus hitam: 12.1 w/(m · k)
Ia menunjukkan bagaimana fosforus hitam menjalankan hampir enam kali lebih panas daripada fosforus putih.
Urutan magnet
Perlawanan putih, merah, ungu dan hitam adalah diamagnetik.
Isotop
Fosforus mempunyai 20 isotop, menjadi yang utama: 31P, satu -satunya isotop yang stabil dengan banyak 100%; 32P, pemancar β isotop- dan dengan separuh hayat 14.28 hari; dan 33P, isotop pemancar β- Dan dengan separuh hayat 25.3 hari.
PHOSPHORESCENCE
Fosforus putih adalah fosforus dan memancarkan cahaya hijau dalam kegelapan.
Perubahan allotropik
Fosforus putih tidak stabil dan perubahan kepada suhu hampir 250 ºC ke bentuk polimer yang dikenali sebagai fosforus merah, yang boleh mengubah oren hingga oren ungu. Ia adalah bahan amorf, tetapi ia boleh menjadi kristal; Tidak bersinar dalam kegelapan atau terbakar di udara.
Fosforus putih pada suhu tinggi dan tekanan, atau dengan kehadiran pemangkin, diubah menjadi bentuk polimer selain fosforus merah: fosforus hitam. Ini adalah bahan kristal hitam, tidak aktif, serupa dengan grafit, dan itu mempunyai keupayaan untuk menjalankan elektrik.
Kelarutan
Fosforus putih tulen tidak larut dalam air, walaupun ia dapat diselesaikan dalam karbon sulfida. Sementara itu, perlawanan merah dan hitam tidak larut di dalam air dan kurang tidak menentu daripada fosforus putih.
Reaktiviti
Fosforus terbakar secara spontan di udara untuk membentuk p2Sama ada5, Dan ini seterusnya boleh bertindak balas dengan tiga molekul air untuk membentuk asid ortofosforik atau fosforik (H3PO4).
Dengan tindakan air panas berasal fosfin (pH3) dan oxacid fosforus.
Asid fosforik bertindak pada batuan fosfat yang menyebabkan dihydrogen atau superfosfat kalsium fosfat [CA2PO4)2].
Anda boleh bertindak balas dengan halogen untuk membentuk halida px3, mewakili x ke f, cl, br atau i; o haluros dengan formula px5, Menjadi X, CL atau BR.
Juga, fosforus bertindak balas dengan logam dan metalloid untuk menyebabkan fosfida, dan sulfur membentuk beberapa sulfida. Sebaliknya, ia mengikat oksigen untuk berasal dari ester. Dengan cara yang sama, ia digabungkan dengan karbon untuk membentuk sebatian organik fosforus.
Struktur dan konfigurasi elektronik
- Pautan dan unit tetrahedral
Atom fosforus mempunyai konfigurasi elektronik berikut:
[Ne] 3s2 3p3
Oleh itu, lima elektron dari Valencia, seperti nitrogen dan elemen lain kumpulan 15. Kerana ia adalah elemen bukan logam, atomnya perlu membentuk ikatan kovalen sehingga octeto de valencia melengkapkan. Nitrogen mencapainya apabila ditubuhkan sebagai molekul datomik n2, Dengan pautan triple, n≡N.
Begitu juga untuk fosforus: dua atom P dikaitkan dengan ikatan triple untuk membentuk molekul p2, P≡P; Ini, alotrope diphosphorus. Walau bagaimanapun, fosforus mempunyai jisim atom yang lebih besar daripada nitrogen, dan orbital 3pnya, lebih meresap daripada 2p nitrogen, bertindih dengan kecekapan yang kurang; Oleh itu, p2 Ia hanya wujud dalam keadaan gas.
Sebaliknya, pada suhu bilik, atom p lebih suka mengatur kovalen dengan cara lain: dalam molekul tetrahedral p4:
 Unit molekul P4 dalam kristal fosforus putih. Sumber: Benjah-bmm27 melalui Wikipedia.
Unit molekul P4 dalam kristal fosforus putih. Sumber: Benjah-bmm27 melalui Wikipedia. Perhatikan bahawa dalam imej unggul semua atom p mempunyai tiga pautan mudah dan bukannya pautan tiga. Oleh itu, fosforus dalam p4 Lengkapkan Octeto de Valencia. Walau bagaimanapun, dalam p4 Terdapat ketegangan dalam pautan P-P, kerana sudut mereka akan menjadi mata kasar menjadi 109.5 °.
- Alotropes
Fosforus putih
Imej yang sama dari unit p4 Dan ketidakstabilannya menjelaskan mengapa fosforus putih adalah alotropik yang paling tidak stabil dari elemen ini.
Unit p4 Mereka diperintahkan di ruang angkasa untuk menentukan kristal BCC (fasa α) di bawah keadaan normal. Apabila suhu turun ke -77.95 ºC, kaca BCC diubah menjadi HCP (mungkin), lebih padat (fasa β). Iaitu unit p4 Mereka diperintahkan dalam dua lapisan alternatif, A dan B, untuk menubuhkan urutan ABAB ..
Fosforus merah
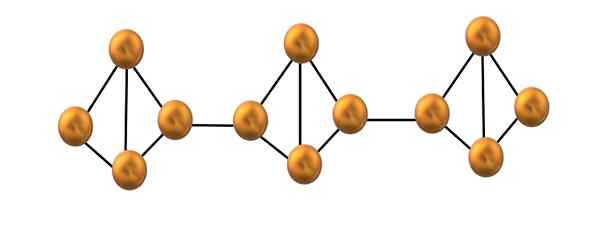 Struktur rantai fosforus merah. Sumber: Gabriel Bolívar.
Struktur rantai fosforus merah. Sumber: Gabriel Bolívar. Di bahagian atas, hanya segmen kecil struktur fosforus merah ditunjukkan. Menjadi tiga unit yang sejajar dengan "simetri", boleh dikatakan bahawa ia adalah struktur kristal, yang diperolehi dengan memanaskan fosforus ini di atas 250 ºC.
Fosforus merah, bagaimanapun, kebanyakan masa ia terdiri daripada amorf yang kukuh, jadi strukturnya tidak kemas. Jadi, rantai polimer p4 Mereka akan mempunyai corak yang jelas, satu di atas dan yang lain di bawah pesawat yang sama sewenang -wenangnya.
Perhatikan bahawa ini adalah perbezaan struktur utama antara fosforus putih dan merah: pada yang pertama4 Mereka adalah individu, dan dalam rantai pembentukan kedua. Ini mungkin kerana salah satu pautan P-P dipecahkan di dalam tetrahedron untuk dapat menghubungkan ke tetrahedron jiran. Oleh itu, ketegangan anulus dan fosforus merah dikurangkan lebih banyak kestabilan.
Boleh melayani anda: zink: sejarah, sifat, struktur, risiko, kegunaanApabila terdapat campuran kedua -dua alotrop, ia ditawarkan sebagai fosforus kuning; Campuran rantai fosforus tetrahedra dan amorf. Malah, fosfor putih.
Fosforus Violet atau Hittorf
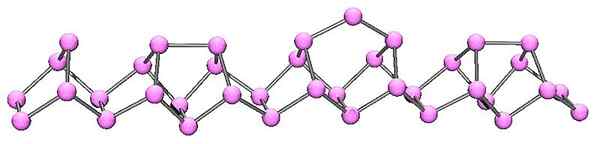 Struktur molekul fosforus violet. Sumber: Cadmium di Bahasa Inggeris Wikipedia [Domain Awam]
Struktur molekul fosforus violet. Sumber: Cadmium di Bahasa Inggeris Wikipedia [Domain Awam] Fosforus Violet adalah evolusi akhir fosforus merah. Seperti yang dapat dilihat dalam imej yang unggul, ia terus terdiri daripada rantai polimer; Tetapi sekarang strukturnya lebih rumit. Nampaknya unit struktur tidak lagi p4 Tetapi p2, diatur sedemikian rupa sehingga mereka membentuk cincin pentagonal yang tidak teratur.
Walaupun bagaimana asimetrik struktur kelihatan, rantai polimer ini berjaya memerintahkan dengan cukup baik dan berkala sehingga fosfor violet.
Fosforus hitam
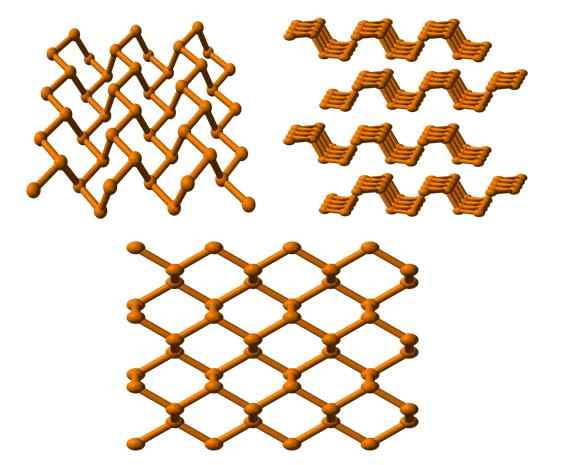 Struktur fosforus hitam dilihat dari beberapa sudut. Sumber: Benjah-bmm27 [domain awam].
Struktur fosforus hitam dilihat dari beberapa sudut. Sumber: Benjah-bmm27 [domain awam]. Dan akhirnya kita mempunyai alotrope fosforus yang paling stabil: warna hitam. Menyediakan fosforus putih di bawah tekanan 12.000 atm.
Dalam imej atas (di bawah), dapat dilihat bahawa strukturnya, dari satah yang lebih tinggi, mempunyai persamaan tertentu dengan grafit; Ia adalah rangkaian cincin heksagon yang curam (walaupun mereka kelihatan persegi).
Di sudut kiri atas gambar, anda dapat lebih menghargai yang baru dikemukakan. Persekitaran molekul atom p adalah piramid trigonal. Perhatikan bahawa struktur melihat secara lisan (sudut kanan atas), diatur dalam lapisan yang sesuai dengan yang lain.
Struktur fosforus hitam agak simetri dan teratur, yang bersetuju dengan keupayaannya untuk menubuhkan dirinya sebagai kristal ortorrombik. Penumpukan lapisan polimernya menyebabkan atom P tidak tersedia untuk banyak tindak balas kimia; Dan itulah sebabnya ia agak stabil dan sedikit reaktif.
Walaupun tidak perlu menyebutnya, daya penyebaran London dan massa molar pepejal fosforik ini adalah mereka yang mengawal beberapa sifat fizikalnya; sementara struktur dan ikatan mereka p-p menentukan sifat kimia dan lain-lain.
Di mana dan dapatkan
Apatita dan fosforit
Ia adalah dua belas elemen kerak bumi dan mewakili 0.1% dari beratnya. Terdapat kira -kira 550 mineral yang mengandungi fosforus, Apatita menjadi mineral yang paling penting untuk mendapatkan fosforus.
Apatita adalah mineral fosforus dan kalsium yang boleh mengandungi jumlah fluorida, klorida dan hidroksida yang berubah -ubah, yang formulanya adalah seperti berikut: [CA10(PO4)6(F, cl atau oh)2)]. Sebagai tambahan kepada apatite terdapat mineral fosforus lain yang penting dalam komersil; Demikianlah kes wavelita dan vivianita.
Batu fosfat atau fosforit adalah sumber fosfora utama. Ia adalah batu sedimen bukan detritik yang mempunyai kandungan fosforus 15-20%. Fosforus biasanya hadir sebagai CA10(PO4)6F2 (Fluoroapatita). Ia juga hadir sebagai hydroxyapatite, walaupun pada tahap yang lebih rendah.
Di samping itu, fluoroapatite dapat dijumpai sebahagian daripada batu -batu igneus dan metamorf, serta limestones dan syal.
Pengurangan elektrotermal fluoroapatita
Batu fosfat terpilih dipindahkan ke loji rawatan untuk diproses. Pada mulanya, mereka dihancurkan untuk mendapatkan serpihan batu yang kemudiannya di dalam kilang bola pada 70 revolusi seminit.
Kemudian, produk pengisaran serpihan batu diasingkan untuk dapat pecahan mereka. Fraksi tersebut dipilih dengan kandungan fosforus 34% seperti fosforus pentoksida (p2Sama ada5).
Fosforus putih (p4) Ia diperolehi secara industri oleh pengurangan fluoroapatite elektrotermal dengan karbon pada suhu 1.500 ºC dengan kehadiran silikon oksida:
2ca3(PO4)2(s) + 6sio2(s) + 10 c (s) => p4(g) + casio3(L) + co (g)
P4 Dalam keadaan gas, selepas pemeluwapan, ia dikumpulkan dan disimpan sebagai pepejal putih yang tenggelam di dalam air untuk mengelakkan reaksi dengan udara luaran.
Aloi
Coppery
Perlindungan fosforus dihasilkan dengan peratusan yang berbeza dari tembaga dan fosforus: Cu 94 % - p 6 %; CU 92% - P 8%; CU 85% - P 15%, dll. Aloi ini digunakan sebagai ejen deoksidan, pelembab untuk industri tembaga dan juga sebagai nuklear dalam industri aluminium.
Broncine
Mereka adalah tembaga, fosforus dan aloi timah yang mengandungi 0.5 - 11% fosforus dan 0.01 - 0.35% TIN. Tin meningkatkan ketahanan kakisan, sementara fosfor.
Ia digunakan dalam penjelasan mata air, bolt dan, secara umum, dalam artikel yang memerlukan keletihan, haus dan kakisan kimia. Penggunaannya dalam kipas kapal disyorkan.
Boleh melayani anda: kadmium (CD): sejarah, sifat, struktur, kegunaanNictelladas
Aloi yang paling terkenal ialah nipdua puluh, Menggunakan nikel fosforasi dalam aloi kimpalan yang kuat, untuk meningkatkan ketahanannya terhadap hakisan kimia, pengoksidaan dan suhu tinggi.
Aloi digunakan dalam komponen enjin gas dan reaksi, galvanoplasti, dan dalam pengeluaran elektrod kimpalan.
Risiko
Fosforus putih menghasilkan luka kulit yang serius dan merupakan racun yang kuat yang boleh fana dengan dos 50 mg. Fosforus menghalang pengoksidaan sel, mengganggu pengurusan oksigen selular, yang boleh menyebabkan degenerasi lemak dan kematian sel.
Keracunan fosforus akut menghasilkan dalam empat hari pertama kesakitan perut pengambilan, semangat, nafas dengan bau bawang putih, muntah fosforesen, berpeluh, kekejangan otot, dan juga keadaan kejutan.
Selanjutnya, jaundis, petechiae, pendarahan, pengaruh miokardium dengan aritmia, perubahan sistem saraf pusat dan kematian pada hari kesepuluh pengambilan ditunjukkan.
Manifestasi keracunan fosforus kronik yang paling jelas adalah kerosakan pada struktur tulang rahang.
Peningkatan kepekatan fosforus plasma (hyperphospathia), biasanya dibentangkan pada pesakit yang mengalami kegagalan buah pinggang. Ini menyebabkan deposit fosfat yang tidak normal dalam tisu lembut, yang boleh menyebabkan disfungsi vaskular dan penyakit kardiovaskular.
Aplikasi
Fosforus adalah elemen penting untuk tumbuh -tumbuhan dan haiwan. Ia adalah salah satu daripada tiga nutrien utama tumbuhan, yang diperlukan untuk keperluan pertumbuhan dan tenaga mereka. Di samping itu, ia adalah sebahagian daripada asid nukleik, fosfolipid, produk perantaraan proses metabolik, dll.
Dalam vertebrata fosforus terdapat dalam tulang dan gigi dalam bentuk hidroksilapatit.
- Fosforus Elementary
 Kotak perlawanan atau "fosforus". Sumber: Pxhere.
Kotak perlawanan atau "fosforus". Sumber: Pxhere. Dengan fosforus enamel kimia dihasilkan yang digunakan untuk menerangi notis yang diletakkan pada aluminium dan aloinya; serta gangsa tembaga dan fosforasi.
Ia juga digunakan untuk membuat bom pembakar, bom tangan, pam asap dan peluru pengesan. Fosforus merah digunakan dalam penjelasan perlawanan atau perlawanan keselamatan.
Fosforus putih digunakan untuk penjelasan organofosfat. Di samping itu, ia digunakan dalam pengeluaran asid fosforik.
Sejumlah besar fosforus yang dihasilkan dibakar untuk pengeluaran fosforus tetraxide (p4Sama ada10), diperoleh sebagai serbuk atau pepejal.
- Sebatian
Fosfin
Ia adalah bahan mentah untuk penjelasan beberapa sebatian fosforus. Ia bertindak sebagai ejen doping untuk komponen elektronik.
Asid fosforik
Ia digunakan dalam penjelasan minuman ringan kerana rasa ciri yang memberi mereka. Bertindak pada batu fosfat untuk membentuk kalsium fosfat dihydrogenik2PO4)2], juga dikenali sebagai superfosfat, yang digunakan sebagai baja.
Asid fosforik adalah perapi elemen enamel pergigian untuk memudahkan lekatan bahan pemulihannya. Ia juga digunakan, dicampur dengan minyak, urea, rehat, bitumen dan pasir, untuk membentuk asfalt; Bahan yang digunakan dalam pembaikan saluran komunikasi tanah.
Organophosphorus
Sebatian Organophosphorus mempunyai banyak aplikasi; seperti: retardan api, racun perosak, ejen pengekstrakan, ejen tindakan saraf dan rawatan air.
Dihidrat dihydrate kalsium fosfat
Ia digunakan sebagai baja, serbuk penaik, bahan tambahan makanan haiwan dan dalam penjelasan pasta pergigian.
Phosphorus pentoxide
Ia digunakan dalam analisis kimia sebagai ejen dehidrasi dan sintesis organik sebagai ejen kondensor. Kompaun ini terutamanya diperuntukkan untuk pengeluaran asid orthophosphoric.
Natrium tripolyphosphate
Ia digunakan dalam detergen dan sebagai pelembut air, yang meningkatkan tindakan detergen dan membantu mengelakkan kakisan paip.
Fosfat trisodik
Ia digunakan sebagai ejen pembersih dan pelembut air.
Natrium fosfat
Natrium fosfat dibasic (NA2HPO4) dan natrium fosfat monobasic (nah2PO4) adalah komponen sistem penyerap kejutan pH, yang juga bertindak dalam makhluk hidup; Antara mereka manusia.
Rujukan
- Reid Danielle. (2019). Allotropes of Phosphorus: Borang, Kegunaan & Contoh. Kajian. Pulih dari: belajar.com
- Prof. Robert J. Lancashire. (2014). Kuliah 5c. Struktur unsur, teruskan p, s dan i. Pulih dari: chem.Uwimona.Edu.JM
- Byju's. (2019). Fosforus merah. Pulih dari: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang, et al. (2019). Sifat Struktur dan Optik Elektronik Fosforus Biru Multilayer: Kajian Prinsip Pertama. Jurnal Nanomaterials, Vol. 2019, ID Artikel 4020762, 8 halaman. doi.org/10.1155/2019/4020762
- Dr. Dough Stewar. (2019). Fakta unsur fosforus. Chemicool. Pulih dari: chemicool.com
- Wikipedia. (2019). Fosforus. Diperoleh dari: dalam.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (3 Julai 2019). Fakta fosforus (nombor atom 15 atau simbol elemen p). Pulih dari: Thoughtco.com
- Institut Linus Pauling. (2019). Fosforus. Pulih dari: lpi.Oregonstate.Edu
- Bernardo Fajardo ms. & Héctor lozano v. (s.F.). Pemprosesan batu fosforik kebangsaan untuk pengeluaran superfosfat. [Pdf]. Pulih dari: bdigital.i.Edu.co
- Editor enyclopaedia Britannica. (16 November 2018). Unsur kimia fosforus. Encyclopædia Britannica. Pulih dari: Britannica.com
- Reade International Corp. (2018). Aloi fosforus tembaga (cawan). Pulih dari: Reade.com
- KBM Affilips. (27 Disember 2018). Aloi induk nikel (NIP). Azom. Pulih dari: azom.com
- Lentech b.V. (2019). Jadual Tempoh: Fosforus. Pulih dari: lentech.com
- Abhijit Naik. (21 Februari 2018). Penggunaan fosforus. Pulih dari: Sciencestruck.com
- « Penjelasan tekanan manometrik, formula, persamaan, contoh
- Trincheras Kebudayaan Asal, Ciri, Agama, Budaya »

