Unit kuasa ionik, bagaimana mengira, contohnya

- 1333
- 333
- Mr. Tracy Parisian
The kekuatan ionik Ini adalah cara untuk menyatakan kepekatan ion dalam penyelesaian. Konsep ini diperkenalkan pada tahun 1922 oleh Lewis dan Randall semasa mengusahakan penerangan pekali aktiviti kimia.
Apabila kepekatan ion dalam larutan adalah tinggi, interaksi elektrostatik antara ion bertentangan dihasilkan; Ia.
 Daya ionik air laut tinggi, sekitar 0.7, kerana kepekatan garam terlarut yang besar
Daya ionik air laut tinggi, sekitar 0.7, kerana kepekatan garam terlarut yang besar Atas sebab ini, konsep aktiviti kimia diperkenalkan sebagai kepekatan ionik yang berkesan penyelesaian, aktiviti kimia menjadi hasil molariti penyelesaian oleh pekali aktiviti kimia.
Koefisien ini mempunyai nilai yang dekat dengan unit (1) untuk penyelesaian ionik yang dicairkan dan untuk penyelesaian ideal yang dipanggil. Ini adalah penyelesaian di mana interaksi intermolecular antara molekul yang serupa adalah sama dengan yang ada antara molekul yang berbeza.
Penciptaan konsep daya ionik menyumbang kepada penjelasan penyimpangan dari tingkah laku yang ideal, diperhatikan dalam penyelesaian ionik sebenar.
[TOC]
Unit kuasa ionik
Daya ionik mempunyai unit mol/l (molariti) atau tahi lalat/kg air (moleality). Yang terakhir disyorkan dalam penyelesaian bukan ideal, yang dicirikan kerana jumlah campuran mereka tidak sepenuhnya aditif.
Ini bermakna, sebagai contoh, yang berikut: jika bercampur 0.5 liter cecair a dan 0.5 liter cecair b, jumlah campuran campuran ini, tidak semestinya sama dengan 1 liter, tetapi boleh berbeza.
Daya ionik diwakili oleh simbol i.
Boleh melayani anda: butanal: struktur, sifat, kegunaan dan risikoCara mengira daya ionik?
Untuk pengiraan daya ionik penyelesaian, kepekatan semua ion yang ada dalam penyelesaiannya diambil kira, serta nilai masing -masing.
Nilai daya ionik diperoleh dengan menggunakan formula berikut:
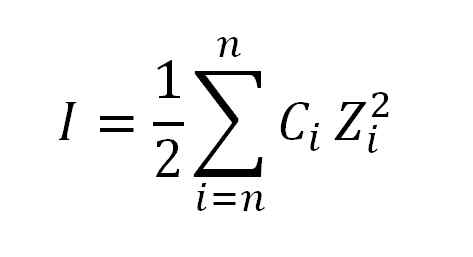 Formula yang digunakan untuk mengira daya ionik. Sumber: Gabriel Bolívar.
Formula yang digunakan untuk mengira daya ionik. Sumber: Gabriel Bolívar. Di mana saya, seperti yang telah dikatakan, adalah kuasa ionik; C, sepadan dengan kepekatan ion moral atau moral; Manakala z, mewakili nilai masing -masing (± 1, ± 2, ± 3, dan lain -lain.).
Ungkapan yang muncul dalam formula dalam pengiraan daya ionik (σ) dibaca sebagai ringkasan, iaitu jumlah produk kepekatan molar (c) setiap ion yang ada dalam larutan oleh valencia (z) tinggi kuasa dua.
Seperti yang dapat dilihat, valensi ion mempunyai berat terbesar dalam nilai daya ionik penyelesaiannya. Contohnya: Valencia (z) CA adalah +2, jadi z2 Ia adalah sama 4. Sementara itu, Valencia (z) Na Es +1, dan oleh itu, z2 Ia adalah sama 1.
Ini menunjukkan bahawa sumbangan ion ca2+ Kepada nilai daya ionik, kepada kepekatan ionik molar yang sama, ia adalah empat kali lebih besar daripada na ion+.
Kepentingan daya ionik
Daya ionik adalah ukuran yang mencukupi kepekatan ionik penyelesaian dan merupakan asas untuk mewujudkan teori Debye-Hückel. Teori ini menerangkan tingkah laku ideal penyelesaian ionik.
Daya ionik berfungsi sebagai asas untuk mengira pekali aktiviti (γYo), parameter yang seterusnya membolehkan pengiraan aktiviti kimia sebatian ionik, aktiviti kimia menjadi kepekatan yang berkesan dan nyata dari sebatian ionik dalam larutan.
Boleh melayani anda: Aluminium acetate (AL (CH3COO) 3): Struktur, sifat, kegunaanDengan meningkatkan daya ionik penyelesaian, interaksi antara ion meningkat. Oleh itu, penurunan γYo dan aktiviti kimia ion.
Peningkatan daya ionik dapat mengurangkan kelarutan protein dalam persekitaran berair, harta ini digunakan untuk pemendakan protein secara selektif. Penyelesaian sulfat daya ionik tinggi digunakan untuk pemendakan dan pemurnian protein plasma.
Contoh kuasa ionik
Contoh 1
Kirakan daya ionik penyelesaian kalium klorida (KCl) 0.3 m.
KCL memisahkan dengan cara berikut:
KCl → K+ + Cl-
Kami mempunyai dua ion: kation+ (Z =+1) dan anion cl- (Z = -1). Kami kemudian menggunakan formula untuk mengira daya ionik i:
I = 1/2 [c · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 11 + 0.3 m · 11]
= 0.3 m
Perhatikan bahawa Valencia -1 dari CL- Ia diambil sebagai 1, nilai mutlaknya, kerana sebaliknya daya ionik akan sama dengan 0.
Contoh 2
Kirakan daya ionik penyelesaian kalsium sulfat (kes4) 0.5m
Kes itu4 Ia memisahkan seperti berikut:
Kes4 → ca2+ + SW42-
Kami mempunyai dua ion: CA Cation2+ (Z =+2) dan anion SO42- (Z = -2). Kami kemudian menggunakan formula untuk mengira daya ionik i:
I = 1/2 [c · (+2)2 + C · (-2)2]
= 1/2 [0.5 m · 4 +0.5 m · 4]
= 2 m
Contoh 3
Kirakan daya ionik penyerap kejutan dengan kepekatan akhir natrium fosfat dibasic (NA2HPO4) 0.3 m dan natrium fosfat monobasic (nah2PO4) 0.4 m.
Na2HPO4 Ia memisahkan seperti berikut:
Boleh melayani anda: asid arsenik (H3SO4): sifat, risiko dan kegunaanNa2HPO4 → ke -2+ + HPO42-
Sementara nah2PO4 Ia memisahkan mengikut corak berikut:
Nah2PO4 → NA+ + H2PO4-
Kami meneruskan sebagai latihan sebelumnya, kali ini mempunyai anion HPO42- (Z = -2) dan h2PO4- (Z = -1):
I = 1/2 [c · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Perhatikan bahawa kepekatan NA+ dari na2HPO4 Ia didarabkan dengan 2, kerana kepekatannya dua kali ganda. Walau bagaimanapun, untuk garam yang lain, nah2PO4, Kepekatan na+ Ya, kami membiaknya dengan 1, menurut stoikiometri persamaan pembubarannya.
Contoh 4
Kirakan daya ionik penyelesaian natrium klorida (NaCl) 0.15 m dan glukosa (c6H12Sama ada6) 0.3 m.
NaCl memisahkan seperti berikut:
NaCl → Na+ + Cl-
Glukosa, bagaimanapun, tidak dipisahkan pada ion kerana ia hanya mempunyai ikatan jenis kovalen dalam struktur kimianya. Oleh itu, Valencia de la glucosa (z) sama dengan sifar (0). Kami kemudian mengira produk kuasa ionik NaCl:
I = 1/2 [c · (+1)1 + C · (-1)1]
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Wikipedia. (2020). Kekuatan ion. Diperoleh dari: dalam.Wikipedia.Atau
- Dr. David k. Ryan. (s.F.). Kelas Kekuatan & Kekuatan Ionik 4 Ryan. [Pdf]. Diperolehi dari: Faculy.uml.Edu
- Universiti Michigan. (s.F.). Pandangan yang lebih terperinci mengenai keseimbangan kimia. [Pdf]. Pulih dari: umich.Edu
- Elsevier b.V. (2020). Kekuatan ion. Scientedirect. Diperoleh dari: Scientedirect.com
- C.D. Kennedy. (1990). Stik ionik dan dinsosiasi asid. [Pdf]. Pulih dari: iubmb.Perpustakaan dalam talian.Wiley.com

