Pasukan van der Waals
- 4657
- 1422
- Miss Elmer Hagenes
Kami menerangkan apa yang Van der Waals adalah kekuatan, ciri -ciri, jenis dan memberi contoh dalam setiap
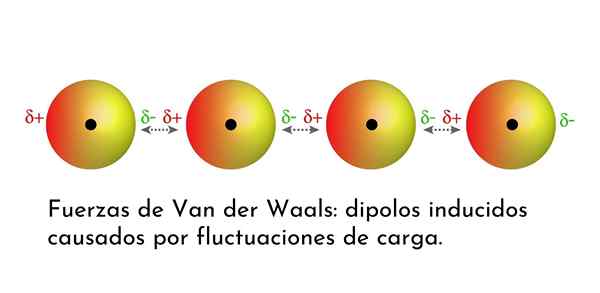
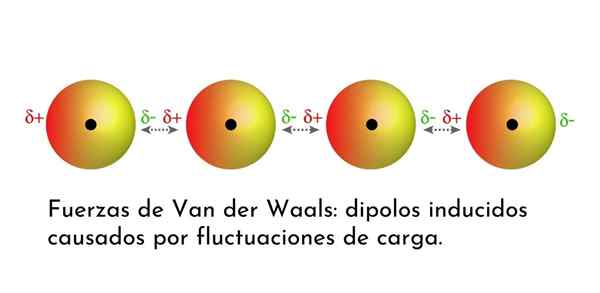 Ilustrasi yang menunjukkan salah satu jenis kekuatan Van der Waals, daya penyebaran London, di antara beberapa atom dengan dipole segera
Ilustrasi yang menunjukkan salah satu jenis kekuatan Van der Waals, daya penyebaran London, di antara beberapa atom dengan dipole segera Apa kuasa Van der Waals?
The Pasukan van der Waals Mereka adalah satu set daya tarikan pendek antara semua atom dan molekul. Mereka menerima nama mereka sebagai penghormatan kepada saintis Belanda Johannes Diderik van der Waals.
Kekuatan ini agak lemah, tetapi muncul di seluruh permukaan sentuhan antara dua atom, antara dua molekul atau antara dua permukaan, jadi, jika permukaan sentuhan itu besar, daya van der Waals dapat menjadi besar.
Pemahaman kekuatan van der Waals membolehkan secara kualitatif meramalkan banyak sifat fizikal bahan kimia, seperti titik lebur dan mendidih dan kelarutan dalam pelbagai jenis pelarut. Ini adalah daya yang membolehkan untuk menerangkan bagaimana mungkin gas monoatomik seperti helium, yang tidak membentuk apa -apa jenis ikatan kimia, boleh memeluk dan bergerak ke keadaan cecair.
Daya -daya ini juga menjelaskan mengapa bahan seperti air, yang dibentuk oleh molekul yang jisim molar hanya 18 g/mol, adalah cecair, manakala klorin, yang beratnya hampir 4 kali lebih banyak, adalah gas pada suhu bilik.
Ciri -ciri pasukan Van der Waals
Di samping mewakili jenis daya tarikan antara atom dan molekul, daya van der Waals tidak berkongsi banyak ciri dengan ikatan kimia. Seterusnya, ciri -ciri yang paling cemerlang dalam jenis kuasa ini dibentangkan:
- Mereka adalah kekuatan yang bergantung pada jarak. Dalam kes yang paling mudah, mereka berkurangan dengan kuadrat jarak. Di samping itu, mereka sangat bergantung pada geometri molekul.
- Berbanding dengan daya tarikan yang berlaku dalam pautan ionik, kovalen dan logam, daya van der Waals agak lemah.
- Kecuali interaksi dipole-dipolo, mereka adalah interaksi suhu bebas.
- Mereka adalah kekuatan pendek, yang bermaksud bahawa mereka merosot dengan cepat apabila atom dan molekul bergerak jauh.
- Mereka adalah kuasa umum yang berlaku di antara mana -mana atom dan mana -mana molekul.
- Tidak seperti ikatan kovalen, mereka tidak mempunyai arah. Ini bermakna, tanpa mengira orientasi yang mana dua molekul pendekatan, jika mereka cukup mendekati, kekuatan Van der Waals akan selalu muncul.
- Apabila dua molekul atau atom mendekati terlalu banyak, daya menjadi menjijikkan, yang menghalang molekul daripada runtuh antara satu sama lain.
- Mereka adalah bahan tambahan, yang bermaksud bahawa, walaupun agak lemah, kewujudan banyak interaksi serentak dapat menyebabkan daya tarikan penuh menjadi besar.
Jenis Van Der Waals Pasukan
Sebagai tambahan kepada komponen yang menjijikkan yang memastikan atom dan molekul tidak runtuh, terdapat tiga jenis daya van der Waals, yang mungkin atau mungkin tidak bertindak pada masa yang sama antara dua molekul atau atom. Ini dibentangkan di bawah:
1. Interaksi Dipolo-Dipolo atau Kekuatan Keesom
Kekuatan Keesom adalah salah satu pembayar cukai kepada kekuatan Van der Waals. Ini adalah daya interaksi elektrostatik yang muncul di antara dipole kekal molekul kutub seperti air, aseton dan lain -lain.
Kekuatan Keesom adalah serupa dengan daya elektrostatik antara ion, tetapi berbeza dari ini kerana mereka lebih lemah dan merosot dengan kuasa keenam jarak (iaitu, dengan r r6). Sebab mengapa mereka lebih lemah adalah bahawa tarikan berlaku di antara beban separa dipole, bukannya caj elektrik keseluruhan seperti dalam kes ion.
Interaksi ini hanya diberikan antara molekul dan bukan antara atom, kerana atom tidak mempunyai momen dipol tetap. Di samping itu, daya Keesom berkadar songsang dengan suhu, yang bermaksud bahawa, apabila ia meningkat, daya Keesom berkurangan.
Contoh molekul yang mempunyai interaksi dipole-dipolo
Semua molekul kutub mempunyai interaksi dipole-dipole di antara mereka. Sebagai contoh:
- Dua molekul aseton.
- Dua molekul kloroform.
- Molekul sikloheksanon dengan molekul aseton.
2. Interaksi Dipolo-dipolo yang disebabkan atau pasukan Debye
Apabila molekul kutub mendekati atom atau molekul apolar, dipole yang pertama menarik atau mengulangi elektron di permukaan kedua. Ini mendorong dipole dalam molekul apolar, yang dipanggil dipole disebabkan. Dipole baru terbentuk, kemudian berinteraksi dengan dipole asal yang membuat daya tarikan kecil.
Boleh melayani anda: haba pembakaranInteraksi ini antara dipole yang kekal dan terinduksi biasanya dikenali sebagai daya Debye, dan bergantung bukan sahaja pada jarak antara kedua -dua molekul atau antara molekul polar dan atom individu, tetapi juga bergantung kepada polarizabiliti molekul apolar dan magnitud momen dipole molekul kutub.
Contoh molekul yang disebabkan oleh interaksi dipole-dipole
Interaksi semacam ini hanya diberikan antara molekul yang berbeza, kerana seseorang diperlukan untuk menjadi kutub dan yang lain tidak. Beberapa contoh adalah:
- Atom gas mulia seperti argon dan sebatian kutub seperti hidrogen klorida. Dalam kes ini, beban separa positif dalam hidrogen HCl menarik elektron valencia argon, menghasilkan dipol kecil yang disebabkan oleh yang terakhir. Jika argon mendekati atom klorin, beban separa negatif akan menangkis elektron valensi dan dipole yang diinduksi juga terbentuk.
- Brominat molekul (BR2) Ia larut dalam air, walaupun menjadi sebatian apolar dan air pelarut kutub yang kuat. Penjelasan adalah, sebahagiannya, kepada polarizabiliti yang tinggi dari bromin yang membolehkan anda membentuk interaksi yang sangat kuat.
3. Dipolo-dipolo-dipolo yang disebabkan oleh interaksi atau daya penyebaran London
Dari semua pasukan Van der Waals, yang paling lemah adalah kekuatan penyebaran London. Interaksi ini diberikan antara semua atom dan molekul kerana kemunculan dipole segera di mana -mana bahagian struktur mereka.
Dipole segera adalah dipole kecil yang dibentuk oleh pengagihan asimetrik elektron valensi pada masa tertentu.
Boleh melayani anda: hidrokarbon tak tepuBagaimana dipole segera dihasilkan?
Apabila elektron berputar di sekitar nukleus, ia boleh berlaku bahawa pada satu masa terdapat lebih banyak elektron di satu sisi daripada yang lain, yang menimbulkan dipole. Dipole kecil ini hilang dengan cepat kerana elektron terus bergerak di sekitar nukleus, dan itulah sebabnya mereka dipanggil gambar.
Dipole segera boleh timbul di mana sahaja dalam struktur molekul dan pada bila -bila masa mungkin terdapat banyak daripada mereka. Kekuatan penyebaran London terdiri daripada interaksi antara masa -masa segera ini dalam satu molekul dan yang lain.
Contoh sebatian yang mempunyai daya penyebaran London
Seperti yang disebutkan, jenis interaksi ini berlaku di antara semua atom dan molekul. Walau bagaimanapun, ia berada dalam molekul apolar yang besar di mana kesannya dapat diperhatikan dengan lebih baik, kerana dalam kes ini ia adalah satu -satunya jenis interaksi intermolecular yang berlaku.
Contoh tipikal di mana daya ini sangat sengit adalah dalam hal hidrokarbon alifatik rantaian panjang, terutama dalam polimer seperti polietilena.

