Gas sifat, tingkah laku, bentuk, contoh

- 4463
- 1302
- Dallas Bernhard
The Gas Mereka semua adalah bahan atau sebatian yang menyatakan keadaan pengagregatannya lemah dan tersebar, sementara sangat bergantung pada keadaan tekanan dan suhu yang memerintah mereka. Mungkin merupakan bentuk kedua perkara yang lebih banyak di seluruh alam semesta selepas plasma.
Di bumi gas membentuk lapisan atmosfera, dari exosphere, ke troposfera dan udara yang kita nafas. Walaupun gas tidak dapat dilihat apabila ia disebarkan oleh ruang besar, seperti langit, ia dikesan oleh pergerakan awan, giliran bilah kilang, atau oleh wap mulut mulut kita di iklim sejuk.
 Gas dapat diperhatikan di cerobong perindustrian atau rumah, serta di menara asap yang dipancarkan oleh gunung berapi. Sumber: Pxhere.
Gas dapat diperhatikan di cerobong perindustrian atau rumah, serta di menara asap yang dipancarkan oleh gunung berapi. Sumber: Pxhere. Begitu juga, pergi ke aspek negatif alam sekitar, diperhatikan dalam asap hitam paip ekzos kenderaan, di tiang asap menara yang terletak di kilang -kilang, atau di asap yang dibangkitkan ketika hutan terbakar.
Ia juga menghadapi fenomena gas ketika wap dilihat bahawa meninggalkan pembetung, di kebakaran rawa dan tanah perkuburan yang ditakdirkan, dalam oksigen bubb yang dikeluarkan oleh produk tumbuhan fotosintesis mereka, dan bahkan di erut dan kembung.
Di mana sahaja gas diperhatikan, ini bermakna terdapat tindak balas kimia, kecuali jika ia tetap atau diasimilasikan secara langsung dari udara, sumber utama gas (dangkal). Apabila suhu meningkat, setiap bahan (elemen kimia) akan berubah menjadi gas, termasuk logam seperti besi, emas dan perak.
Terlepas dari sifat kimia gas, semua orang berkongsi secara umum jarak yang jauh yang memisahkan zarah mereka (atom, molekul, ion, dll.), yang bergerak huru -hara dan sewenang -wenangnya dengan jumlah atau ruang tertentu.
[TOC]
Sifat gas
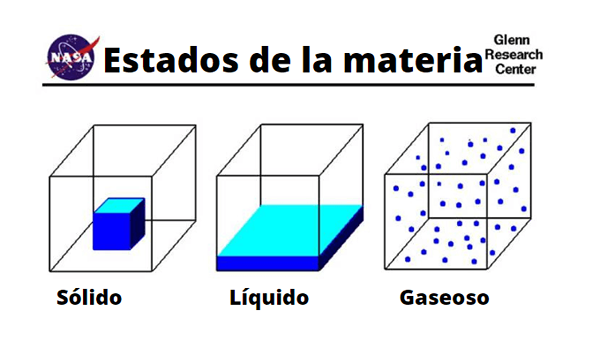 Perbezaan molekul pepejal, cecair dan gas
Perbezaan molekul pepejal, cecair dan gas Fizikal
Sifat fizikal gas berbeza -beza bergantung pada bahan atau sebatian yang. Popularly Gas dikaitkan dengan bau buruk atau reput, kerana kandungan sulfur mereka, atau kehadiran amina yang tidak menentu. Begitu juga, mereka divisualisasikan oleh pewarnaan hijau, coklat atau kekuningan, yang menakut -nakutkan dan memberikan pertanda yang buruk.
Walau bagaimanapun, kebanyakan gas, atau sekurang -kurangnya yang paling banyak, sebenarnya tidak berwarna dan tidak berbau. Walaupun mereka tidak diselesaikan, mereka dapat dirasai pada kulit dan menentang rintangan pergerakan, bahkan mencipta lapisan likat di dalam badan yang menyeberanginya (seperti dengan pesawat).
Semua gas mungkin mengalami tekanan atau perubahan suhu yang akhirnya membuat cecair masing -masing; iaitu, mereka mengalami pemeluwapan (jika mereka disejukkan) atau pencairan (jika mereka "ditekan").
 Pemeluwapan; keadaan gas ke keadaan cair
Pemeluwapan; keadaan gas ke keadaan cair Sebaliknya, gas mampu membubarkan cecair dan beberapa pepejal berliang (seperti karbon diaktifkan). Gelembung adalah hasil daripada kelompok gas yang belum dibubarkan di tengah dan melarikan diri ke permukaan cecair.
Kekonduksian elektrik dan terma
Di bawah keadaan normal (tanpa pengionan zarah mereka), gas adalah pemacu haba dan elektrik yang buruk. Walau bagaimanapun, apabila mereka tegang dengan banyak elektron, mereka membenarkan laluan arus melalui mereka, seperti yang dilihat dalam sinar semasa ribut.
Sebaliknya, pada tekanan rendah dan tertakluk kepada medan elektrik, beberapa gas, terutama yang mulia atau sempurna, menerangi dan lampu mereka digunakan untuk reka bentuk kehidupan malam dan poster (cahaya neon), serta dalam kejutan elektrik yang terkenal lampu di tanglung jalanan.
Boleh melayani anda: keseimbangan granataria: ciri, bahagian dan cara menggunakannyaMengenai kekonduksian terma, banyak gas berkelakuan sebagai penebat haba, sehingga penggabungan mereka ke dalam pengisian serat, tisu, atau panel kaca, membantu mencegah haba dari membancuh mereka dan menjaga suhu tetap.
Walau bagaimanapun, terdapat gas yang merupakan konduktor haba yang baik, dan boleh menyebabkan luka bakar yang lebih teruk yang disebabkan oleh cecair atau pepejal; Contohnya, seperti stim panas kek panggang (atau empanadas), atau dengan jet stim yang melarikan diri dari dandang.
Reaktiviti
Umumnya tindak balas yang melibatkan gas, atau di mana ia berlaku, digambarkan sebagai berbahaya dan rumit.
Kereaktifannya bergantung, sekali lagi, terhadap sifat kimia mereka; Walau bagaimanapun, apabila berkembang dan menggerakkannya, lebih banyak penjagaan dan kawalan mesti diambil kerana mereka boleh mencetuskan peningkatan tekanan drastik yang meletakkan struktur reaktor berisiko; Belum lagi bagaimana mudah terbakar atau tidak gembira gas.
Tingkah laku gas
Secara makroskopik seseorang dapat memberi idea tentang tingkah laku gas dengan menyaksikan bagaimana asap, cincin, atau "bahasa" sastera rokok berevolusi di udara. Juga, apabila bom tangan asap meletup, menarik untuk memperincikan pergerakan awan warna -warna yang berbeza ini.

Walau bagaimanapun, pemerhatian sedemikian tertakluk kepada tindakan udara, dan juga pada hakikat bahawa terdapat zarah pepejal yang sangat halus yang digantung dalam asap. Oleh itu, contoh -contoh ini tidak mencukupi untuk mencapai kesimpulan mengenai tingkah laku sebenar gas. Sebaliknya, eksperimen telah dijalankan dan mengembangkan teori kinetik gas.
Molekul dan idealnya, zarah gas bertabrakan secara elastik antara satu sama lain, mempunyai perpindahan linear, putaran dan getaran. Mereka mempunyai tenaga yang berkaitan dengan purata, yang membolehkannya bergerak secara bebas melalui mana -mana ruang tanpa hampir berinteraksi atau bertembung dengan zarah lain kerana jumlahnya meningkat di sekelilingnya.
Tingkah lakunya akan menjadi campuran gerakan Brownian yang tidak menentu, dan perlanggaran bola biliard yang melantun secara tidak sengaja antara satu sama lain dan dinding meja; Sekiranya tidak ada dinding, mereka akan tersebar ke arah tak terhingga, kecuali jika mereka mengekalkannya: graviti.
Bentuk Gase
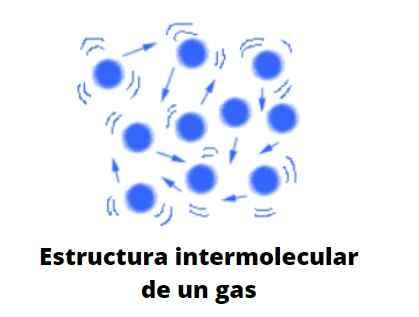
Gas, tidak seperti cecair dan pepejal, tidak tertakluk kepada jenis pekat; iaitu, pengagregatan atau perpaduan zarah mereka tidak pernah berjaya menentukan bentuk. Mereka berkongsi dengan cecair hakikat bahawa mereka sepenuhnya menduduki jumlah bekas yang mengandungi mereka; Walau bagaimanapun, mereka kekurangan permukaan dan ketegangan permukaan.
Sekiranya kepekatan gas tinggi, bentuk "bahasa" atau makroskopik anda sudah dijelaskan dapat divisualisasikan dengan mata kasar. Ini, lambat laun, akan berakhir pudar kerana tindakan angin atau dengan pengembangan gas semata -mata. Oleh itu, gas meliputi semua sudut ruang terhad yang menyebabkan sistem yang sangat homogen.
Sekarang, teori itu dengan mudah menganggap gas sebagai sfera yang hampir tidak bertembung dengan diri mereka sendiri; Tetapi apabila mereka melakukannya, mereka melantun secara elastik.
Sfera ini sangat dipisahkan antara satu sama lain, jadi gas praktikal "penuh" vakum; Dari sana anda berhutang fleksibiliti anda untuk menyeberangi celah atau fissure yang sedikit, dan kemudahan dapat memampatkannya dengan ketara.
Boleh melayani anda: oksida bukan logamItulah sebabnya, bagaimanapun, menutup pemasangan kedai roti, jika berjalan di sebelahnya pasti aroma roti yang baru dibakar akan dinikmati.
Tekanan gas
Boleh dipercayai bahawa dengan begitu bertaburan dan memisahkan sfera gas atau zarah, ini tidak dapat menghasilkan tekanan ke atas badan atau objek. Walau bagaimanapun, atmosfera menunjukkan bahawa kepercayaan itu palsu: ia mempunyai jisim, berat dan menghalang cecair daripada menguap atau mendidih dari apa -apa. Titik mendidih diukur pada tekanan atmosfera.
Tekanan gas menjadi lebih boleh diukur jika manometer tersedia, atau jika mereka terkunci dari bekas dinding yang tidak dapat ditentukan. Oleh itu, lebih banyak zarah gas ada di dalam bekas, semakin besar bilangan perlanggaran di antara mereka dan dinding yang sama.
Zarah -zarah ini apabila berlanggar dengan dinding menekan mereka, kerana mereka menggunakan permukaan mereka berkadar berkadar dengan tenaga kinetik mereka. Seolah -olah bola biliard yang ideal ke dinding telah terharu; Sekiranya terdapat banyak yang memberi kesan kepada mereka pada kelajuan tinggi, ia dapat memecahkan.
Unit
Terdapat banyak unit yang mengiringi pengukuran tekanan gas. Beberapa yang paling terkenal ialah milimeter Mercury (mmHg), serta Torr. Adalah sistem unit antarabangsa (SI) yang menentukan Pascal (PA) dari segi N/M2; Dan dia, Kilo (KPA), Mega (MPA) dan Giga (GPA) Pascal.
Jumlah gas
Gas menduduki dan mengembang sepanjang jumlah bekas. Semakin besar bekas, jumlah gas juga akan; Tetapi kedua -dua tekanan dan ketumpatan mereka akan berkurangan untuk jumlah zarah yang sama.
Gas itu sendiri, sebaliknya, mempunyai jumlah yang berkaitan yang tidak bergantung sepenuhnya pada sifat molekul atau strukturnya (idealnya), tetapi pada keadaan tekanan dan suhu yang memerintahnya; Ini, jumlah molarnya.
Pada hakikatnya, jumlah molar berbeza dari satu gas ke gas yang lain, walaupun variasi kecil jika mereka tidak mempunyai molekul heterogen dan besar. Sebagai contoh, jumlah molar ammonia (NH3, 22,079 l/mol) pada 0 ºC dan 1 atm, ia berbeza dari helium (dia, 22,435 l/mol).
Semua gas mempunyai jumlah molar yang berubah bergantung pada p dan t, dan tanpa mengira seberapa besar zarah mereka, bilangannya selalu sama. Dari sini dia memperoleh apa yang diketahui oleh nombor Avogadro (nKe).
Undang -undang utama gas
Tingkah laku gas telah belajar sejak abad lalu melalui eksperimen, pemerhatian yang mendalam dan tafsiran hasilnya.
Eksperimen sedemikian membenarkan satu siri undang -undang yang, dikumpulkan dalam persamaan yang sama (gas ideal), membantu meramalkan tindak balas gas kepada tekanan dan keadaan suhu yang berbeza. Dengan cara ini, terdapat hubungan antara jumlah, suhu dan tekanannya, serta bilangan tahi lalat mereka dalam sistem tertentu.
Antara undang-undang ini adalah empat berikut: Boyle, Charles, Gay-Lussac dan Avogadro.
Undang -undang Boyle
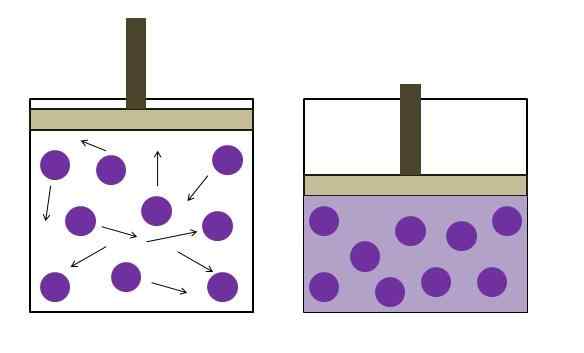 Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar
Peningkatan tekanan pengurangan tekanan. Sumber: Gabriel Bolívar Undang -undang Boyle menetapkan bahawa pada suhu malar, jumlah gas ideal berkadar songsang dengan tekanannya; Ini, semakin besar bekas, semakin rendah tekanan yang akan dialami oleh dindingnya dengan jumlah gas yang sama.
Ia boleh melayani anda: Charles Law: Formula dan Unit, Eksperimen, LatihanCharles Law
 Lentera Cina atau keinginan. Sumber: Pxhere.
Lentera Cina atau keinginan. Sumber: Pxhere. Undang -undang Charles menetapkan bahawa pada tekanan berterusan, jumlah gas ideal berkadar secara langsung dengan suhunya. Belon menunjukkan Charles '.
Undang-undang Gay-Lussac
Undang-undang Gay-Lussac menetapkan bahawa pada jumlah yang berterusan, tekanan gas ideal adalah berkadar terus dengan suhunya. Dalam kawah yang ditutup dengan baik jika gas semakin panas, setiap kali tekanan di dalamnya akan lebih besar, kerana dinding kawah tidak berubah atau melebarkan; Iaitu, jumlahnya tidak berubah, ia tetap.
Undang -undang Avogadro
Akhir. Oleh itu, jika anda mempunyai mol zarah (6.02 · 1023), maka jumlah gas molar akan.
Jenis gas
Gas mudah terbakar
Ini adalah gas yang komponennya berfungsi sebagai bahan api, kerana ia digunakan untuk pengeluaran tenaga terma. Sebahagian daripada mereka adalah gas asli, minyak cecair dan gas hidrogen.
Gas perindustrian
Ini adalah gas yang dihasilkan, yang dipasarkan kepada orang ramai untuk kegunaan dan aplikasi yang berbeza, seperti untuk sektor kesihatan, makanan, perlindungan alam sekitar, metalurgi, industri kimia, keselamatan, antara lain. Sebahagian daripada gas ini adalah oksigen, nitrogen, helium, klorin, hidrogen, karbon monoksida, propana, metana, nitrous oksida, antara lain.
Gas inert
Mereka adalah gas yang di bawah keadaan suhu dan tekanan tertentu, tidak menghasilkan tindak balas kimia atau sangat rendah. Mereka adalah Neon, Argon, Helium, Kripton dan Xenon. Ia digunakan dalam proses kimia di mana unsur -unsur tidak aktif diperlukan.
Contoh elemen dan sebatian gas
Apakah unsur -unsur gas dari jadual berkala di bawah keadaan terestrial?
Kami mula -mula mempunyai hidrogen (h), yang membentuk molekul h2. Ia diikuti oleh helium (dia), gas mulia yang lebih ringan; dan kemudian nitrogen (n), oksigen (O) dan fluorida (F). Ketiga terakhir ini juga membentuk molekul diatomik: n2, Sama ada2 dan f2.
Selepas fluorida datang neon (ne), gas mulia yang mengikuti helium. Di bawah fluorin kita mempunyai klorin (CL), dalam bentuk molekul CL2.
Kemudian kita mempunyai seluruh gas mulia: Argon (AR), Kripton (KR), Xenón (XE), Radon (RN) dan Oganeson (OG).
Oleh itu, mereka adalah dua belas elemen gas; Sebelas jika kita mengecualikan Oganeson yang sangat radioaktif dan tidak stabil.
Sebatian gas
Sebagai tambahan kepada unsur -unsur gas, beberapa sebatian gas biasa akan disenaraikan:
-H2S, hidrogen sulfida, bertanggungjawab terhadap bau telur busuk
-NH3, ammonia, aroma menembusi yang dilihat dalam sabun yang digunakan
-Co2, Karbon dioksida, gas rumah hijau
-Tidak2, nitrogen dioksida
-Tidak, nitrogen monoksida, gas yang dipercayai sangat toksik tetapi memainkan peranan penting dalam sistem peredaran darah
-SW3, Sulfur trioksida
-C4H10, butana
-HCL, hidrogen klorida
-Sama ada3, ozon
-Sf6, Hexafluoruro Sulfur
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Sifat gas. Diperolehi daripada: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Gas. Diperoleh dari: dalam.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (5 Disember 2018). Gas - Sifat umum gas. Pulih dari: Thoughtco.com
- Jam tangan kesihatan lelaki harvard. (2019). Keadaan gas. Pulih dari: kesihatan.Harvard.Edu
- Editor penyejuk elektronik. (1 September 1998). Kekonduksian terma gas. Pulih dari: penyejukan elektronik.com

