Konsep, jenis dan contoh geometri molekul
- 1755
- 427
- Erick Krajcik
The Geometri molekul Sama ada Struktur molekul Ia adalah pengagihan ruang atom di sekitar atom tengah. Atom mewakili kawasan di mana terdapat ketumpatan elektronik yang tinggi, dan oleh itu dianggap sebagai kumpulan elektronik, tanpa mengira pautan yang membentuk (mudah, berganda atau tiga).
Geometri molekul unsur boleh mencirikan beberapa sifat fizikal atau kimianya (titik mendidih, kelikatan, ketumpatan, dll.). Sebagai contoh, struktur molekul air menentukan keterlarutannya.
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Konsep ini dilahirkan dari gabungan dan data eksperimen dua teori: iaitu Link Valencia (TEV) dan penolakan pasangan elektronik lapisan Valencia (RPECV). Walaupun yang pertama mentakrifkan pautan dan sudut mereka, yang kedua menetapkan geometri dan, akibatnya, struktur molekul.
Apa bentuk geometri yang dapat mengguna pakai molekul? Dua teori terdahulu menyumbang jawapannya. Menurut RPECV, atom dan pasang elektron bebas mesti diatur di angkasa sedemikian rupa sehingga penolakan elektrostatik di antara mereka berkurangan hingga maksimum.
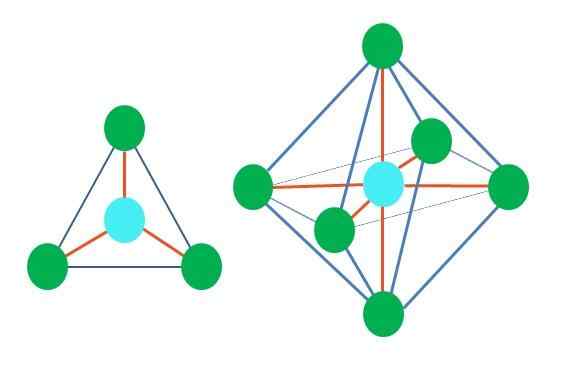
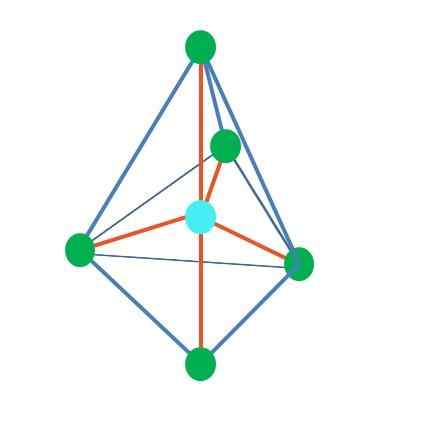
Oleh itu, bentuk geometri tidak sewenang -wenangnya, tetapi cari reka bentuk yang paling stabil. Sebagai contoh, di bahagian atas imej segitiga dapat dilihat di sebelah kiri, dan di sebelah kanan octahedron. Titik hijau mewakili atom dan jalur oren pautan.
Di segitiga, tiga titik hijau berorientasikan dalam pemisahan 120º. Sudut ini, yang sama dengan pautan, membolehkan atom untuk menangkis satu sama lain. Oleh itu, molekul dengan atom pusat yang dilampirkan kepada tiga orang lain akan menggunakan geometri trigonal rata.
Walau bagaimanapun, RPECV meramalkan bahawa sepasang elektron bebas di atom pusat akan memutarbelitkan geometri. Dalam kes satah trigonal, tork ini akan menolak tiga titik hijau, mengakibatkan geometri piramid trigonal.
Perkara yang sama juga boleh berlaku dengan octahedron gambar. Di dalamnya semua atom dipisahkan dengan cara yang paling stabil.
[TOC]
Cara mengetahui terlebih dahulu geometri molekul atom x?
Untuk ini, juga perlu mempertimbangkan elektron bebas sebagai kumpulan elektronik. Ini, bersama -sama dengan atom, akan menentukan apa yang dikenali sebagai Geometri elektronik, yang merupakan teman geometri molekul yang tidak dapat dipisahkan.
Dari geometri elektronik, dan setelah mengesan pasangan elektron bebas oleh struktur Lewis, dapat ditubuhkan apa geometri molekul. Jumlah semua geometri molekul akan memberikan lakaran struktur global.
Jenis geometri molekul
Seperti yang dapat dilihat dalam imej utama, geometri molekul bergantung pada berapa banyak atom mengelilingi atom tengah. Walau bagaimanapun, jika beberapa elektron hadir tanpa berkongsi, ia akan mengubahsuai geometri kerana ia menduduki banyak kelantangan. Oleh itu, ia memberi kesan sterik.
Menurut ini, geometri dapat membentangkan satu siri bentuk ciri untuk banyak molekul. Dan ini adalah di mana pelbagai jenis geometri molekul atau struktur molekul timbul.
Bilakah geometri sama dengan struktur? Kedua -duanya menunjukkan sama hanya dalam kes di mana struktur tidak mempunyai lebih daripada satu jenis geometri; Jika tidak, semua jenis yang hadir mesti dipertimbangkan dan memberikan struktur nama global (linear, bercabang, globular, rata, dll.).
Boleh melayani anda: HydraceGeometri amat berguna untuk menjelaskan struktur pepejal dari unit strukturnya.
Linear
Semua ikatan kovalen adalah arah, jadi pautan A-b linear. Tetapi adakah molekul ab akan linear2? Jika ya, geometri hanya diwakili sebagai: b-a-b. Dua atom B dipisahkan oleh sudut 180º, dan menurut TEV, A mesti mempunyai orbital hibrid sp.
Sudut
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Geometri linear untuk molekul ab boleh diandaikan pada mulanya2; Walau bagaimanapun, adalah penting untuk menarik struktur Lewis sebelum mencapai kesimpulan. Menarik struktur Lewis, anda dapat mengenal pasti bilangan pasangan elektron yang tidak biasa (:) pada atom a.
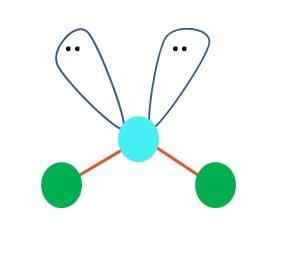
Apabila ini begitu, pada pasangan elektron dua atom B ke bawah, menukar sudut mereka. Akibatnya, molekul linear B-A-B akhirnya menjadi V, bumerang atau geometri sudut (imej unggul)
Molekul air, H-O-H, adalah contoh yang ideal untuk jenis geometri ini. Di dalam atom oksigen terdapat dua pasang elektron tanpa berkongsi yang berorientasikan pada sudut kira -kira 109º.
Kenapa sudut ini? Kerana geometri elektronik adalah tetrahedral, yang mempunyai empat titik: dua untuk atom H, dan dua untuk elektron. Dalam imej yang unggul, perhatikan bahawa titik hijau dan dua "lobus dengan mata" melukis tetrahedron dengan titik kebiruan di pusatnya.
Jika atau tidak mempunyai elektron bebas, air akan membentuk molekul linear, polaritasnya akan berkurangan dan lautan, laut, tasik, dll., Mereka mungkin tidak akan wujud kerana mereka saling mengenali.
Tetrahedral
 Sumber: Gabriel Bolívar
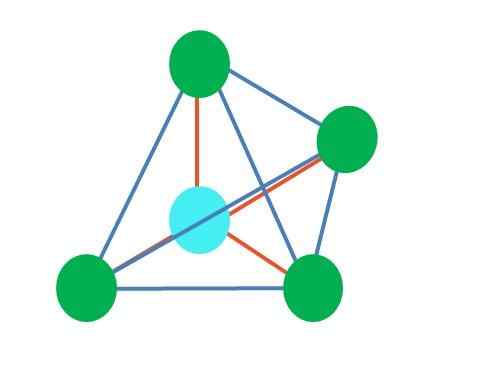
Sumber: Gabriel Bolívar Imej atas mewakili geometri tetrahedral. Untuk molekul air, geometrik elektroniknya adalah tetrahedral, tetapi dengan menghapuskan pasangan bebas elektron dapat diperhatikan bahawa ia berubah menjadi geometri sudut. Ini juga hanya diperhatikan dengan menghapuskan dua titik hijau; Baki dua akan menarik v dengan titik biru.
Bagaimana jika bukannya dua pasang elektron bebas hanya ada satu? Maka akan ada satah trigonal (imej utama). Walau bagaimanapun, dengan menghapuskan kumpulan elektronik, kesan sterik yang dihasilkan oleh sepasang elektron bebas tidak dielakkan. Oleh itu, ia mengganggu satah trigonal ke piramid asas segi tiga:
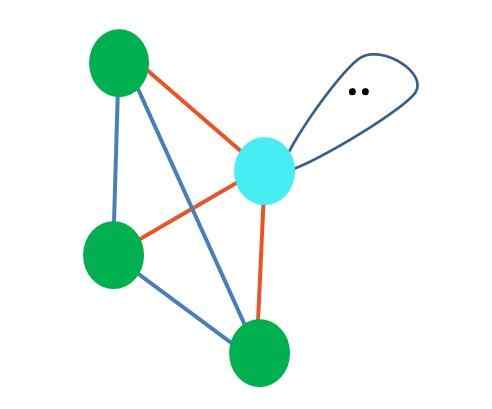 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Walaupun geometri molekul trigonal dan piramid tetrahedral berbeza, geometri elektronik adalah sama: tetrahedral. Jadi piramid trigonal tidak dikira sebagai geometri elektronik?
Jawapannya tidak, kerana ia adalah produk penyimpangan yang disebabkan oleh "lobus dengan mata" dan kesan steriknya, dan berkata geometri tidak mengambil kira distorsi kemudian.
Atas sebab ini, selalu penting untuk menentukan geometri elektronik pertama dengan bantuan struktur Lewis sebelum menentukan geometri molekul. Molekul Ammonia, NH3, Ia adalah contoh piramid trigonal geometri molekul, tetapi dengan geometri elektronik tetrahedral.
Trigonal bipiramid
 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Sehingga kini, kecuali geometri linear, dalam piramid tetrahedral, sudut dan trigonal atom pusat mereka mempunyai SP hibridisasi SP3, Menurut Tev. Ini bermakna jika sudut pautannya ditentukan secara eksperimen, mereka harus sekitar 109º.
Ia boleh melayani anda: Kimia Gunaan: Objek Kajian, Cawangan, Kepentingan, ContohDari geometri dipharmidal trigonal, terdapat lima kumpulan elektronik di sekitar atom tengah. Dalam imej atas, anda dapat melihat dengan lima titik hijau; tiga di pangkalan segi tiga, dan dua dalam kedudukan paksi, yang merupakan bahagian atas dan bawah piramid.
Apa hibridisasi kemudian mempunyai titik biru? Ia memerlukan lima orbital hibrid untuk membentuk bon mudah (oren). Ini mencapai melalui lima orbitals sp sp3d (produk campuran orbital s, tiga p dan satu d).
Apabila mempertimbangkan lima kumpulan elektronik, geometri sudah terdedah, tetapi mempunyai pasangan elektron tanpa berkongsi, ia sekali lagi mengalami gangguan yang menjana geometri lain. Begitu juga, soalan berikut timbul: Pasangan ini boleh menduduki mana -mana kedudukan piramid? Ini adalah: paksi atau khatulistiwa.
Kedudukan paksi dan khatulistiwa
Titik hijau yang membentuk pangkalan segi tiga berada dalam kedudukan khatulistiwa, manakala kedua -dua di bahagian atas dan bawah, dalam kedudukan paksi. Di mana lebih suka pasangan elektron akan ditempatkan tanpa berkongsi? Dalam kedudukan yang berkurangan kepada penolakan elektrostatik maksimum dan kesan sterik.
Dalam kedudukan paksi sepasang elektron akan membuat "tekanan" berserenjang (90º) secara segi tiga, manakala jika ia berada di kedudukan khatulistiwa, kumpulan elektronik yang tersisa dari pangkalan akan dipisahkan 120º dan tekan kedua -dua hujung pada 90º (bukannya tiga, seperti pangkalan).
Oleh itu, atom pusat akan berusaha untuk membimbing rakan -rakan bebas elektron dalam kedudukan khatulistiwa untuk menghasilkan geometri molekul yang lebih stabil.
Berayun dan bentuk t
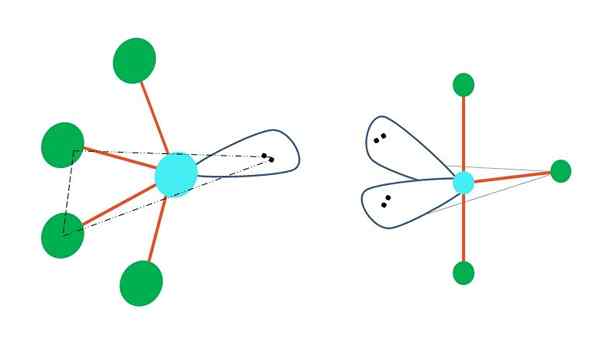 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Jika satu atau lebih atomnya bebas daripada elektron digantikan dalam geometri bipirramid trigonal, geometri molekul yang berbeza juga akan mempunyai.
Di sebelah kiri imej atas, geometri berubah menjadi bentuk berayun. Di dalamnya, tork bebas elektron mendorong seluruh empat atom ke arah yang sama, membongkok pautan mereka ke kiri. Perhatikan bahawa tork ini dan dua atom terletak pada satah segi tiga yang sama dari bipiramide asal.
Dan di sebelah kanan imej, geometri dalam bentuk t. Geometri molekul ini adalah hasil menggantikan dua atom dengan dua pasang elektron, mengakibatkan tiga atom selebihnya menyelaraskan dalam satah yang sama yang menarik tepat huruf t.
Jadi, untuk molekul jenis AB5, Ini mengguna pakai geometri bipyramid trigonal. Walau bagaimanapun, Ab4, Dengan geometri elektronik yang sama, ia akan mengguna pakai geometri berayun; dan AB3, Geometri t -shaped. Dalam semua mereka akan mempunyai (umumnya) hibridisasi SP3d.
Untuk menentukan geometri molekul, perlu menarik struktur Lewis dan oleh itu geometri elektroniknya. Sekiranya ini adalah bipiramid trigonal, pasangan bebas elektron akan dibuang, tetapi bukan kesan sterik mereka pada seluruh atom. Oleh itu, ia dapat dilihat dengan sempurna antara tiga geometri molekul yang mungkin.
Octahedral
Di sebelah kanan imej utama, geometri molekul octahedral diwakili. Geometri jenis ini sepadan dengan sebatian ab6. Ab4 Mereka membentuk pangkalan persegi, sementara baki dua b kedudukannya sendiri dalam kedudukan paksi. Oleh itu, beberapa segitiga sama rata dibentuk, yang merupakan wajah octahedron.
Boleh melayani anda: tenaga pengaktifanDi sini, sekali lagi, mungkin ada (seperti dalam semua geometri elektronik) pasangan elektron bebas, dan oleh itu berasal dari fakta ini geometri molekul lain. Contohnya, AB5 Dengan geometri elektronik octronistik ia terdiri daripada piramid dengan pangkalan persegi, dan ab4 satah persegi:
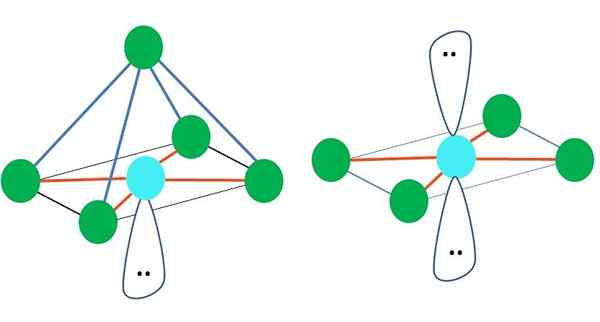 Sumber: Gabriel Bolívar
Sumber: Gabriel Bolívar Dalam kes geometri elektronik octronistik, kedua -dua geometri molekul ini adalah yang paling stabil dari segi penolakan elektrostatik. Di geometri rata persegi dua pasang elektron dipisahkan 180º.
Apakah hibridisasi atom dalam geometri ini (atau struktur, jika ia satu -satunya)? Sekali lagi, Tev menetapkan bahawa ia adalah SP3d2, Enam orbital hibrid, yang membolehkan anda membimbing kumpulan elektronik di simpang octahedron.
Geometri molekul lain
Mengubah asas piramid yang disebutkan setakat ini, beberapa geometri molekul yang lebih kompleks dapat diperoleh. Contohnya, bipiramid pentagonal didasarkan pada pentagon dan sebatian yang bentuk mempunyai formula ab umum7.
Seperti geometri molekul yang lain, menggantikan atom B dengan pasangan bebas elektron akan mengganggu geometri ke bentuk lain.
Juga, sebatian ab8 Mereka boleh mengamalkan geometri seperti antiprisme persegi. Beberapa geometri boleh menjadi sangat rumit, terutamanya untuk formula ab7 Bermula dari sekarang12).
Contoh geometri molekul
Satu siri sebatian akan disebutkan di bawah untuk setiap geometri molekul utama. Sebagai latihan, struktur Lewis boleh ditarik untuk semua contoh dan mengesahkan jika, diberi geometri elektronik, geometri molekul diperolehi kerana ia disenaraikan di bawah.
Geometri linear
-Etilena, h2C≡CH2
-Beryllium Chloride, Becl2 (Cl-be-cl)
-Karbon Dioksida, CO2 (O = c = o)
-Nitrogen, n2 (N≡N)
-Dibromure Mercury, HGBR2 (BR-HG-BR)
-Triyoduro anion, i3- (I-i-i)
-Asid MadeHydric, HCN (H-N≡C)
Sudutnya mestilah 180º, dan oleh itu mempunyai hibridisasi SP.
Geometri sudut
-Air
-Sulfur dioksida, jadi2
-Nitrogen dioksida, tidak2
-Ozon, atau3
-Anion Amiduro, NH2-
Trigonal flat
-Bromine trifluoride, bf3
-Aluminium Trichloride, ALCL3
-Anion nitrat, tidak3-
-Karbonat Anion, CO32-
Tetrahedral
-Gas Metano, CH4
-Karbon Tetrachloride, CCL4
-Kation ammonium, NH4+
-Anion sulfat, jadi42-
Piramid Trigonal
-Ammonia, NH3
-Hydronio kation, h3Sama ada+
Trigonal bipiramid
-Fosforus pentafluoruro, pf5
-Antimoni Pentachloride, SBF5
Berayun
Sulfur tetrafluoride, sf4
Bentuk t
-Trichloride iodine, ICL3
-Trifluoride klorin, CLF3 (Kedua -dua sebatian dikenali sebagai interhalogens)
Octahedral
-Hexafluoruro sulfur, sf6
-Selenium hexafluoruro, sef6
-Hexaflorophosphate, pf6-
Untuk memuncak, geometri molekul adalah yang menerangkan pemerhatian sifat kimia atau fizikal perkara itu. Walau bagaimanapun, ia berorientasikan mengikut geometri elektronik, supaya yang terakhir mesti selalu ditentukan sebelum yang pertama.
Rujukan
- Whitten, Davis, Peck & Stanley. Kimia. (8th ed.). Pembelajaran Cengage, ms 194-198.
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat., p. 23, 24, 80, 169). MC Graw Hill.
- Mark e. Tuckerman. (2011). Geometri Molekul dan Teori VSEPR. Pulih dari: NYU.Edu
- Chembook Maya, Charles dan. Ophardt. (2003). Pengenalan kepada geometri molekul. Pulih dari: kimia.Elmhursst.Edu
- Kimia Librettexts. (8 September 2016). Geometri molekul. Pulih dari: chem.Libretxts.org

