Fungsi glikolisis, enzim, fasa, produk, kepentingan
- 1629
- 270
- Ms. Micheal Rippin
The Glikolisis o Glikolisis adalah laluan katabolisme glukosa utama, yang matlamat utamanya adalah untuk mendapatkan tenaga dalam bentuk ATP dan NADH mengurangkan kuasa, dari karbohidrat ini.
Laluan ini, yang benar -benar dijelaskan pada tahun 1930 -an oleh Gustav Embden dan Otto Meyerhof semasa mengkaji penggunaan glukosa dalam sel -sel otot rangka, terdiri daripada pengoksidaan lengkap monosakarida tersebut dan, dengan sendirinya, mewakili laluan anaerobik untuk mendapatkan tenaga.
 Struktur molekul ATP, salah satu produk glikolitik (ringkasan laluan glikolitik (Sumber: Tekks di Bahasa Inggeris Wikipedia/CC By-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) melalui Wikimedia Commons) melalui Wikimedia Commons)
Struktur molekul ATP, salah satu produk glikolitik (ringkasan laluan glikolitik (Sumber: Tekks di Bahasa Inggeris Wikipedia/CC By-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) melalui Wikimedia Commons) melalui Wikimedia Commons) Ia adalah salah satu laluan metabolik utama, kerana ia berlaku, dengan perbezaannya, dalam semua organisma hidup yang wujud, uniselular atau multiselular, prokariot atau eukariota, dan ia dianggap sebagai rantai tindak balas yang sangat diawetkan secara semula jadi.
Malah, terdapat beberapa organisma dan jenis sel yang bergantung secara eksklusif pada laluan ini untuk wujud.
Pada mulanya, glikolisis terdiri daripada pengoksidaan glukosa, 6 atom karbon, untuk piruvat, yang mempunyai tiga atom karbon; Dengan pengeluaran bersamaan ATP dan NADH, berguna untuk sel -sel dari sudut pandangan metabolik dan sintetik.
Dalam sel -sel yang mampu memproses selanjutnya produk yang diperolehi daripada katabolisme glukosa, glikolisis berakhir dengan pengeluaran karbon dioksida dan air melalui kitaran Krebs dan rantai penghantar elektron (glikolisis aerobik).
Sepuluh reaksi enzimatik berlaku semasa laluan glikolitik dan, walaupun peraturan tindak balas ini boleh menjadi sesuatu yang berbeza dari satu spesies ke yang lain, mekanisme peraturan juga cukup dipelihara.
[TOC]
Fungsi glikolisis
Dari sudut pandangan metabolik, glukosa adalah salah satu karbohidrat yang paling penting untuk semua makhluk hidup.
Ia adalah molekul yang stabil dan sangat larut, sehingga dapat diangkut dengan mudah di seluruh tubuh binatang atau tumbuhan, dari mana ia disimpan dan/atau diperolehi di mana ia diperlukan sebagai bahan bakar selular.
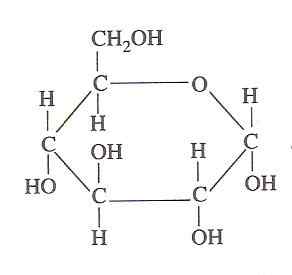 Struktur Glukosa (Sumber: Oliva93/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) melalui Wikimedia Commons)
Struktur Glukosa (Sumber: Oliva93/CC BY-S (https: // creativeCommons.Org/lesen/by-sa/3.0) melalui Wikimedia Commons) Tenaga kimia yang terkandung dalam glukosa dieksploitasi oleh sel -sel hidup melalui glikolisis, yang terdiri daripada satu siri langkah -langkah yang sangat terkawal yang mana tenaga yang dikeluarkan dari pengoksidaan karbohidrat ini dalam bentuk tenaga tenaga yang lebih banyak dapat "ditangkap", oleh itu kepentingannya.
Melalui laluan ini, bukan sahaja tenaga (ATP) dan pengurangan kuasa (NADH) diperolehi, tetapi ia menyediakan satu siri perantara metabolik yang merupakan sebahagian daripada laluan lain, juga penting dari anabolik (biosintetik) dan operasi selular umum. Berikut adalah senarai:
- Glukosa 6-fosfat untuk laluan fosfat pentosas (PPP, Bahasa Inggeris Pantos Mushco Pathway)
- Piruvat untuk penapaian laktik
- Piruvat untuk sintesis asid amino (alanine, terutamanya)
- Piruvat untuk kitaran asid tricarboxylic
- Fruktosa 6-fosfat, glukosa 6-fosfat dan dihydroxyacetone fosfat, yang berfungsi sebagai "blok pembinaan" pada laluan lain seperti sintesis glikogen, asid lemak, trigliserida, nukleotida, asid amino, dan lain-lain.
Pengeluaran tenaga
Jumlah ATP yang dihasilkan oleh laluan glikolitik.
Walau bagaimanapun, apabila ia datang kepada sel -sel aerobik, glikolisis juga bertindak sebagai sumber tenaga kecemasan dan berfungsi sebagai "langkah persediaan" sebelum tindak balas fosforilasi oksidatif yang mencirikan sel -sel dengan metabolisme aerobik.
Enzim yang mengambil bahagian dalam glikolisis
Glikolisis hanya mungkin terima kasih kepada penyertaan 10 enzim yang memangkinkan tindak balas yang mencirikan laluan ini. Banyak enzim ini adalah bentuk alosterik dan perubahan atau penyesuaian apabila mereka menjalankan fungsi pemangkin mereka.
Terdapat enzim yang memecahkan dan membentuk ikatan kovalen di kalangan substrat mereka dan ada orang lain yang memerlukan cofactor tertentu untuk menjalankan fungsi mereka, terutamanya ion logam.
Secara struktural, semua enzim glikolitik mempunyai pusat yang pada dasarnya dibentuk oleh lembaran β selari dikelilingi oleh Neraka α dan memerintahkan lebih dari satu domain. Selain itu, enzim ini dicirikan kerana tapak aktif mereka biasanya berada di tapak kesatuan antara domain.
Ia juga penting untuk menyerlahkan bahawa peraturan utama laluan berjalan melalui kawalan (hormon atau metabolit) enzim seperti heksoquinase, phosphofrucerachinase, glyceraldehyde 3-fosfat dehidrogenase dan pyruvate kinase.
Boleh melayani anda: parenchyma pulmonari: keterangan, histologi, penyakit Titik Peraturan Utama Laluan Glikolitik.Org/lesen/by-sa/3.0) melalui Wikimedia Commons)
Titik Peraturan Utama Laluan Glikolitik.Org/lesen/by-sa/3.0) melalui Wikimedia Commons) 1- Hexoquinase (HK)
Reaksi pertama glikolisis (fosforilasi glukosa) dipangkin oleh hexoquinase (HK), yang mekanisme tindakannya seolah -olah terdiri daripada "pelarasan yang diinduksi" oleh substrat, yang menggalakkan "penutupan" enzim di sekitar ATP dan glukosa ( substratnya) setelah mereka menyertai ini.
Bergantung pada organisma yang dipertimbangkan, mungkin ada satu atau lebih isoenzim, yang berat molekulnya berkisar antara 50 (kira -kira 500 asid amino) dan 100 kDa, kerana mereka seolah -olah dikelompokkan dalam bentuk sempadan, yang pembentukannya disukai oleh kehadiran ion glukosa, magnesium dan ATP.
Hexoquinase mempunyai struktur tersier yang terdiri daripada alpha dan helaian beta terbuka, walaupun terdapat banyak perbezaan struktur dalam enzim ini.
2- phosphoglucose isomerase (PGI)
Glukosa fosforilasi oleh hexoquinase adalah isomerized ke fruktosa 6-fosfat dengan cara isomerase phosphoglucose (PGI), juga dikenali sebagai isomerase 6-fosfat glukosa. Oleh itu, enzim tidak mengeluarkan atau menambah atom, melainkan menyusun semula mereka di peringkat struktur.
Ini adalah enzim aktif dalam bentuk dimorinya (monomer beratnya lebih kurang 66 kDa) dan terlibat bukan sahaja dalam glikolisis, tetapi juga dalam gluconeogenesis, dalam sintesis karbohidrat dalam tumbuhan, dll.
3- Phosphofrutequinase (PFK)
Fruktosa 6-fosfat adalah substrat untuk enzim phosphofrucerachinase, yang mampu fosforilasi sekali lagi molekul ini menggunakan ATP sebagai penderma kumpulan fosforil, menghasilkan fruktosa 1.6-biffosfat.
Enzim ini wujud dalam bakteria dan mamalia sebagai enzim homotramerik (terdiri daripada empat subunit identik 33 kDa setiap satu untuk bakteria dan 85 kDa masing -masing dalam mamalia) dan dalam ragi ia adalah octameter (terdiri daripada subunit yang lebih besar, antara 112 dan 118 kDa).
Ia adalah enzim alosterik, yang bermaksud bahawa ia secara positif atau negatif dikawal oleh mana -mana produknya (ADP) dan molekul lain seperti ATP dan sitrat.
4- Aldolase
Juga dikenali sebagai fruktosa 1.6-biffosphate aldolase, aldolase memangkinkan pecah pemangkin fruktosa 1.6-biphosphate dalam dihydroxyacetone fosfat dan gliseraldehida 3-fosfat dan tindak balas reaksi,.
Dalam erti kata lain, enzim ini memotong fruktosa 1.6-biphosphate hanya di tengah, melepaskan dua sebatian fosforilasi 3 atom karbon. Aldolase juga terdiri daripada 4 subunit yang sama, masing -masing dengan tapak aktifnya sendiri.
Kewujudan dua kelas (I dan II) enzim ini telah ditentukan, yang berbeza dengan mekanisme tindak balas yang memangkin dan kerana beberapa (yang pertama) berlaku dalam bakteria "lebih rendah" dan eukariota, dan yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain (yang lain ( yang kedua) berada dalam bakteria, protik dan metazoo.
Aldolase dari eukariota "unggul" terdiri daripada homotermeter subunit 40 kDa berat molekul, masing -masing dibentuk oleh laras yang terdiri daripada 8 β/α lembaran.
5- triosa-fosfat isomerase (Tim)
Kedua-dua triosas yang fosforilasi boleh saling berkaitan dengan satu sama lain terima kasih kepada tindakan isomerase triosa-fosfat, yang membolehkan kedua-dua gula digunakan di seluruh glikolisis, memastikan penggunaan lengkap setiap molekul glukosa yang memasuki jalan.
Enzim ini telah digambarkan sebagai enzim "sempurna", kerana ia memangkinkan reaksi yang diterangkan kira -kira satu bilion kali lebih cepat daripada yang akan berlaku tanpa penyertaannya. Tapak aktifnya terletak di tengah-tengah struktur beta-barel, ciri-ciri enzim glikolitik.
Ia adalah protein Dimérica, dibentuk oleh dua subunit yang sama kira -kira 27 kDa, kedua -duanya dengan struktur globular.
6- Glyceraldehyde 3-fosfat dehidrogenase (GAPDH)
Glyceraldehyde 3-fosfat yang dihasilkan oleh tindakan isomerase triosa-fosfat berfungsi sebagai substrat untuk GAPDH, yang merupakan enzim homoterramerik (34-38 kDa setiap subunit) , serta 2 ion fosfat atau sulfat.
Dalam laluan laluan ini, enzim ini membolehkan fosforilasi salah satu substratnya yang digunakan fosfat bukan organik sebagai penderma kumpulan fosforil, dengan pengurangan bersamaan dua molekul NAD+ dan pengeluaran 1.3-bifosphoglycerato.
7- Fosfoglycerato Kinase (PGK)
Kinase Fosphoglycerate bertanggungjawab untuk memindahkan salah satu kumpulan fosfat 1.3-bifogliserat kepada molekul ADP kerana fosforilasi di peringkat substrat. Enzim ini menggunakan mekanisme yang serupa dengan yang digunakan oleh hexoquinase, kerana ia ditutup untuk dihubungi pada substratnya, melindungi mereka dari molekul air interferensial.
Boleh melayani anda: aponeurosis: ciri, fungsi, lokasiEnzim ini, seperti orang lain yang menggunakan dua atau lebih substrat, mempunyai tapak mengikat untuk ADP dan yang lain untuk gula fosfat.
Tidak seperti enzim lain yang diterangkan, protein ini adalah monomer 44 kDa dengan struktur bilobular, terdiri daripada dua domain saiz yang sama yang dihubungkan dengan "alur" sempit.
8- mutase phosphoglycerate
3-phosphoglycerate mengalami perubahan dari kumpulan fosfat ke karbon 2, di tengah-tengah molekul, yang mewakili tapak ketidakstabilan strategik yang memudahkan pemindahan kumpulan berikutnya ke molekul ATP dalam reaksi terakhir laluan tersebut.
Resreglo ini dipangkin oleh enzim fosfogliserasi mutasa, enzim dimérica untuk manusia dan tetramerik untuk ragi, dengan saiz subunit hampir 27 kDa.
9- Enolase
Enolase memangkin dehidrasi 2-phosphoglycerate kepada phosphoenolpiruvate, langkah yang diperlukan untuk penjanaan ATP dalam reaksi berikut.
Ia adalah enzim Dimérica yang terdiri daripada dua subunit yang sama dengan 45 kDa. Ia bergantung kepada ion magnesium untuk kestabilan dan untuk perubahan konformasi yang diperlukan untuk menyertai substrat anda. Ia adalah salah satu enzim yang dinyatakan dengan kelimpahan yang lebih besar dalam sitosol banyak organisma dan menjalankan fungsi tambahan untuk glikolitik.
10- Quinasa Piruvato
Fosforilasi kedua di peringkat substrat yang berlaku dalam glikolisis dipangkin oleh piruvat kinase, yang bertanggungjawab untuk pemindahan kumpulan fosforil fosfoenolpiruvate kepada ADP dan pengeluaran pyruvate.
Enzim ini lebih kompleks daripada mana -mana enzim glikolitik yang lain dan dalam mamalia ia adalah enzim homotramal (57 kDa/subunit). Terdapat, dalam vertebrata, sekurang -kurangnya 4 isoenzim: L (dalam hati), R (dalam erythrocytes), M1 (dalam otot dan otak) dan M2 (tisu janin dan tisu dewasa).
Fasa glikolisis (langkah demi langkah)
Laluan glikolitik terdiri daripada sepuluh langkah berurutan dan bermula dengan molekul glukosa. Semasa proses, molekul glukosa adalah "diaktifkan" atau "disediakan" dengan penambahan dua fosfat, melabur dua molekul ATP.
Seterusnya ia "dipotong" dalam dua serpihan dan akhirnya diubahsuai secara kimia beberapa kali, mensintesis, di jalan raya, empat molekul ATP, jadi keuntungan bersih laluan sepadan dengan dua molekul ATP.
Dari atas, ia dapat disimpulkan bahawa laluan dibahagikan kepada fasa "pelaburan" tenaga, asas untuk pengoksidaan lengkap molekul glukosa, dan satu lagi fasa tenaga "keuntungan", di mana tenaga yang digunakan pada mulanya diisi semula dan dua ATP bersih molekul.
- Fasa pelaburan tenaga
1- Langkah pertama laluan glikolitik terdiri daripada fosforilasi glukosa yang dimediasi oleh hexoquinase (HK), yang mana enzim menggunakan molekul ATP untuk setiap molekul glukosa yang fosforilasi. Ia adalah tindak balas yang tidak dapat dipulihkan dan bergantung kepada kehadiran ion magnesium (Mg2+):
Glukosa + ATP → glukosa 6-fosfat + ADP
Glukosa 2- 6-fosfat yang dihasilkan adalah isomerized kepada fruktosa 6-fosfat berkat tindakan enzim fosfoglukosa isomerase (PGI) (PGI). Ini adalah tindak balas yang boleh diterbalikkan dan tidak membayangkan perbelanjaan tenaga tambahan:
Glukosa 6-fosfat → fruktosa 6-fosfat
3- Seterusnya, langkah pelaburan tenaga lain membayangkan fosforilasi fruktosa 6-fosfat untuk membentuk fruktosa 1.6-biphosphate. Reaksi ini dipangkin oleh enzim phosphofrutequinase-1 (PFK-1). Seperti langkah pertama laluan, molekul penderma kumpulan fosfat adalah ATP dan ia juga merupakan reaksi yang tidak dapat dipulihkan.
Fruktosa 6-fosfat + ATP → fruktosa 1.6-biphosphat + ADP
4- Dalam langkah glikolisis ini terdapat pecah pemangkin fruktosa 1.6-biphosphate dalam dihydroxyacetone fosfat (DHAP) ketosis, dan dalam gliseraldehida 3-fosfat (GAP). Pemeluwapan aldolis ini dikatalisasi oleh enzim aldolase dan merupakan proses yang boleh diterbalikkan.
Fruktosa 1.6-biffosphat → dihydroxyacetone fosfat + glyceraldehyde 3-fosfat
5- Reaksi terakhir fasa pelaburan tenaga terdiri daripada interconversion triosas dhap fosfat dan jurang yang dikatalisis oleh enzim isomerase triosa-fosfat (TIM), suatu fakta yang tidak memerlukan sumbangan tenaga tambahan dan juga proses yang boleh diterbalikkan.
Dihydroxyacetone fosfat ↔ Glyceraldehyde 3-fosfat
- Fasa keuntungan tenaga
6- 3-fosfat glyceraldehyde digunakan "hiliran" pada laluan glikolitik sebagai substrat untuk tindak balas pengoksidaan dan satu lagi fosforilasi, yang dipangkin oleh enzim yang sama, glyceraldehyde 3-fosfat dehydrogenase (gapdh).
Enzim memangkinkan pengoksidaan karbon C1 molekul ke asid karboksilik dan fosforilasi ini dalam kedudukan yang sama, menghasilkan 1.3-bifoscicerate. Dalam perjalanan reaksi, 2 NAD+ molekul dikurangkan setiap molekul glukosa dan 2 molekul fosfat bukan organik digunakan.
Boleh melayani anda: trachea2GlyceralDehyde 3-phosphate + 2NAD + + 2PI → 2 (1.3-bifosphoglycerato) + 2NADH + 2H
Dalam organisma aerobik, setiap NADH yang dihasilkan dengan cara ini melalui rantai penghantar elektron untuk berfungsi sebagai substrat untuk sintesis 6 molekul ATP disebabkan oleh fosforilasi oksidatif.
7- Ini adalah langkah pertama sintesis ATP dalam glikolisis dan membayangkan tindakan fosfoglycerato kinase (PGK) pada 1.3-bifogliserat, memindahkan kumpulan fosforil (fosforilasi pada tahap substrat) dan 2 molekul 3-phosphoglycerate (3pg) untuk setiap molekul glukosa.
2 (1.3-bifosphoglycerato) + 2ADP → 2 (3-phosphoglycerate) + 2ATP
8- 3-phosphoglycerate berfungsi sebagai substrat untuk enzim phosphoglycerato mutasa (PGM), yang menjadikannya 2-phosphoglycerate dengan anjakan kumpulan fosforil karbon 3 kepada karbon 2 dengan reaksi dua langkah yang boleh diterbalikkan dan bergantung Ion magnesium (mg+2).
2 (3-phosphoglycerate) → 2 (2-phosphoglycerate)
9- Enzim dalam dehidrat 2-phosphoglycerate dan menghasilkan phosphoenolpiruvate (PEP) dengan cara tindak balas yang tidak meraih penambahan tenaga tambahan dan yang bertujuan untuk menghasilkan sebatian tenaga yang tinggi, yang mampu mendermakan kumpulan fosforilnya dalam reaksi seterusnya.
2 (2-phosphoglycerate) → 2fosfoenolpiruvate
10- phosphoenolpiruvate adalah substrat enzim pyruvate kinase (pyk), yang bertanggungjawab untuk pemindahan kumpulan fosforil dalam molekul ini ke arah molekul ADP, dengan itu memangkinkan, oleh itu, reaksi fosforilasi pada tahap substrat di peringkat substrat.
Dalam reaksi 2ATP dan 2 molekul piruvat dihasilkan untuk setiap glukosa dan kehadiran kalium dan magnesium dalam bentuk ionik diperlukan.
2FOSPO ELPLIVATO + 2ADP → 2PYRUVATE + 2ATP
Prestasi bersih glikolisis, dengan cara ini, terdiri daripada 2ATP dan 2NAD+ untuk setiap molekul glukosa yang memasuki laluan.
Jika ini adalah sel -sel dengan metabolisme aerobik, maka jumlah kemerosotan molekul glukosa menghasilkan antara 30 dan 32 ATP melalui kitaran Krebs dan rantai pengangkutan elektron.
Produk glikolisis
Reaksi umum glikolisis adalah seperti berikut:
Glukosa + 2NAD + + 2ADP + 2PI → 2Pyruvate + 2ATP + 2NADH + 2H+
Oleh itu, jika ia dianalisis secara ringkas, ia dapat memastikan bahawa produk utama laluan glikolitik adalah piruvat, ATP, NADH dan H.
Walau bagaimanapun, destinasi metabolik setiap perantara tindak balas bergantung, sebahagian besarnya, pada keperluan selular, oleh itu semua perantara boleh dianggap sebagai produk tindak balas, dapat mencubanya seperti berikut:
- Glukosa 6-fosfat
- Fruktosa 6-fosfat
- Fruktosa 1.6-biphosphate
- Dihydroxyacetone fosfat dan glyceraldehyde 3-fosfat
- 1.3-Bifosphoglycerato
- 3-phosphoglycerate dan 2-phosphoglycerate
- Phosphoenolpiruvate dan pyruvate
Kepentingan
Walaupun glikolisis, dengan sendirinya (boleh bercakap tentang glikolisis anaerobik) menghasilkan hanya kira -kira 5% daripada ATP yang boleh diekstrak daripada katabolisme aerobik glukosa, laluan metabolik ini adalah asas untuk beberapa sebab:
- Ia berfungsi sebagai sumber tenaga "cepat", terutamanya dalam situasi di mana haiwan harus meninggalkan keadaan rehat dengan cepat, yang mana proses pengoksidaan aerobik tidak cukup cepat.
- Serat otot "putih" rangka dalam tubuh manusia, contohnya, adalah gentian penguncupan pesat dan bergantung kepada glikolisis anaerobik untuk berfungsi.
- Bila, atas sebab tertentu, sel memerlukan glikolitik.
- Banyak sel bergantung kepada glukosa sebagai sumber tenaga oleh laluan glikolitik, termasuk sel darah merah, kekurangan organel dalaman, dan sel mata (terutamanya kornea) yang tidak mempunyai ketumpatan mitokondria yang hebat.
Rujukan
- Canback, b., Andersson, s. G. Dan., & Kurland, c. G. (2002). Phylogeny global enzim glikolitik. Prosiding Akademi Sains Kebangsaan, 99 (9), 6097-6102.
- Chaudhry R, Varacallo M. Biokimia, glikolisis. [Dikemaskini 2019 AP 21]. Dalam: Statpearls [Internet]. Treasure Island (FL): Penerbitan Statpearls; 2020 Jan-. Terdapat dari: https: // www.NCBI.NLM.NIH.Kerajaan/Buku/NBK482303/
- Fothergill-Gilmore, l. Ke., & Michels, p. Ke. (1993). Evolusi glikolisis. Kemajuan dalam Biofizik dan Biologi Molekul, 59 (2), 105-235.
- Kim, j. W., & Dang, c. V. (2005). Peranan pelbagai enzim glikolitik. Trend dalam Sains Biokimia, 30 (3), 142-150.
- Kumari, a. (2017). Biokimia manis: Mengingati struktur, kitaran, dan laluan oleh mnemonik. Akhbar Akademik.
- Li, x. B., Gu, j. D., & Zhou, Q. H. (2015). Kajian semula glikolisis aerobik dan sasaran enzim utama untuk terapi kanser paru-paru. Kanser Thoracic, 6 (1), 17-24.
- « Ciri -ciri Haiwan Herbivora, Jenis, Contoh
- Ciri -ciri virus Mosaic Tembakau, Struktur, Replikasi »

