Ciri -ciri Kumpulan Karbonyl, Harta, Tatanama, Kereaktifan
- 4264
- 155
- Anthony Breitenberg
Dia Kumpulan Carbonyl Ia adalah kumpulan berfungsi organik dan oksigen yang menyerupai molekul gas karbon monoksida. Ia diwakili sebagai C = O, dan walaupun ia dianggap organik, ia juga boleh didapati dalam sebatian bukan organik; Seperti asid karbonik, h2Co3, atau dalam sebatian organometal dengan CO sebagai mengikat.
Walau bagaimanapun, ia adalah dalam kimia karbon, kehidupan, biokimia dan cawangan saintifik yang lain di mana kumpulan ini menonjol untuk kepentingannya. Jika bukan untuknya, banyak molekul tidak dapat berinteraksi dengan air; Protein, gula, asid amino, lemak, asid nukleik dan biomolekul lain tidak akan wujud jika bukan untuknya.
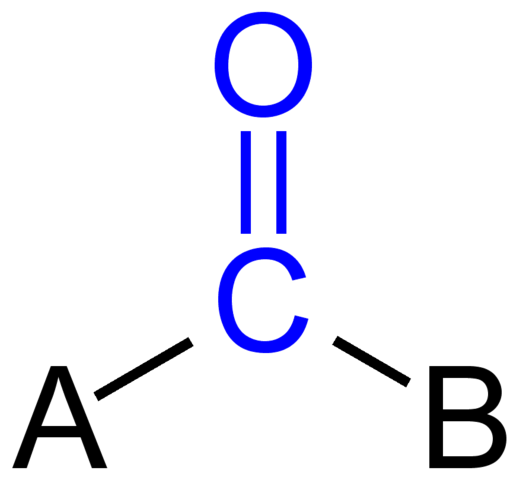
 Kumpulan Carbonyl. Sumber: Jü [Domain Awam]
Kumpulan Carbonyl. Sumber: Jü [Domain Awam] Imej atas menunjukkan bagaimana kumpulan ini kelihatan di rangka umum sebatian. Perhatikan bahawa ia diserlahkan oleh warna biru, dan jika kita mengeluarkan penggantian A dan B (R atau R ', sama sah), akan ada molekul karbon monoksida. Kehadiran substituen ini mentakrifkan sejumlah besar molekul organik.
Sekiranya A dan B adalah atom karbon, seperti logam atau unsur bukan logam, sebatian organometal atau bukan organik boleh dibuat. Dalam kes kimia organik, substituen A dan B akan sentiasa menjadi atau atom hidrogen, garisan berkarbonat, dengan atau tanpa ramuan, kitaran, atau cincin aromatik.
Oleh itu, ia mula memahami mengapa kumpulan karbonil adalah perkara biasa bagi mereka yang belajar sains semula jadi atau kesihatan; Di mana -mana, dan tanpa itu mekanisme molekul yang berlaku di sel kita tidak akan berlaku.
Sekiranya kaitannya dapat diringkaskan, dikatakan bahawa ia memberikan polaritas, keasidan dan kereaktifan kepada molekul. Di mana terdapat kumpulan karbonil, kemungkinan besar pada ketika itu molekul mungkin mengalami transformasi. Oleh itu, ia adalah tapak strategik untuk membangunkan sintesis organik melalui pengoksidaan atau serangan nukleofilik.
[TOC]
Ciri -ciri dan sifat kumpulan karbonil
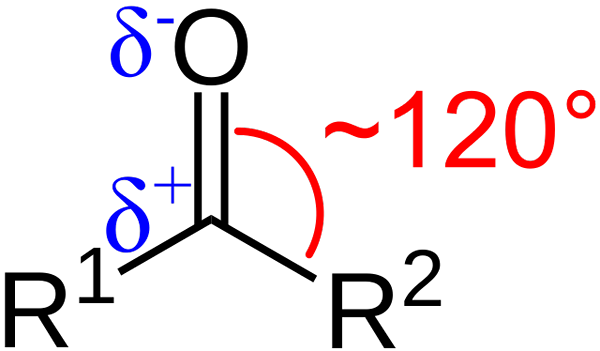 Ciri -ciri struktur kumpulan karbonil. Sumber: Azaline Gomberg [Domain Awam].
Ciri -ciri struktur kumpulan karbonil. Sumber: Azaline Gomberg [Domain Awam]. Apakah ciri -ciri struktur dan elektronik kumpulan karbonil? Naik1 dan r2 Daripada A dan B, yang wujud di antara substituen dan atom oksigen sudut 120 ° C; Iaitu, geometri di sekitar kumpulan ini adalah trigonal flat.
Apakah geometri seperti itu2; Oleh itu, karbon akan mempunyai tiga orbital SP2 Untuk membentuk pautan kovalen mudah dengan r1 dan r2, dan orbital p murni untuk menubuhkan ikatan berganda dengan oksigen.
Dengan cara ini ia dijelaskan bagaimana boleh ada ikatan berganda c = o.
Sekiranya imej diperhatikan, ia juga akan dilihat bahawa oksigen mempunyai ketumpatan elektronik yang lebih besar, δ-, daripada karbon, δ, δ+. Ini kerana oksigen lebih elektronegatif daripada karbon, dan oleh itu "mencuri" ketumpatan elektronik; Dan bukan hanya kepadanya, tetapi juga kepada substituen r r1 dan r2.
Oleh itu, momen dipole kekal dijana, yang boleh menjadi magnitud yang lebih besar atau lebih rendah bergantung kepada struktur molekul. Di mana terdapat kumpulan karbonil, akan ada saat -saat dipole.
Struktur resonans
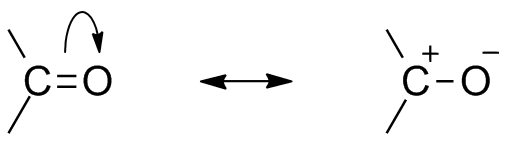 Dua struktur resonans untuk kumpulan organik ini. Sumber: Mfomich [CC0]
Dua struktur resonans untuk kumpulan organik ini. Sumber: Mfomich [CC0] Satu lagi akibat dari elektronegativiti oksigen ialah dalam kumpulan karbonil terdapat struktur resonans yang menentukan hibrid (gabungan dua struktur imej unggul). Perhatikan bahawa pasangan elektron boleh berhijrah ke orbital p oksigen, yang meninggalkan atom karbon dengan beban separa positif; Karbohidrat.
Boleh melayani anda: Cycloalcanos: sifat, reaksi, kegunaan, contohKedua -dua struktur itu berlaku secara berterusan, jadi karbon mengekalkan kekurangan elektron yang berterusan; iaitu, untuk kation yang sangat dekat dengannya, mereka akan mengalami penolakan elektrostatik. Tetapi, jika ia adalah anion, atau spesies yang mampu menderma elektron, ia akan merasakan tarikan yang kuat untuk karbon ini.
Maka apa yang dikenali sebagai serangan nukleofilik, yang akan dijelaskan dalam bahagian seterusnya.
Nomenclature
Apabila sebatian mempunyai kumpulan c = o, dikatakan bahawa ia adalah karbonyl. Oleh itu, bergantung kepada sifat sebatian karbonyl, ia mempunyai peraturan tatanama tersendiri.
Walaupun, tanpa mengira apa, semua orang berkongsi peraturan yang sama: C = O mempunyai keutamaan dalam rantai berkarbonat pada masa penyenaraian atom karbon.
Ini bermakna jika terdapat kesan, atom halogen, kumpulan fungsi nitrogenik, pautan berganda atau tiga, tiada seorang pun daripada mereka boleh membawa nombor yang lebih kecil daripada C = O; Oleh itu, rantai terpanjang mula disenaraikan sedekat mungkin untuk kumpulan karbonil.
Jika sebaliknya terdapat beberapa c = atau dalam rantai, dan salah satunya adalah sebahagian daripada kumpulan berfungsi hierarki yang lebih besar, maka kumpulan karbonil akan membawa pencari yang lebih besar dan akan disebut sebagai substituen oxo.
Dan apa yang dikatakan hierarki? Yang berikut, dari tertinggi hingga kecil:
-Asid karboksilat, rcooh
-Ester, rcoor '
-Amida, Rconh2
-Aldehid, rcoh (atau rcho)
-Cetona, Rcor
Menggantikan R dan R 'dengan segmen molekul, sebatian karbonil yang tidak berkesudahan yang diwakili oleh keluarga di atas: asid karboksilik, ester, amidas, dll. Masing -masing telah mengaitkan tatanama tradisional atau IUPAC.
Reaktiviti
Serangan nukleofilik
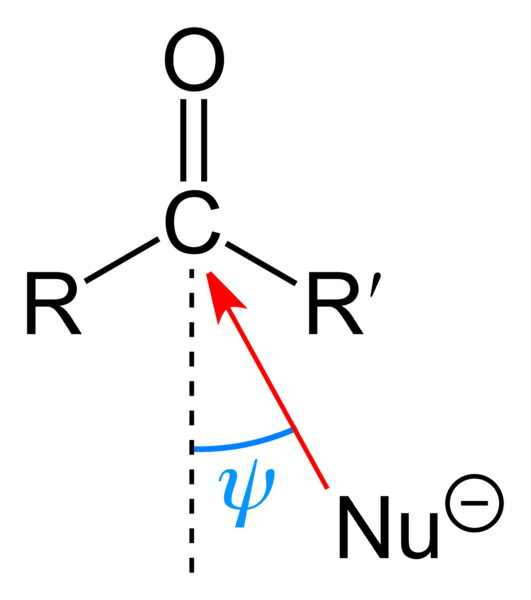 Serangan nukleofilik terhadap kumpulan karbonil. Sumber: Benjah-bmm27 [domain awam]
Serangan nukleofilik terhadap kumpulan karbonil. Sumber: Benjah-bmm27 [domain awam] Imej atas menunjukkan serangan nukleofilik yang dialami oleh kumpulan karbonil. Nukleofil, nu-, Ia boleh menjadi anion atau spesies neutral dengan elektron yang ada; Seperti ammonia, NH3, Sebagai contoh. Ini kelihatan semata -mata untuk karbon kerana, mengikut struktur resonans, ia memberikan beban separa positif.
Beban positif menarik NU-, yang akan berusaha untuk mendekati "sayap" sehingga ada halangan sterik yang sedikit oleh substituen R dan R '. Bergantung pada betapa besarnya mereka, atau saiz NU yang sama-, Serangan akan berlaku kepada sudut yang berbeza ψ; Ia boleh sangat terbuka atau ditutup.
Sebaik sahaja serangan itu berlaku, sebatian perantara akan dibentuk, nu-cr'-o-; iaitu, oksigen kekal dengan beberapa elektron untuk membolehkan NU ditambah- ke kumpulan karbonil.
Oksigen yang dimuatkan secara negatif ini dapat campur tangan dalam langkah -langkah lain dari reaksi; Proton sebagai kumpulan hidroksil, OH, atau melepaskan seperti molekul air.
Boleh melayani anda: pekali partition: pengedaran, pengedaran, aplikasiMekanisme yang terlibat, serta produk tindak balas yang diperolehi oleh serangan ini, sangat bervariasi.
Derivatif
Ejen nublyic nu- Ia boleh menjadi banyak spesies. Untuk setiap spesifik untuk bertindak balas dengan kumpulan karbonil, derivatif yang berbeza.
Sebagai contoh, apabila dikatakan ejen nukleofilik adalah amina, NH2A, iminas asal, r2C = nr; Sekiranya ia hidrokslamine, NH2Oh, hasil dalam oximas, rr'c = noh; Sekiranya ia adalah anion sianida, CN-, Cianohydrinas, rr'c (oh) cn, dan dengan itu dengan spesies lain.
Pengurangan
Pada mulanya dikatakan bahawa kumpulan ini beroksigen, dan oleh itu, berkarat. Ini bermakna, memandangkan keadaan, pautan dapat dikurangkan atau kehilangan atom oksigen menggantikannya dengan hidrogen. Sebagai contoh:
C = o => ch2
Transformasi ini menunjukkan bahawa kumpulan karbonil dikurangkan kepada kumpulan metilena; Terdapat keuntungan hidrogen akibat kehilangan oksigen. Dalam istilah kimia yang lebih sesuai: sebatian karbonil dikurangkan menjadi alkane.
Jika ia adalah cetona, rcor ', dengan kehadiran hydraracina, h2N-nh2, dan persekitaran yang sangat asas dapat dikurangkan kepada alkana masing -masing; Reaksi ini dikenali sebagai pengurangan Wolff-Kishner:
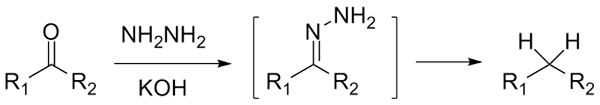 Pengurangan Wolff-Kishner. Sumber: Jü [CC0]
Pengurangan Wolff-Kishner. Sumber: Jü [CC0] Jika sebaliknya campuran tindak balas terdiri daripada zink amalgamat dan asid hidroklorik, tindak balas dikenali sebagai pengurangan clemmensen:
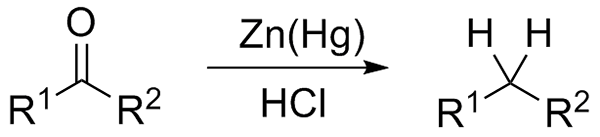 Pengurangan Clemmensen. Sumber: Wikimedia Commons.
Pengurangan Clemmensen. Sumber: Wikimedia Commons.
Latihan Acetal dan Ceal
Kumpulan karbonil bukan sahaja dapat menambah ejen nukleofilik NU-, Tetapi dalam keadaan asid ia juga boleh bertindak balas dengan alkohol melalui mekanisme yang serupa.
Apabila aldehid atau cetona sebahagiannya bertindak balas dengan alkohol, hemiacetals atau hemical berasal dari. Sekiranya tindak balas dijalankan sepenuhnya, produk adalah asetal dan ketals. Persamaan kimia berikut meringkaskan dan menjelaskan yang baru disebutkan:
Rcho + r3Oh g rchoh (atau3) (Hemiacetal) + r4Oh g rch (atau3) (Atau4) (Acetal)
Rcor2 + R3Oh g rcor2(Oh) (atau3) (Hemical) + r4Oh g rcor2(Atau3) (Atau4) (ketal)
Reaksi pertama sepadan dengan pembentukan hemiacetals dan asetal dari aldehid, dan kedua hemicetals dan ketal dari keton.
Persamaan ini tidak cukup mudah untuk menerangkan pembentukan sebatian ini; Walau bagaimanapun, untuk pendekatan pertama kepada subjek, sudah cukup untuk memahami bahawa alkohol ditambah, dan rantai sampingan mereka r (r (r (r (r (r3 dan r4) Mereka dikaitkan dengan karbon karbonil. Itulah sebabnya atau atau3 dan atau4 Ke molekul awal.
Perbezaan utama antara asetal dan ketal, adalah kehadiran atom hidrogen yang dikaitkan dengan karbon. Perhatikan bahawa keton tidak mempunyai hidrogen ini.
Lelaki
Sangat serupa seperti yang dijelaskan dalam bahagian nomenclature untuk kumpulan karbonil, jenisnya didasarkan pada apa yang substituen A dan B, atau R dan R '. Oleh itu, terdapat ciri -ciri struktur yang berkongsi satu siri sebatian karbonil melebihi pesanan atau jenis pautan.
Sebagai contoh, sebutkan dibuat kepada prinsip analogi antara kumpulan ini dan karbon monoksida, C≡O. Sekiranya molekul tidak mempunyai atom hidrogen dan jika terdapat juga dua terminal C = O, ia akan menjadi karbon oksida, cnSama ada2. Untuk N sama dengan 3, anda akan mempunyai:
Boleh melayani anda: isóbarosO = C = C = C = O
Yang seolah -olah terdapat dua molekul C≡O yang dikaitkan dan dipisahkan oleh karbon.
Sebatian karbonil bukan sahaja dapat diperoleh dari gas Co, tetapi juga dari asid karbonik, h2Co3 atau oh- (c = o) -oh. Di sini kedua -dua oh mewakili r dan r ', dan menggantikan salah satu daripada mereka, atau hidrogen mereka, derivatif asid karbononik diperolehi.
Dan kemudian terdapat derivatif asid karboksilik, RCOOH, yang diperolehi dengan mengubah identiti R, atau menggantikan H dengan atom atau rantai lain (yang akan menimbulkan ester, rcoor ').
Cara mengenalinya di Aldehid dan Ketones
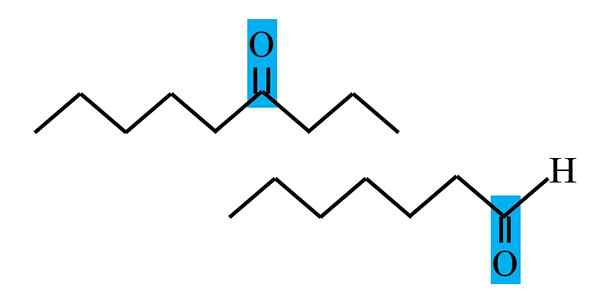 Pembezaan keton dan aldehid dari formula struktur. Sumber: Gabriel Bolívar.
Pembezaan keton dan aldehid dari formula struktur. Sumber: Gabriel Bolívar. Kedua -dua aldehid dan keton mempunyai kesamaan kehadiran kumpulan karbonil. Sifat kimia dan fizikalnya disebabkan olehnya. Walau bagaimanapun, persekitaran molekul mereka tidak sama dalam kedua -dua sebatian; Dalam bekas dia berada di kedudukan terminal, dan dalam beberapa saat, di mana sahaja di rantai.
Contohnya, di bahagian atas, kumpulan karbonil berada di dalam kotak kebiruan. Di dalam keton, di sebelah kotak ini mesti ada segmen karbon atau rantai lain (terbalik); Semasa di aldehid, hanya ada atom hidrogen (di bawah).
Jika C = O berada di satu hujung rantai, ia akan menjadi aldehid; Itu adalah cara paling langsung untuk membezakannya dari cetona.
ID
Tetapi bagaimana untuk mengetahui secara eksperimen jika sebatian yang tidak diketahui adalah aldehid atau keton? Terdapat banyak kaedah, dari spektroskopi (penyerapan radiasi inframerah, IR), atau ujian kualitatif organik.
Mengenai esei kualitatif, ini adalah berdasarkan reaksi yang apabila memberi positif, penganalisis akan melihat tindak balas fizikal; Perubahan warna, pelepasan haba, pembentukan gelembung, dll.
Sebagai contoh, menambah sampel penyelesaian asid k2Cr2Sama ada7 Aldehid akan diubah menjadi asid karboksilik, yang menjadikan warna perubahan penyelesaian dari oren ke hijau (ujian positif). Sementara itu, keton tidak bertindak balas, dan oleh itu, penganalisis tidak mematuhi sebarang perubahan warna (ujian negatif).
Percubaan lain adalah menggunakan reagen Tollens, [AG (NH3)2]+, supaya aldehid mengurangkan kation ag+ ke perak logam. Dan hasilnya: pembentukan cermin perak di bahagian bawah tiub ujian di mana sampel diletakkan.
Contoh utama
Akhirnya, satu siri contoh sebatian karbonyl akan disenaraikan:
-Ch3COOH, asid asetik
-HCOOH, asid formik
-Ch3COCH3, Propanona
-Ch3COCH2Ch3, 2-Butanon
-C6H5COCH3, acetophenone
-Ch3Cho, Etanal
-Ch3Ch2Ch2Ch2Cho, Pentanal
-C6H5Cho, Benzaldehyde
-Ch3Conh2, acetamide
-Ch3Ch2Ch2Cooch3, Propil asetat
Sekarang, jika contoh sebatian disebutkan yang hanya memiliki kumpulan ini, senarai itu hampir tidak berkesudahan.
Rujukan
- Morrison, r. T. dan Boyd, R, n. (1987). Kimia organik. Edisi ke -5. Editorial Addison-Wesley Inter-American.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. Amina. (Edisi ke -10.). Wiley Plus.
- Reid Danielle. (2019). Kumpulan Carbonyl: Properties & Gambaran Keseluruhan. Kajian. Pulih dari: belajar.com
- Sharleen Agvateesiri. (5 Jun, 2019). Kumpulan Karbonyl. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Wiki Kids Ltd. (2018). Sebatian Carbonyl. Pulih dari: hanya.Sains
- Toppr. (s.F.). Nomenklatur dan Struktur Kumpulan Karbonyl. Pulih dari: TOPPR.com
- Clark J. (2015). Pengoksidaan aldehid dan keton. Pulih dari: chemguide.co.UK

