Kumpulan hidroksil

- 1660
- 242
- Dallas Bernhard
Kami menerangkan apa kumpulan hidroksil, ciri -ciri, struktur dan beberapa contohnya
 Struktur kimia kumpulan hidroksil
Struktur kimia kumpulan hidroksil Apa itu kumpulan hidroksil?
A Kumpulan hidroksil Ia adalah kumpulan berfungsi atau sebahagian daripada kumpulan berfungsi lain yang terdapat di banyak sebatian organik dan bukan organik. Ia dibentuk oleh atom hidrogen dan salah satu oksigen (oleh itu namanya).
Kumpulan hidroksil biasanya dikaitkan dengan atom karbon atau elemen bukan logam lain seperti sulfur atau fosforus, antara lain, dan merupakan salah satu kumpulan fungsional yang paling penting dalam kimia organik.
Kumpulan atom ini terdapat dalam kumpulan berfungsi organik seperti alkohol, fenol dan asid karboksilik, dan adalah yang memberikan setiap kumpulan fungsinya ciri ciri -ciri ciri -ciri ciri -ciri ciri -ciri. Dalam struktur yang berbeza ia boleh diwakili sebagai -OH atau HO-
Ciri -ciri kumpulan hidroksil
- Ia terdiri daripada atom oksigen dan salah satu hidrogen yang dikaitkan antara satu sama lain dan dikaitkan dengan atom lain dalam molekul melalui ikatan kovalen.
- Hubungan antara atom hidrogen dan oksigen adalah ikatan kutub di mana oksigen mempunyai beban separa negatif dan hidrogen beban separa positif, yang menjadikan kumpulan hidroksil sebagai kumpulan fungsi polar.
- Ia mempunyai struktur yang serupa dengan air. Atas sebab ini, banyak sebatian yang mengandungi ia biasanya larut dalam pelarut tersebut.
- Ia mempunyai hidrogen secara langsung dikaitkan dengan atom oksigen, jadi kumpulan hidroksil dapat membentuk ikatan hidrogen di mana ia mengambil bahagian sebagai kumpulan hidrogen penderma.
- Mempunyai dua elektron bebas pada atom oksigen, kumpulan hidroksil boleh membentuk dua ikatan hidrogen tambahan yang bertindak sebagai penerima atom hidrogen.
- Anda boleh bertindak sebagai asid dengan memberikan proton ke pangkalan. Bergantung pada kumpulan berfungsi yang mana ia adalah sebahagian dan atom yang dikaitkan secara langsung, kumpulan hidroksil dapat menunjukkan tahap keasidan yang berbeza. Sebagai contoh, dalam alkohol, ia mempunyai PKA sebanyak 15 atau lebih (asid sengit daripada air), dalam fenol ia berbeza antara 7 dan 10 manakala dalam asid karboksilik biasanya antara 4 dan 5.
- Anda juga boleh bertindak sebagai pangkalan Lewis, mendermakan salah satu pasangan elektronnya untuk menghubungkan ke proton lain atau asid Lewis yang lain.
Struktur kumpulan hidroksil
Seperti yang disebutkan di antara ciri -ciri, atom oksigen dan hidrogen dalam kumpulan hidroksil membentuk ikatan kovalen kutub.
Di samping itu, atom oksigen membentuk ikatan kovalen kedua dengan atom lain yang merupakan sebahagian daripada molekul sebagai alkohol, fenol ke beberapa kompaun lain. Struktur Lewis kumpulan ini dibentangkan di bawah:
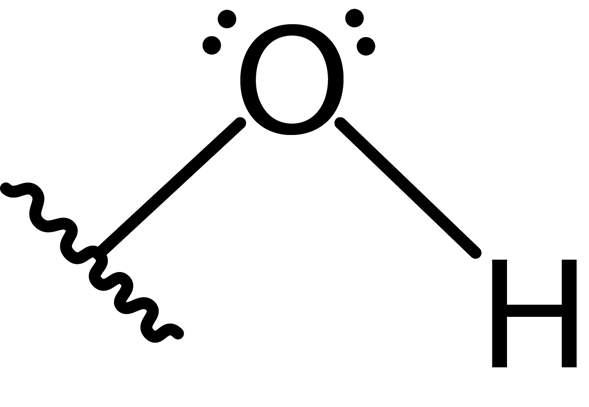
Oleh kerana kehadiran dua pasang elektron bebas pada atom oksigen dan dua ikatan kovalen, kumpulan hidroksil mempunyai geometri sudut dengan sudut kira -kira 104 °, sedikit lebih rendah daripada sudut tetrahedral. Panjang ikatan hidrogen oksigen adalah sekitar 0.97 Angstroms.
Kumpulan hidroksil, hidroksil radikal dan hidroksida
Sangat biasa untuk mengelirukan kumpulan hidroksil dengan anion radikal dan hidroksida hidroksil, kerana semuanya dibentuk oleh dua atom yang sama, bagaimanapun, istilah ini tidak merujuk kepada yang sama.
Di satu pihak, radikal hidroksil berbeza dari kumpulan hidroksil di mana ia adalah radikal bebas dengan bilangan elektron valensi yang ganjil, dan juga tidak dikaitkan dengan mana -mana atom atau kumpulan atom lain (itulah sebabnya ia diberitahu percuma).
Walaupun terdapat perbezaan ini, ramai orang salah menggunakan istilah radikal hidroksil untuk merujuk kepada kumpulan hidroksil apabila hadir dalam molekul.
Anion hidroksida, sebaliknya, adalah ion dengan beban negatif yang dibentuk oleh hidrogen dan oksigen, sementara kumpulan hidroksil adalah kumpulan neutral.
Di samping.
Boleh melayani anda: apakah anod dan katod?Contoh kumpulan hidroksil
Alkohol
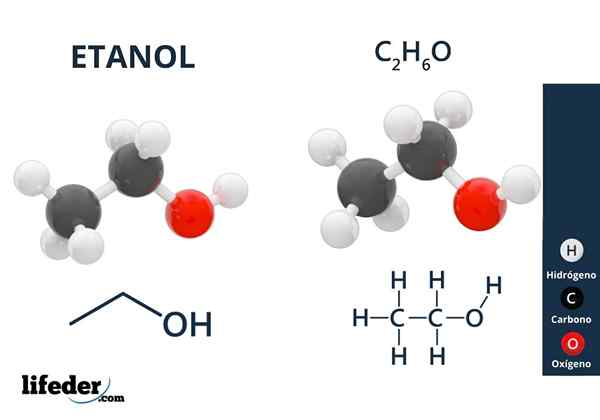 Etanol
Etanol Alkohol mempunyai kumpulan hidroksil yang dikaitkan dengan karbon alifatik. Contoh alkohol adalah:
- Metil alkohol.
- Etanol.
- Isopropil alkohol.
Phenols
Fenol dicirikan dengan mempunyai kumpulan hidroksil secara langsung dikaitkan dengan cincin aromatik. Beberapa contoh fenol biasa adalah:
- Phenol.
- Alfa dan beta-naftol.
- Ortho, matlamat dan cresol.
Karbohidrat
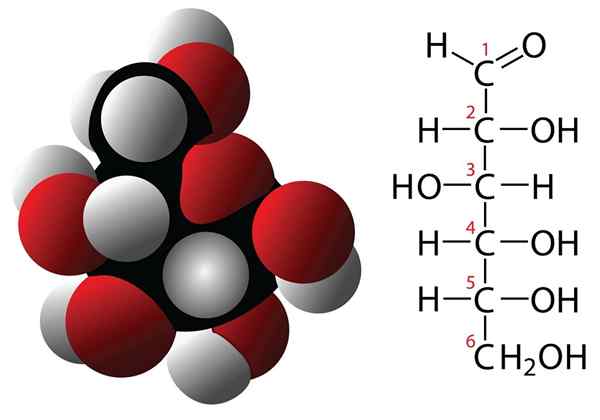 Molekul formula glukosa dan molekul
Molekul formula glukosa dan molekul Karbohidrat adalah sebatian dengan 3 atau lebih atom karbon yang dicirikan dengan mempunyai formula empirikal yang dibentuk oleh karbon dan molekul air. Sebatian ini sering mempunyai pelbagai kumpulan hidroksilia yang menjadikannya sangat larut dalam air. Beberapa contoh karbohidrat adalah:
- Glukosa.
- Fruktosa.
- Saccharose.
Asid karboksilik
Kumpulan berfungsi karboksil yang terdapat dalam asid karboksilik sepadan dengan salah satu kumpulan fungsional yang paling berasid yang boleh dimiliki oleh molekul organik. Sebatian ini biasanya asid lemah apabila membandingkannya dengan beberapa asid mineral, tetapi mereka boleh menjadi sangat berasid bergantung kepada struktur mereka.
Keasidan kumpulan karboksil adalah disebabkan oleh kehadiran kumpulan hidroksil yang dikaitkan dengan kumpulan karbonil, yang menstabilkan beban negatif anion yang terbentuk apabila hidroksil menghasilkan protonnya. Beberapa contoh asid karboksilik adalah:
- Asid asetik.
- Asid benzoik.
- Asid trifluoroacetic.
Asid sulfonik
Asid sulfonik adalah sebatian organik yang dibentuk oleh tindak balas antara beberapa sebatian organik dan asid sulfurik atau sulfur dioksida. Jenis -jenis sebatian ini mempunyai kumpulan hidroksil dan, secara umum, adalah asid yang agak kuat, setanding dengan asid sulfurik.
Beberapa contoh asid sulfonik adalah:
- Asid pentosulfonik.
- Ortho, matlamat dan isomer asid toluensulfonik.
- Asid benzeulfonic.
Asid bukan organik
Kumpulan hidroksil bukan sahaja muncul dalam sebatian organik. Banyak sebatian bukan organik juga memilikinya, khususnya asid oksasid. Dalam kes ini, kumpulan hidroksil secara langsung dikaitkan dengan bukan metal, biasanya berbeza dengan karbon.
Beberapa contoh asid bukan organik yang mempunyai kumpulan hidroksil bersama -sama dengan bukan metal yang mana ia dihubungkan adalah:
- Asid hypochlorous, di mana kumpulan hidroksil dikaitkan dengan atom klorin.
- Asid sulfurik, yang mempunyai dua kumpulan hidroksil yang dikaitkan dengan atom sulfur.
- Asid fosforik, di mana tiga kumpulan hidroksil dikaitkan dengan atom fosforus.

