Halogen
- 1657
- 503
- Donnie Ryan
 Unsur -unsur adalah 5: fluorida, klorin, bromin, yodium dan menyatakan semula
Unsur -unsur adalah 5: fluorida, klorin, bromin, yodium dan menyatakan semula Apa itu halogen?
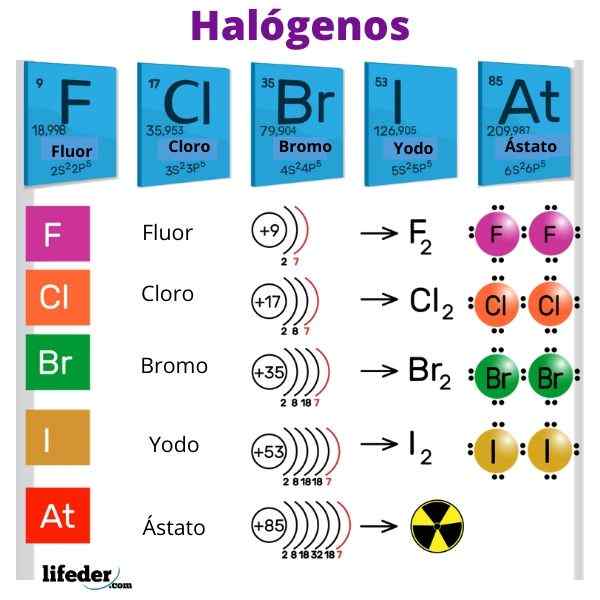
The Halogen Mereka adalah unsur bukan logam yang tergolong dalam kumpulan VIIA atau 17 dari jadual berkala. Mereka mempunyai elektronegativiti elektronik yang tinggi dan pertalian, yang sangat memberi kesan kepada sifat ionik ikatan mereka dengan logam. Perkataan 'halogeno' berasal dari bahasa Yunani dan bermaksud "garam garam".
Halogen adalah fluorida (F), klorin (CL), bromin (BR), iodin (i) dan unsur radioaktif dan tidak lama lagi (AT). Mereka begitu reaktif bahawa mereka bertindak balas antara satu sama lain untuk membentuk molekul diatomik: f2, Cl2, Br2, Yo2 dan di2.
Molekul ini dicirikan dengan mempunyai sifat struktur yang serupa (molekul linear), walaupun dengan keadaan fizikal yang berbeza.
Apakah penampilan halogen?
Dalam gambar yang lebih rendah tiga halogen ditunjukkan. Dari kiri ke kanan: klorin, bromin dan iodin. Fluorin mahupun janteat tidak dapat disimpan di dalam bekas kaca, kerana yang terakhir tidak menahan kehamilan mereka. Perhatikan bagaimana sifat organoleptik halogen berubah kerana kumpulan mereka turun ke elemen iodin.
 Penampilan halogen. Sumber: Sumber: oleh W. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], melalui Wikimedia Commons
Penampilan halogen. Sumber: Sumber: oleh W. OELEN [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], melalui Wikimedia Commons Fluorin adalah gas nada kekuningan; Klorin juga, tetapi kuning-hijau; Bromo adalah cecair kemerahan gelap; Iodin, pepejal hitam dengan violet visos; Dan astat, pepejal logam yang gelap dan cerah.
Halogen dapat bertindak balas dengan hampir semua elemen jadual berkala, walaupun dengan beberapa gas mulia (seperti Xenon dan Kripton). Apabila mereka melakukannya, mereka dapat mengoksidakan atom ke keadaan pengoksidaan yang paling positif, menjadikan mereka ejen pengoksidaan yang kuat.
Begitu juga, mereka memberikan sifat khusus kepada molekul apabila beberapa atom mereka dikaitkan atau diganti. Jenis sebatian ini dipanggil haluros. Malah, haluros merupakan sumber semulajadi halogen utama, dan kebanyakannya dibubarkan di laut atau merupakan sebahagian daripada mineral; Begitulah kes fluorit (CAF2).
Kedua -dua halogen dan haluros mempunyai pelbagai kegunaan, dari perindustrian atau teknologi, untuk menyerlahkan rasa makanan tertentu, seperti garam permata (natrium klorida) (natrium klorida).
Sifat fizikal dan kimia halogen
Berat atom
Fluoride (F) 18.99 g/mol; Klorin (CL) 35.45 g/mol; Bromo (BR) 79.90 g/mol; Iodin (i) 126.9 g/mol dan astato (pada) 210 g/mol.
Keadaan fizikal
F gas; Gaseous Cl; Cecair; Saya Pepejal dan Pepejal.
Warna
F, pucat kuning-grind; CL, pucat hijau; Br, Reddish-Brown; I, violet dan at, logam hitam * * (diandaikan)
Mata Fusion
F -219.6º C; CL -101.5º C; BR -7.3º C; I 113.7º C dan pada 302º c.
Mata mendidih
F -118.12º C; CL -34.04º C; Br 58.8º C; I 184.3º C dan ?Pada 337º c.
Ketumpatan pada 25º c
F- 0.0017 g/cm3; CL- 0.0032 g/cm3; Br- 3,102 g/cm3; I- 4.93 g/cm3 dan di- 6.2-6.5 g/cm3
Kelarutan air
CL- 0.091 mmol/cm3; Br- 0.21 mmol/cm3 dan I- 0.0013 mmol/cm3.
Tenaga pengionan
F- 1.681 kJ/mol; Cl- 1.251 kJ/mol; Br- 1,140 kJ/mol; I- 1,008 kJ/mol dan at- 890 kJ/mol.
Elektronegativiti
F- 4.0; Cl- 3.0; 2,8; I- 2,5 dan at- 2,2.
Halogen mempunyai 7 elektron di lapisan valensi mereka, oleh itu kekasaran besar mereka untuk memenangi elektron. Juga, halogen mempunyai elektronegativiti yang tinggi kerana radio atom kecil mereka dan tarikan hebat bahawa teras pada elektron Valencia mengusahakan.
Boleh melayani anda: undang -undang tindakan massaReaktiviti
Halogen sangat reaktif, yang kemudiannya akan menjelaskan ketoksikan mereka. Di samping itu, mereka mengoksidakan ejen.
Perintah kereaktifan yang berkurangan ialah: f> cl> b> i> at.
Keadaan keadaan
Oleh kerana kereaktifan mereka yang hebat, atom halogen tidak bersifat bebas, tetapi membentuk agregat atau sebagai molekul diatomik yang dikaitkan dengan ikatan kovalen.
Struktur molekul
Halogen tidak wujud sebagai atom asas, tetapi sebagai molekul diatomik. Walau bagaimanapun, mereka semua mempunyai struktur molekul linear yang sama, dan satu -satunya perbezaan terletak pada panjang pautan mereka dan dalam interaksi intermolecular mereka.
Molekul linear x-x (x2) Mereka dicirikan dengan tidak stabil, kerana kedua -dua atom sangat menarik sepasang elektron kepada mereka. Kerana? Kerana elektron luarannya mengalami beban nuklear yang sangat tinggi, zef. Zef utama, kurang akan menjadi jarak pautan x-x.
Apabila kumpulan turun, Zef menjadi lebih lemah dan kestabilan molekul ini meningkat. Oleh itu, penurunan urutan kereaktifan ialah: f2> Cl2> Br2> I2. Walau bagaimanapun, tidak sesuai untuk membandingkan ostat dengan fluorin, kerana isotop yang tidak diketahui.
Interaksi intermolecular
Sebaliknya, molekulnya tidak mempunyai momen dipole, menjadi apolar. Fakta ini bertanggungjawab untuk interaksi intermolecular yang lemah, yang satu -satunya daya laten adalah penyebaran atau London, yang berkadar dengan jisim atom dan kawasan molekul.
Dengan cara ini, molekul kecil f2 tidak mempunyai cukup massa atau elektron untuk membentuk pepejal. Tidak seperti saya2, Molekul iodin, yang tetap menjadi pepejal yang mengeluarkan wap ungu.
Bromo mewakili contoh pertengahan antara kedua -dua hujung: molekul BR2 Mereka cukup berinteraksi untuk muncul dalam keadaan cair.
The Resate, mungkin disebabkan oleh watak logamnya yang semakin meningkat, tidak hadir sendiri2 Tetapi sebagai atom ate yang membentuk pautan logam.
Mengenai warna-warnanya (kuning-kuning-kuning-mudad-negro), penjelasan yang paling sesuai adalah berdasarkan teori orbital molekul (TOM). Jarak tenaga antara orbital molekul penuh yang terakhir, dan tenaga yang lebih besar (Antienlace) yang lebih besar, dilampaui oleh penyerapan foton dengan panjang gelombang yang semakin besar dan lebih besar.
Haluros
Halogen bertindak balas untuk membentuk haluros, sama ada bukan organik atau organik. Yang paling terkenal ialah halida hidrogen: hidrogen fluorida (HF), hidrogen klorida (HCL), hidrogen bromida (HBR) dan hidrogen iodida (HI).
Semuanya dibubarkan dalam air menjana penyelesaian asid; Begitu berasid, HF dapat merendahkan sebarang bekas kaca. Di samping itu, bahan permulaan dipertimbangkan untuk sintesis asid yang sangat kuat.
Terdapat juga halida logam yang dipanggil, yang mempunyai formula kimia yang bergantung pada valencia logam. Sebagai contoh, logam alkali halida mempunyai formula MX, dan di antaranya ialah: NaCl, natrium klorida; Kbr, kalium bromida; CSF, cesium fluoride; dan lii, litium iodida.
Logam alkali, logam peralihan atau logam blok P, mempunyai formula MXn, N Menjadi beban logam positif. Oleh itu, beberapa contohnya adalah: FECL3, Ferric Trichloride; Mgbr2, magnesium bromida; Alf3, Aluminium trifluoruro; dan cui2, Cupric iodide.
Boleh melayani anda: kalium sulfat (K2SO4): Struktur, sifat, kegunaan, sintesisWalau bagaimanapun, halogen juga boleh membentuk pautan dengan atom karbon; Oleh itu, mereka boleh campur tangan dalam dunia kompleks kimia organik dan biokimia. Sebatian ini dipanggil halida organik, dan biasanya formula kimia, iaitu x mana -mana halogen.
Penggunaan/aplikasi halogen
Klorin
Dalam industri
-Bromo dan klorin digunakan dalam industri tekstil untuk meluntur dan merawat bulu, dengan itu mengelakkan pengecutan anda ketika basah.
-Ia digunakan sebagai disinfektan ditritus dan untuk penyucian air minuman dan kolam. Di samping itu, sebatian klorin digunakan dalam laundri dan dalam industri kertas.
-Cari penggunaan dalam pembuatan bateri khas dan hidrokarbon berklorin. Ia juga digunakan dalam pemprosesan daging, sayur -sayuran, ikan dan buah -buahan. Juga, klorin berfungsi sebagai ejen bakteria.
-Ia digunakan untuk membersihkan dan menolak kulit, dan meluntur selulosa. Dahulu, nitrogen trichloride digunakan sebagai pengisar dan perapi tepung.
-Gas fosfen (COCL2) Ia digunakan dalam banyak proses sintesis perindustrian, serta dalam pembuatan gas ketenteraan. Phosphane sangat toksik dan bertanggungjawab untuk banyak kematian dalam Perang Dunia I, di mana gas digunakan.
-Gas ini juga terdapat dalam insektisida dan fumigant.
-NaCl adalah garam yang sangat banyak yang digunakan untuk makanan musim dan dalam pemuliharaan lembu dan daging burung. Di samping itu, ia digunakan dalam cecair rehidrasi badan, secara lisan dan intravena.
Dalam bidang perubatan
-Atom halogen yang mengikat ubat -ubatan menjadikannya lebih lipophilic. Ini membolehkan ubat -ubatan untuk melalui membran sel yang lebih mudah dibubarkan dalam lipid yang membentuknya.
-Klorin disebarkan di pedalaman neuron sistem saraf pusat melalui saluran ionik yang dikaitkan dengan reseptor GABA neurotransmitter, dengan itu menghasilkan kesan sedatif. Ini adalah mekanisme tindakan beberapa anxiolytics.
-HCl hadir di dalam perut, di mana ia campur tangan mewujudkan persekitaran pengurangan yang nikmat pemprosesan makanan. Di samping itu, HCl mengaktifkan pepsin, enzim yang memulakan hidrolisis protein, tahap sebelum penyerapan usus bahan protein.
Yang lain
-Asid hidroklorik (HCL) digunakan dalam membersihkan bilik mandi, dalam makmal pengajaran dan penyelidikan dan dalam pelbagai industri.
-PVC (polyvinyl chloride) adalah polimer vinil klorida yang digunakan dalam pakaian, lantai untuk lantai, kabel elektrik, tiub fleksibel, paip, struktur kembung dan jubin bumbung. Di samping itu, klorin digunakan sebagai perantara dalam penjelasan bahan plastik lain.
-Klorin digunakan dalam pengekstrakan bromin.
-Metil klorida memenuhi fungsi anestetik. Ia juga digunakan dalam penjelasan polimer silikon tertentu dan dalam pengekstrakan lemak, minyak dan resin.
-Chloroform (Chcl3) adalah pelarut yang digunakan di banyak makmal, terutamanya dalam makmal kimia organik dan biokimia, dari pengajaran, kepada penyelidik.
-Dan akhirnya, berkenaan dengan klorin, trichlorethylene digunakan untuk merendahkan bahagian logam.
Bromin
-Bromo digunakan dalam proses pengekstrakan perlombongan emas dan dalam penggerudian telaga minyak dan gas. Ia digunakan sebagai pembakaran pembakaran dalam industri plastik dan gas. Bromo mengasingkan api oksigen menyebabkan ia mematikan.
Boleh melayani anda: natrium metabisulfite (Na2S2O5): Struktur, sifat, kegunaan, risiko-Ia adalah perantara dalam pembuatan cecair hidraulik, agen penyejuk dan dehumidifier dan bersedia untuk membentuk rambut. Potassium Bromide digunakan dalam pembuatan plat dan kertas fotografi.
-Potassium bromida juga digunakan sebagai antikonvulsif, tetapi disebabkan kemungkinan garam boleh menyebabkan disfungsi neurologi, penggunaannya telah dikurangkan. Di samping itu, satu lagi kegunaan umum adalah sebagai pil untuk sampel pepejal spektroskopi inframerah.
-Sebatian Bromo hadir dalam ubat -ubatan yang digunakan dalam rawatan radang paru -paru. Begitu juga, sebatian bromin dimasukkan ke dalam ubat -ubatan yang digunakan dalam ujian yang dilakukan dalam rawatan penyakit Alzheimer.
-Bromo digunakan untuk mengurangkan pencemaran merkuri di loji elektrik yang menggunakan arang batu sebagai bahan bakar. Ia juga digunakan dalam industri tekstil untuk mencipta pewarna warna yang berbeza.
-Metil brominat digunakan sebagai racun perosak untuk pengasingan tanah dan rumah, tetapi kesannya yang berbahaya terhadap ozon telah membatasi penggunaannya.
-Lampu halogen adalah pijar dan agregat sejumlah kecil bromin dan yodium membolehkan pengurangan saiz mentol.
Iodin
-Iodin campur tangan dalam fungsi kelenjar tiroid, hormon pengawalseliaan metabolisme badan. Kelenjar tiroid rahsia hormon T3 dan T4, yang melakukan tindakan mereka pada organ putih mereka. Contohnya, tindakan hormon pada otot jantung menyebabkan peningkatan tekanan darah dan kadar denyutan jantung.
-Begitu juga, iodin digunakan dalam mengenal pasti kehadiran kanji. Silver Yoduro adalah reagen yang digunakan dalam wahyu gambar.
Fluorin
-Beberapa sebatian fluorida ditambah ke pasta pergigian untuk mengelakkan penampilan karies. Derivatif fluorin hadir dalam beberapa anestetik. Dalam industri farmaseutikal mereka menggabungkan fluorida ke ubat -ubatan untuk mengkaji kemungkinan peningkatan kesannya terhadap badan.
-Asid fluorhoric digunakan untuk merakam kaca. Juga dalam pengeluaran Halons (gas pemadam api, seperti goreng). Sebatian fluorida digunakan dalam elektrolisis aluminium untuk mencapai pembersihannya.
-Lapisan antirreflejantes mengandungi sebatian fluorin. Ini digunakan dalam pembuatan skrin plasma, skrin rata dan sistem mikroelektrik. Fluorin juga terdapat dalam tanah liat yang digunakan dalam beberapa seramik.
Menyatakan semula
Dianggap bahawa Restate dapat menyumbang kepada iodin dalam pengawalan fungsi kelenjar tiroid. Juga, isotop radioaktifnya (210Pada) telah digunakan dalam kajian kanser pada tikus.
Rujukan
- Ensiklopedia kesihatan dan keselamatan di tempat kerja. Halogen dan sebatiannya. [Pdf]. Diambil daripada:
- pekerjaan.Gob.adalah
- Kimia Librettexts. Kumpulan 17: Sifat Umum Halogen. Diambil dari: chem.Libretxts.org
- Wikipedia. (2018). Halogen. Diambil dari: dalam.Wikipedia.org
- Jim Clark. (Mei 2015). Sifat atom dan fizikal unsur -unsur kumpulan 7 (halogen). Diambil dari: chemguide.co.UK
- Whitten, k. W., Davis, r. Dan., Peck, m. L. Dan Stanley, G. G. Kimia (2003), ed ke -8. Pembelajaran Cengage.
- Item. Halogen. Diambil dari: elemen.org.adalah
- Brown, Laurel. (24 April 2017). Ciri -ciri halogen. Saintifik. Pulih dari: saintifik.com

