Hibridisasi kimia

- 3143
- 820
- Anthony Breitenberg
Apakah hibridisasi kimia?
The Hibridisasi kimia Ia adalah "campuran" orbital atom, yang konsepnya diperkenalkan oleh ahli kimia Linus Pauling pada tahun 1931 untuk menampung ketidaksempurnaan teori pautan Valencia (TEV). Yang tidak sempurna? Ini adalah: geometri molekul dan pautan setara dalam molekul seperti metana (CH4).
Menurut TEV, dalam metana orbital atom C membentuk empat pautan σ dengan empat atom H. Orbitals 2p, dengan bentuk ∞ (imej yang lebih rendah) dari C berserenjang antara satu sama lain, jadi H harus dikeluarkan dari satu sama lain pada sudut 90º.

Di samping itu, orbital 2s (sfera). Walau bagaimanapun, secara eksperimen telah didapati bahawa sudut di CH4 Mereka adalah 109.5º dan, sebagai tambahan, panjang pautan C-H adalah bersamaan.
Untuk menerangkan ini, gabungan orbital atom asal mesti dipertimbangkan untuk membentuk empat orbital hibrid yang merosot (tenaga yang sama). Di sini hibridisasi kimia dimainkan. Bagaimana orbital hibrid? Ia bergantung pada orbital atom yang menghasilkannya. Mereka juga mempamerkan campuran ciri -ciri elektronik ini.
Sp3
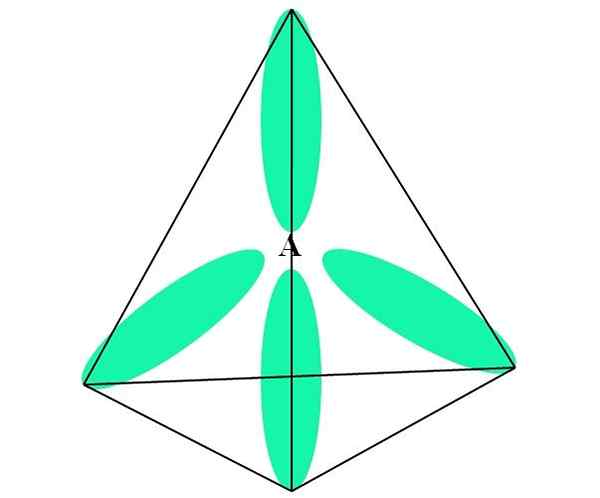
Dalam kes CH4, C hibridisasi adalah sp sp3. Dari pendekatan ini, geometri molekul dijelaskan dengan empat orbital SP3 dipisahkan pada 109.5º dan menunjuk ke arah simpul tetrahedron.
Di bahagian atas, anda dapat melihat bagaimana orbitals sp sp3 (hijau) menubuhkan persekitaran elektronik tetrahedral di sekitar atom (a, iaitu c untuk ch4).
Boleh melayani anda: AminaMengapa 109.5º dan bukan sudut lain, untuk "menarik" geometri yang berbeza? Sebabnya disebabkan oleh fakta bahawa sudut ini meminimumkan penolakan elektronik empat atom yang dikaitkan dengan.
Dengan cara ini, molekul Cho4 Ia boleh diwakili sebagai tetrahedron (geometri molekul tetrahedral).
Jika, bukannya H, C membentuk hubungan dengan kumpulan atom lain, apakah hibridisasinya? Dengan syarat bahawa karbon membentuk empat pautan σ (c-a), hibridinya akan menjadi sp3.
Secara konsisten diandaikan bahawa dalam sebatian organik lain seperti CH3Oh, CCl4, C (ch3)4, C6H12 (Cyclohexan), dll., Karbon mempunyai hibridisasi SP3.
Ini adalah penting untuk melukis struktur organik, di mana karbon dengan pautan mudah mewakili titik perbezaan; iaitu, struktur tidak kekal dalam satu satah.
Tafsiran
Apakah tafsiran paling mudah untuk orbital hibrid ini tanpa menangani aspek matematik (fungsi gelombang)? Orbitals sp3 Mereka menyiratkan bahawa mereka berasal dari empat orbital: satu s dan tiga p.
Kerana gabungan orbital atom ini sepatutnya sesuai, empat orbital SP3 Hasilnya sama dan menduduki orientasi yang berbeza di ruang angkasa (seperti dalam orbital px, pdan Dan pz).
Di atas boleh digunakan untuk selebihnya hibridasi yang mungkin: bilangan orbital hibrid yang terbentuk adalah sama dengan orbital atom yang menggabungkan. Contohnya, orbital sp híbridos3d2 Mereka dibentuk dari enam orbital atom: satu s, tiga p dan dua d.
Penyimpangan dari sudut pautan
Menurut teori penolakan pasangan elektronik lapisan Valencia (RPECV), sepasang elektron bebas menduduki lebih banyak jumlah daripada atom yang dipautkan. Ini menyebabkan pautan bergerak, mengurangkan ketegangan elektronik dan mengalihkan sudut 109.5º:
Ia boleh melayani anda: Cruise untuk Crucible: Ciri -ciri, Fungsi, Gunakan Contoh
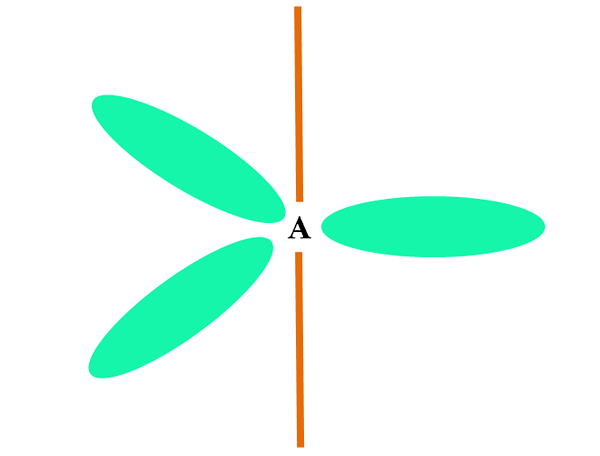
Contohnya, dalam molekul air atom H dikaitkan dengan orbitals SP3 (dalam hijau), dan juga pasangan elektron tidak dikongsi ":" menduduki orbital ini.
Penolakan pasangan elektron ini biasanya diwakili sebagai "dua belon dengan mata", yang, disebabkan oleh jumlah mereka, menangkis dua pautan σ o-h.
Oleh itu, di dalam air sudut pautan benar -benar 105º, bukannya 109.5º yang dijangka untuk geometri tetrahedral.
Apa yang dilakukan oleh geometri H kemudian2Sama ada? Mempunyai geometri sudut. Kerana? Kerana sementara geometri elektronik adalah tetrahedral, dua pasang tidak dikongsi elektron yang memutarbelitkannya ke geometri molekul sudut.
Sp2
Apabila atom menggabungkan dua atau s orbital, ia menghasilkan tiga orbital hibrid SP2; Walau bagaimanapun, P orbital (kerana terdapat tiga) kekal tidak berubah, yang diwakili sebagai bar oren di atas gambar.
Di sini, tiga orbitals sp sp2 Mereka hijau untuk menyerlahkan perbezaan mereka dari bar oren: orbital p "tulen".
Atom dengan hibridisasi SP2 Ia boleh digambarkan sebagai lantai rata trigonal (segitiga yang ditarik dengan orbital SP2 hijau), dengan simpangnya dipisahkan oleh 120º sudut dan tegak lurus ke bar.
Dan peranan apa main murni orbital? Untuk membentuk ikatan berganda (=). Orbitals sp2 Mereka membenarkan pembentukan tiga pautan σ, manakala ikatan P tulen orbital π (pautan berganda atau tiga melibatkan satu atau dua pautan π).
Sebagai contoh, untuk menarik kumpulan karbonil dan struktur molekul formaldehid (h2C = o), ia berterusan seperti berikut:
Ia boleh melayani anda: sikopropana (c3h6)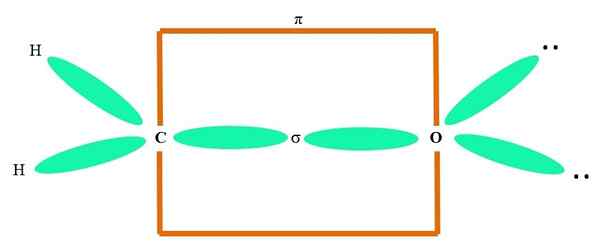
Orbitals sp2 Kedua -dua c dan o membentuk pautan σ, sementara orbital murni membentuk ikatan π (segi empat tepat oren).
Ia dapat diperhatikan bagaimana seluruh kumpulan elektronik (atom H dan pasangan elektron tidak dikongsi) terletak di orbital SP yang lain2, dipisahkan oleh 120º.
Sp
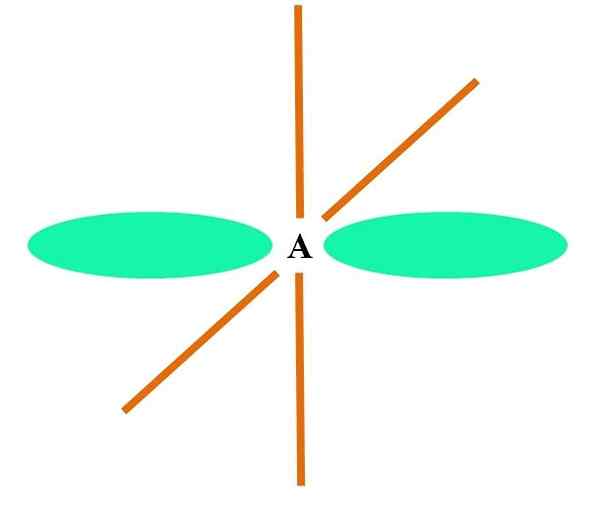
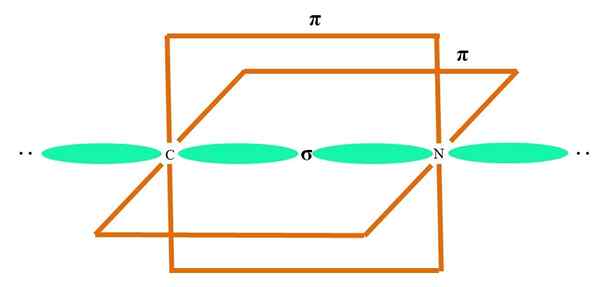
Dalam imej unggul atom digambarkan dengan hibridisasi SP. Di sini, orbital s dan orbital p. Walau bagaimanapun, dua orbital orbital tulen kini tidak berubah, yang membolehkan mereka membentuk dua pautan berganda atau pautan triple (≡).
Dengan kata lain: jika dalam struktur A c mematuhi perkara di atas (= c = o c≡C), maka hibridisasinya adalah sp sp. Untuk atom yang kurang ilustrasi lain - seperti logam peralihan - penerangan geometri elektronik dan molekul adalah rumit kerana orbitals d dan juga f juga dianggap.
Orbital hibrid dipisahkan pada sudut 180º. Atas sebab ini atom yang dipautkan disusun dalam geometri molekul linear (B-A-B). Akhirnya, dalam imej yang lebih rendah struktur anion sianida dapat dilihat: