Sejarah, struktur, sifat hidrogen dan kegunaan

- 3663
- 787
- Donnie Ryan
Dia Hidrogen Ia adalah elemen kimia yang diwakili oleh simbol h. Atomnya adalah yang terkecil dari semua dan ia adalah jadual berkala bermula, tanpa mengira di mana dia diposisikan. Ia terdiri daripada gas tidak berwarna yang terdiri daripada molekul diatomik H2, dan bukan untuk atom terpencil H; Seperti gas mulia dia, ne, ar, antara lain.
Dari semua unsur, ia mungkin yang paling lambang dan ditonjolkan, bukan hanya untuk sifatnya dalam keadaan terestrial atau drastik, tetapi untuk kelimpahan dan pelbagai sebatiannya. Hidrogen adalah gas, walaupun tidak aktif dalam ketiadaan api, mudah terbakar dan berbahaya; Semasa air, H2Atau, ia adalah pelarut sejagat dan kehidupan.
 Silinder merah digunakan untuk menyimpan hidrogen. Sumber: Famartin [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Silinder merah digunakan untuk menyimpan hidrogen. Sumber: Famartin [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Dengan sendirinya, hidrogen tidak menunjukkan keanehan visual yang sangat mengagumi, hanya menjadi gas yang disimpan dalam silinder merah atau hab. Walau bagaimanapun, mereka adalah sifat dan keupayaannya untuk menghubungkan ke semua elemen, yang kembali ke hidrogen khas. Dan semua ini, walaupun hanya mempunyai elektron dari Valencia.
Sekiranya hidrogen tidak disimpan dalam silinder masing -masing, ia akan melarikan diri dari ruang sementara sebahagian besar bertindak balas dalam pendakian. Dan walaupun ia mempunyai kepekatan yang sangat rendah di udara yang kita nafas, di luar bumi dan di seluruh alam semesta, ia adalah elemen yang paling banyak, berada di bintang -bintang dan dianggap sebagai unit pembinaannya.
Di Bumi, sebaliknya, ia mewakili kira -kira 10% daripada jumlah jisimnya. Untuk memvisualisasikan apa maksudnya, harus dipertimbangkan bahawa permukaan planet itu praktikal ditutup dengan lautan dan hidrogen yang terdapat di mineral, dalam minyak minyak dan di mana -mana sebatian organik, selain menjadi sebahagian daripada semua makhluk hidup.
Seperti karbon, semua biomolekul (karbohidrat, protein, enzim, DNA, dll.) Mereka mempunyai atom hidrogen. Oleh itu, terdapat banyak sumber untuk mengekstrak atau menghasilkannya; Walau bagaimanapun, sedikit yang mewakili kaedah pengeluaran yang sangat menguntungkan.
[TOC]
Sejarah
Pengenalpastian dan nama
Walaupun pada tahun 1671 Robert Boyle menyaksikan untuk kali pertama gas yang dibentuk apabila fail besi bertindak balas dengan asid, adalah saintis British Henry Cavendish, pada tahun 1766, yang mengenalinya sebagai bahan baru; "Udara mudah terbakar".
Cavendish mendapati bahawa apabila udara yang boleh dibakar mudah terbakar, air dihasilkan. Berdasarkan karyanya dan hasilnya, ahli kimia Perancis Antoine Lavoisier memberikan gas ini nama hidrogen pada tahun 1783. Secara etimologi maksudnya berasal dari kata -kata Yunani 'hidro' dan 'gen': formator air.
Elektrolisis dan bahan bakar
Tidak lama selepas itu, pada tahun 1800, saintis Amerika William Nicholson dan Sir Anthony Carlisle mendapati bahawa air boleh terurai ke dalam hidrogen dan oksigen; telah menemui elektrolisis air. Seterusnya, E 1838, ahli kimia Switzerland Christian Friedrich Schoenbein memperkenalkan idea untuk memanfaatkan pembakaran hidrogen untuk menjana elektrik.
Populariti hidrogen begitu banyak walaupun penulis Julio Verne merujuknya sebagai bahan bakar masa depan dalam bukunya Pulau misteri (1874).
Pengasingan
Pada tahun 1899, ahli kimia Scotland James Dewar adalah yang pertama mengasingkan hidrogen sebagai gas cecair, yang dirinya sendiri dapat menyejukkannya cukup untuk mendapatkannya dalam fasa pepejalnya.
Dua saluran
Dari sudut ini, sejarah hidrogen membentangkan dua saluran. Di satu pihak, perkembangannya dalam bidang bahan api dan bateri; Dan di sisi lain, pemahaman struktur atomnya dan bagaimana dia mewakili elemen yang membuka pintu kepada fizik kuantum.
Struktur dan konfigurasi elektronik
 Molekul hidrogen diatomik. Sumber: Benjah-bmm27 [domain awam]
Molekul hidrogen diatomik. Sumber: Benjah-bmm27 [domain awam] Atom hidrogen sangat kecil dan hampir tidak mempunyai elektron untuk membentuk ikatan kovalen. Apabila dua atom ini bersatu, mereka menimbulkan molekul diatom, h2; Ini adalah hidrogen molekul gas (imej unggul). Setiap sfera putih sepadan dengan atom H individu, dan sfera global untuk orbital molekul.
Oleh itu, hidrogen benar -benar terdiri daripada molekul H2 Sangat kecil yang berinteraksi melalui daya penyebaran London, kerana mereka tidak mempunyai momen dipole untuk menjadi homonuklear. Oleh itu, mereka sangat "gelisah" dan tersebar dengan cepat di ruang angkasa kerana tidak ada kekuatan intermolecular yang kuat untuk melambatkannya.
Konfigurasi Hidrogen Elektronik hanya 1s1. Orbital ini, 1s, adalah produk resolusi persamaan Schrödinger yang terkenal untuk atom hidrogenoid. Dalam h2 Dua orbital 1s bertindih untuk membentuk dua orbital molekul: salah satu pautan dan satu lagi Antienlace, menurut teori orbit molekul (TOM).
Orbital ini membolehkan atau menjelaskan kewujudan ion h2+ atau h2-; Walau bagaimanapun, kimia hidrogen ditakrifkan dalam keadaan normal oleh h2 atau ion h+ atau h-.
Nombor pengoksidaan
Dari konfigurasi elektronik untuk hidrogen, 1s1, Ia sangat mudah untuk meramalkan kemungkinan nombor pengoksidaannya; Sudah tentu, sudah tentu, bahawa 2s orbital tenaga yang lebih besar tidak tersedia untuk pautan kimia. Oleh itu, dalam keadaan basal, hidrogen mempunyai bilangan pengoksidaan 0, h0.
Ia boleh melayani anda: Nikel hidroksida (ii): Struktur, sifat, kegunaan, risikoSekiranya anda kehilangan satu -satunya elektron, orbital 1s kosong dan kation atau ion hidrogen terbentuk, h+, pergerakan yang hebat dalam hampir semua medium cecair; terutamanya air. Dalam kes ini nombor pengoksidaannya ialah +1.
Dan apabila sebaliknya berlaku, iaitu, memenangi elektron, orbital kini akan mempunyai dua elektron dan akan menjadi 1s2. Kemudian nombor pengoksidaan adalah -1, dan sepadan dengan anion hidrida, h-. Perlu diingat bahawa h- Dia adalah isolektronik kepada gas helium mulia, dia; iaitu, kedua -dua spesies mempunyai bilangan elektron yang sama.
Ringkasnya, nombor pengoksidaan hidrogen adalah: +1, 0 dan -1 dan molekul H2 tuduhan seolah -olah mereka mempunyai dua atom hidrogen h0.
Fasa
Fasa kegemaran hidrogen, sekurang -kurangnya dalam keadaan terestrial, adalah soda, disebabkan oleh sebab -sebab yang dinyatakan sebelum ini. Walau bagaimanapun, apabila suhu berkurang mengikut urutan -200 ºC, atau jika tekanan meningkat beratus -ratus ribu kali daripada atmosfera, hidrogen boleh mengekang atau mengkristal dalam fasa cecair atau pepejal, masing -masing.
Di bawah syarat -syarat ini, molekul h2 Mereka dapat menyelaraskan dengan cara yang berbeza untuk menentukan corak struktur. Pasukan penyebaran London kini menjadi sangat berarah dan, oleh itu, geometri atau simetri yang diterima pakai oleh rakan sebaya muncul2.
Sebagai contoh, dua hsses h2, Ia seperti menulis (h2)2 Tentukan persegi simetri atau asimetrik. Sementara itu, tiga pasang h2, atau (h2)3 Mereka menentukan segi enam, sangat serupa dengan karbon dalam kristal grafit. Malah, fasa heksagon ini adalah yang utama atau paling stabil untuk hidrogen pepejal.
Tetapi bagaimana jika pepejal itu tidak terdiri daripada molekul tetapi H? Kemudian kami akan berurusan dengan hidrogen logam. Atom H ini, mengingati sfera putih, dapat menentukan fasa cecair dan pepejal logam.
Sifat
Penampilan fizikal
Hidrogen adalah gas yang tidak berwarna, tidak berbau dan tidak enak. Oleh itu, jika terdapat kebocoran mewakili risiko letupan.
Takat didih
-253 ºC.
Takat lebur
-259 ºC.
Titik pencucuhan dan kestabilan
Secara praktikalnya ia meletup pada suhu mana -mana jika terdapat percikan atau sumber haba yang dekat dengan gas, walaupun cahaya matahari dapat menyalakan hidrogen. Walau bagaimanapun, selagi ia disimpan dengan baik, ia adalah sedikit gas reaktif.
Ketumpatan
0.082 g/l. Adalah 14 kali lebih ringan daripada udara.
Kelarutan
1.62 mg/l pada 21 ºC di dalam air. Ia adalah, secara umum, tidak larut dalam kebanyakan cecair.
Tekanan wap
1.24 · 106 mmHg pada 25 ºC. Nilai ini memberi idea bagaimana menutup silinder hidrogen mestilah untuk mengelakkan gas melarikan diri.
Suhu sendiri
560VºC.
Elektronegativiti
2.20 pada skala Pauling.
Haba pembakaran
-285.8 kJ/mol.
Haba pengewapan
0.90 kJ/mol.
Haba Fusion
0.117 kJ/mol.
Isotop
Atom hidrogen "biasa" adalah protio, 1H, yang merupakan sekitar 99.985% hidrogen. Dua isotop yang lain untuk elemen ini adalah deuterium, 2H, dan tritium, 3H. Ini berbeza dalam bilangan neutron; Deuterium mempunyai neutron, sementara Tritio mempunyai dua.
Isomer duri
Terdapat dua jenis hidrogen molekul, h2: Ortho dan untuk. Pada yang pertama dua putaran (proton) atom H berorientasikan ke arah yang sama (mereka selari); Semasa di tempat kedua, kedua -dua putaran berada dalam arah yang bertentangan (mereka antiparallel).
Hidrogen-untuk adalah yang paling stabil dari dua isomer; Tetapi dengan meningkatkan suhu, hubungan ortho: menjadi 3: 1, yang bermaksud bahawa isomer hidrogen-organ mendominasi di atas yang lain. Pada suhu yang sangat rendah (jauh dekat dengan sifar mutlak, 20k), hidrogen tulen-untuk.
Nomenclature
Nomenclature untuk merujuk kepada hidrogen adalah salah satu yang paling mudah; Walaupun ia tidak sama dengan sebatian bukan organik atau organik mereka. H2 Ia boleh dipanggil dengan nama -nama berikut selain 'hidrogen':
-Hidrogen molekul
-Dihydrogen
-Molekul hidrogen diatomik.
Untuk ion h+ Nama mereka adalah proton atau ion hidrogen; Dan jika ia berada dalam medium berair, h3Sama ada+, Kation hidronium. Sementara ion h- Ia adalah anion hidrida.
Atom hidrogen
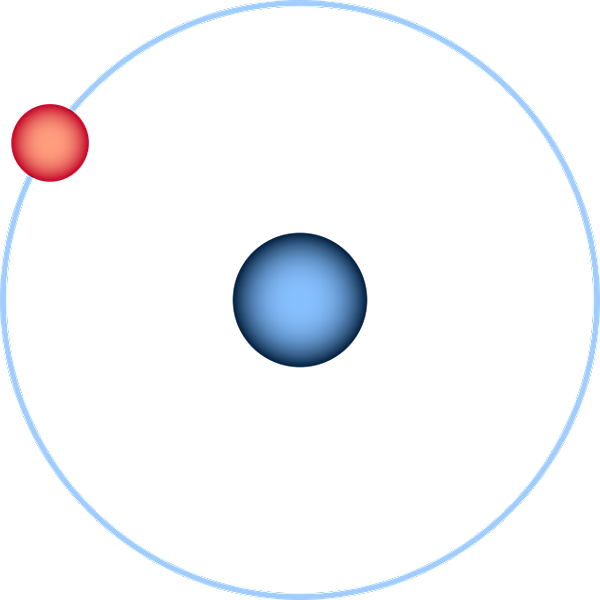 Atom hidrogen yang diwakili melalui model planet Bohr. Sumber: Pixabay.
Atom hidrogen yang diwakili melalui model planet Bohr. Sumber: Pixabay. Atom hidrogen adalah yang paling mudah dari semua dan biasanya diwakili seperti dalam imej unggul: nukleus dengan proton kesepian (untuk 1H), dikelilingi oleh elektron yang menarik orbit. Pada atom ini semua orbital atom untuk unsur -unsur lain dalam jadual berkala telah dibina dan dianggarkan.
Perwakilan yang lebih setia kepada pemahaman semasa atom akan menjadi sfera yang pinggirnya ditakrifkan oleh awan elektronik dan probabilistik elektron (orbital 1s).
Boleh melayani anda: termal: struktur, ciri, pembentukan, contohDi mana dan pengeluaran
 Bidang Bintang: Sumber hidrogen yang tidak habis -habisnya. Sumber: Pixabay.
Bidang Bintang: Sumber hidrogen yang tidak habis -habisnya. Sumber: Pixabay. Hidrogen adalah, walaupun mungkin lebih rendah berbanding dengan karbon, elemen kimia yang boleh dikatakan tanpa keraguan yang ada di mana -mana; Di udara, sebagai tambahan kepada air yang mengisi lautan, lautan dan badan kita, dalam minyak mentah dan mineral, serta dalam sebatian organik yang dipasang untuk berasal dari kehidupan.
Sudah cukup untuk melihat secara dangkal di mana -mana kedai buku kompaun untuk mencari atom hidrogen di dalamnya.
Persoalannya tidak banyak berlaku tetapi bagaimana ia hadir. Contohnya, molekul m2 Ia sangat tidak menentu dan reaktif di bawah kejadian sinar solar, yang sangat jarang berlaku di atmosfera; Oleh itu, ia bertindak balas untuk menyertai unsur -unsur lain dan dengan itu mendapat kestabilan.
Semasa di atas, dalam kosmos, hidrogen kebanyakannya sebagai atom neutral, h, h.
Malah, hidrogen dianggap, dalam fasa logam dan pekatnya, seperti unit pembinaan bintang. Apabila terdapat jumlah yang tidak dapat diukur dari mereka dan, disebabkan oleh keteguhan dan dimensi yang besar, mereka menjadikan elemen ini yang paling banyak dari seluruh alam semesta. Dianggarkan bahawa 75% bahan yang diketahui sepadan dengan atom hidrogen.
Semulajadi
Kumpulkan atom -atom hidrogen longgar di ruang angkasa tidak berubah dan mengeluarkannya dari pinggir matahari, atau yang samar -samar, tidak dapat dicapai. Di bumi, di mana keadaannya memaksa elemen ini wujud sebagai h2, Ia boleh berlaku melalui proses semula jadi atau geologi.
Sebagai contoh, hidrogen mempunyai kitaran semula jadi di mana bakteria, mikrob dan alga tertentu dapat menghasilkannya melalui reaksi fotokimia. Peningkatan proses semula jadi dan persamaan dengan ini termasuk penggunaan bioreactor, di mana bakteria memakan hidrokarbon untuk melepaskan hidrogen yang terkandung di dalamnya.
Makhluk hidup juga pengeluar hidrogen, tetapi pada tahap yang lebih rendah. Jika ya, ia tidak dapat dijelaskan bagaimana salah satu daripada komponen -komponen kebun -kebutuhan yang membentuk; yang telah menunjukkan secara berlebihan bahawa mereka mudah terbakar.
Akhirnya, patut disebutkan bahawa dalam keadaan anaerobik (tanpa oksigen), contohnya dalam lapisan bawah tanah, mineral perlahan -lahan boleh bertindak balas dengan air untuk menghasilkan hidrogen. Reaksi Fayelita menunjukkannya:
3fe2SIO4 + 2 jam2O → 2 iman3Sama ada4 + 3 sio2 + 3 jam2
Perindustrian
Walaupun Biohydrogen adalah alternatif untuk menjana gas ini pada skala perindustrian, kaedah yang paling banyak digunakan adalah praktikal "untuk" mengambil "hidrogen ke sebatian yang mengandungi, supaya atom mereka bergabung bersama dan membentuk H2.
Kaedah -kaedah alam sekitar yang paling sedikit untuk menghasilkannya terdiri daripada bertindak balas dengan kok (atau arang) dengan wap air yang terlalu panas:
C (s) + h2O (g) → co (g) + h2(g)
Begitu juga, gas asli telah digunakan untuk tujuan ini:
Ch4(g) + h2O (g) → co (g) + 3h2(g)
Dan kerana jumlah kok atau gas asli luas, ia menguntungkan untuk menghasilkan hidrogen oleh kedua -dua reaksi ini.
Kaedah lain untuk mendapatkan hidrogen adalah menggunakan kejutan elektrik ke air untuk mengurai di bahagian rendahnya (elektrolisis):
2 jam2Atau (l) → 2 jam2(g) + atau2(g)
Di makmal
Di mana -mana makmal, hidrogen molekul boleh disediakan dalam kuantiti yang kecil. Untuk melakukan ini, logam aktif harus bertindak balas dengan asid yang kuat, sama ada dalam bikar atau dalam tiub ujian. Gelembung yang dapat dilihat adalah tanda pembentukan hidrogen yang jelas, yang diwakili oleh persamaan umum berikut:
M (s) + nh+(Ac) → mn+(Ac) + h2(g)
Di mana n adalah valencia logam. Oleh itu, sebagai contoh, magnesium bertindak balas dengan h+ Untuk menghasilkan h2:
Mg (s) + 2h+(Ac) → mg2+(Ac) + h2(g)
Reaksi
Rédox
Nombor pengoksidaan sendiri menawarkan pendekatan pertama bagaimana hidrogen mengambil bahagian dalam reaksi kimia. H2 Apabila bertindak balas, ia boleh kekal tidak berubah, atau membahagikan ion h+ atau h- bergantung kepada spesies yang dihubungkan; Sekiranya mereka lebih kurang elektronegatif daripada dia.
H2 Ia sedikit reaktif kerana kekuatan ikatan kovalennya, H-H; Walau bagaimanapun, ini bukan halangan mutlak untuk bertindak balas dan membentuk sebatian dengan hampir semua elemen jadual berkala.
Reaksi yang paling terkenal adalah dengan gas oksigen untuk menghasilkan wap air:
H2(g) + atau2(g) → 2h2O (g)
Dan ia adalah pertalian untuk oksigen untuk membentuk molekul air yang stabil, yang bahkan dapat bertindak balas dengannya sebagai anion atau2- Dalam oksida logam tertentu:
H2(g) + cuo (s) → cu (s) + h2Atau (l)
Juga oksida perak bertindak balas atau "mengurangkan" dengan tindak balas yang sama:
H2(g) + Aug (s) → Ag (s) + h2Atau (l)
Reaksi hidrogen ini sesuai dengan jenis Rédox. Iaitu pengurangan-pengoksidaan. Hidrogen mengoksidakan kedua -duanya dengan kehadiran oksigen dan oksida logam kurang logam reaktif daripada dia; Contohnya, tembaga, perak, tungsten, merkuri dan emas.
Penyerapan
Sesetengah logam boleh menyerap hidrogen gas untuk membentuk hidror logam, yang dianggap seolah -olah mereka adalah aloi. Contohnya, logam peralihan seperti paladium menyerap jumlah H yang terkenal2, sama dengan span logam.
Boleh melayani anda: Neodymium: struktur, sifat, kegunaanPerkara yang sama berlaku dengan aloi logam yang lebih kompleks. Dengan cara ini hidrogen dapat disimpan dengan cara lain sebagai tambahan kepada silindernya.
Tambahan
Molekul organik juga boleh "menyerap" hidrogen melalui mekanisme molekul dan/atau interaksi yang berbeza.
Untuk logam, m molekul2 Mereka dikelilingi oleh atom logam di dalam kristal mereka; Semasa dalam molekul organik, ikatan H-H dipecahkan untuk membentuk ikatan kovalen lain. Dalam erti kata yang lebih formal: hidrogen tidak diserap, tetapi ditambah ke struktur.
Contoh klasik adalah penambahan h2 untuk menggandakan atau tiga pautan alkena atau alkin, masing -masing:
C = c + h2 → H-C-C-H
C≡C + H2 → HC = CH
Reaksi ini juga diberikan nama hidrogenasi.
Pembentukan Hydros
Hidrogen bertindak balas secara langsung kepada unsur -unsur untuk membentuk keluarga sebatian kimia yang disebut hidros. Terdapat dua jenis: salinos dan molekul.
Terdapat juga hidror logam, yang terdiri daripada aloi logam yang telah disebutkan apabila logam ini menyerap hidrogen gas; dan polimer, dengan rangkaian atau rantai ikatan E-H, di mana ia menandakan elemen kimia.
Salinos
Dalam hidror salin, hidrogen mengambil bahagian dalam ikatan ionik seperti anion hidrida, h, h-. Untuk ini, elemen mestilah kurang elektronegatif; Jika tidak, ia tidak akan melepaskan elektronnya kepada hidrogen.
Oleh itu, hidros salin hanya terbentuk apabila hidrogen bertindak balas dengan logam elektropositif yang sangat, seperti alkali dan alkaliner.
Sebagai contoh, hidrogen bertindak balas dengan natrium logam untuk menghasilkan natrium hidrida:
2NA (s) + h2(g) → 2nah (s)
Atau dengan barium untuk menghasilkan barium hidrida:
BA (s) + h2(g) → Bah2(S)
Molekul
Hidrid molekul lebih dikenali daripada ionik. Mereka juga menerima nama hidrogen halogenuros, HX, apabila hidrogen bertindak balas dengan halogen:
Cl2(g) + h2(g) → 2hcl (g)
Di sini hidrogen mengambil bahagian dalam ikatan kovalen sebagai h+; Oleh kerana, perbezaan antara elektronegativiti antara kedua -dua atom tidak begitu besar.
Air yang sama boleh dianggap sebagai hidrida oksigen (atau hidrogen oksida), yang reaksi pembentukannya sudah terdedah. Sangat serupa adalah tindak balas dengan sulfur untuk memberikan hidrogen sulfida, gas berbau:
S (s) + h2(g) → h2S (g)
Tetapi semua hidror molekul yang paling terkenal (dan mungkin yang paling sukar untuk disintesis) adalah ammonia:
N2(g) + 3h2(g) → 2nh3(g)
Aplikasi
Di bahagian sebelumnya, salah satu penggunaan utama hidrogen telah ditangani: sebagai bahan mentah untuk pembangunan sintesis, bukan organik atau organik. Mengawal gas ini biasanya mempunyai tujuan lain daripada menjadikannya bertindak balas untuk mewujudkan sebatian lain yang berbeza daripada yang diekstrak.
Bahan mentah
- Ia adalah salah satu reagen untuk sintesis ammonia, yang pada gilirannya mempunyai aplikasi perindustrian yang tidak berkesudahan, bermula dengan penghuraian baja, sehingga sebagai bahan untuk ubat nitrogenar.
- Ia bertujuan untuk bertindak balas dengan karbon monoksida dan dengan itu menghasilkan metanol, reagen yang tinggi dalam biofuel.
Mengurangkan ejen
- Ia adalah ejen pengurangan oksida logam tertentu, jadi ia digunakan dalam pengurangan metalurgi (sudah dijelaskan dalam kes tembaga dan logam lain).
- Mengurangkan lemak atau minyak untuk menghasilkan marjerin.
Industri minyak
Dalam industri minyak, hidrogen digunakan untuk "hydrotratar" minyak mentah dalam proses penghalusan.
Sebagai contoh, ia bertujuan untuk memecahkan molekul besar dan berat dalam molekul kecil dan dengan permintaan yang lebih besar di pasaran (Hydrocracheus); Melepaskan logam yang terperangkap dalam sangkar petroporfirine (hidrodesmetalization); Hilangkan atom sulfur sebagai h2S (hidrodesulfurisasi); atau mengurangkan pautan berganda untuk mencipta campuran yang kaya di parafin.
Bahan api
Hidrogen sendiri adalah bahan bakar yang sangat baik untuk roket atau kapal angkasa, kerana sedikitnya bertindak balas dengan oksigen, mereka melepaskan sejumlah besar haba atau tenaga.
Pada skala yang lebih kecil, tindak balas ini digunakan untuk reka bentuk sel atau bateri hidrogen. Walau bagaimanapun, sel -sel ini menghadapi kesukaran untuk tidak dapat menyimpan gas ini dengan betul; dan cabaran sepenuhnya bebas daripada membakar bahan api fosil.
Di sisi positif, digunakan sebagai bahan bakar, hidrogen hanya mengeluarkan air; Daripada gas yang mewakili cara pencemaran untuk atmosfera dan ekosistem.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Hanyu Liu, Li Zhu, Wenwen Cui dan Yanming Ma. (s.F.). Struktur suhu bilik hidrogen pepejal pada tekanan tinggi. Makmal Utama Negeri Superhard Bahan, Jilin University, Changchun 130012, China.
- Pierre-Marie Robitaille. (2011). Hidrogen Metalik Cecair: Blok Bangunan untuk Matahari Cecair. Jabatan Radiologi, Universiti Negeri Ohio, 395 W. 12th Ave, Columbus, Ohio 43210, Amerika Syarikat.
- Kumpulan Bodner. (s.F.). Kimia Hidrogen. Diperolehi daripada: Chemed.Chem.Purdue.Edu
- Wikipedia. (2019). Hidrogen. Diperoleh dari: dalam.Wikipedia.org
- Hidrogen Eropah. (2017). Aplikasi hidrogen. Pulih dari: hydrogeneurope.EU
- Foist Laura. (2019). Hidrogen: sifat & kejadian. Kajian. Pulih dari: belajar.com
- Jonas James. (4 Januari 2009). Sejarah hidrogen. Diperolehi dari: Altenergymag.com

