Struktur, ALH3) Aluminium (ALH3) Struktur, Harta, Kegunaan
- 2820
- 89
- Clarence Greenholt DDS
Dia Aluminium hydride Ia adalah sebatian bukan organik yang formula kimia adalah alh3. Walaupun nampaknya bersifat sederhana, ia sebenarnya adalah bahan yang agak rumit. Kerana kecerahan kristal yang boleh berlaku dalam pepejalnya, biasanya diambil sebagai hidrida ionik, dibentuk oleh ion ke3+ dan h-.
Walau bagaimanapun, sifatnya menunjukkan sebaliknya: ia adalah pepejal polimer, yang perwakilan yang paling setia akan menjadi jenis (ALH3)n, menjadi n Bilangan unit monomerik ALH3 yang akan mengintegrasikan rantai kaca atau lapisan. Oleh itu, ALH3 Ia adalah salah satu polimer yang berjaya mengamalkan struktur kristal.
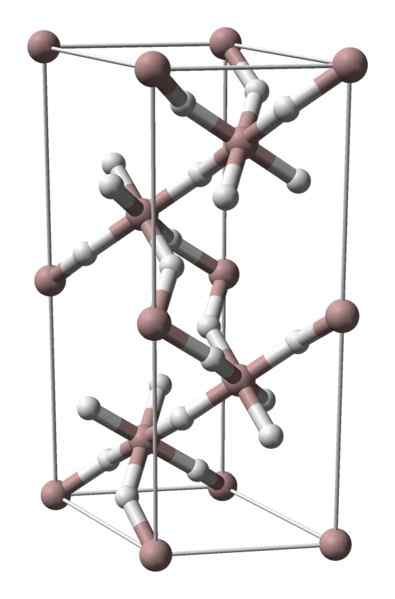 Struktur kristal hidrida aluminium. Sumber: Benjah-bmm27 / domain awam
Struktur kristal hidrida aluminium. Sumber: Benjah-bmm27 / domain awam Aluminium hydride tidak pepejal dengan banyak penyebaran komersial, jadi imej yang ada adalah langka. Ia terutamanya digunakan untuk sintesis organik, di mana ia berfungsi sebagai ejen pengurangan yang kuat. Ia juga menduduki tempat yang istimewa dalam pendahuluan teknologi bahan, menjadi alternatif yang menjanjikan untuk penyimpanan hidrogen.
Kompaun ini, juga dikenali sebagai Alano, mengekalkan hubungan rapat dengan Lialh4, Nama -namanya adalah aluminium dan litium hidrida, litium alanate, atau lithium tetrahydroalumination. Walaupun ia mempunyai ciri -ciri polimer dan metastabiliti terma, ia berlaku dalam tujuh polimorf dengan morfologi kristal yang berbeza.
[TOC]
Struktur
Koordinasi
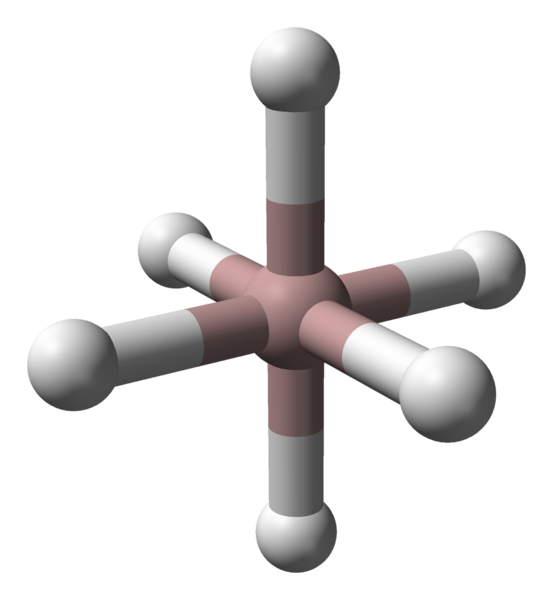
 Koordinasi Octahedral Kation Aluminium di Kristal ALH3. Sumber: Benjah-bmm27 / domain awam.
Koordinasi Octahedral Kation Aluminium di Kristal ALH3. Sumber: Benjah-bmm27 / domain awam. Tidak kira polimorf atau fasa kristal yang dipertimbangkan, koordinasi antara atom aluminium dan hidrogen adalah malar. Dalam imej atas, sebagai contoh, seperti dalam imej pertama, octahedron koordinasi untuk atom aluminium (sfera coklat) ditunjukkan dalam imej pertama.
Boleh melayani anda: Undang -undang stoikiometriSetiap atom dikelilingi oleh enam jam, mewujudkan enam pautan AL-H. Cara di mana octahedra berorientasikan di ruang angkasa akan membuat perbezaan struktur antara satu polimorf dan yang lain.
Sebaliknya, setiap atom H diselaraskan dengan dua atom AL, mewujudkan ikatan Al-H-Al, yang boleh dibenarkan oleh pautan jenis 3C2E (3 pusat-2 elektron). Pautan ini bertanggungjawab untuk menyertai beberapa octaedros alh6 di seluruh Alano Crystal.
Molekul terpencil
Alh3 Ia dianggap polimer kerana rangkaian ALH6 yang mengintegrasikan kaca. Untuk mengasingkan molekul Alano individu, perlu menggunakan tekanan rendah dalam suasana gas mulia yang tidak aktif. Dengan cara ini, polimer memecahkan dan melepaskan molekul ALH3 geometri rata trigonal (sama dengan BH3).
Sebaliknya, ada kemungkinan untuk mengurangkan dua alh3 untuk membentuk a2H6, Seperti Diborano, b2H6. Walau bagaimanapun, untuk mencapai matlamat ini, penggunaan hidrogen pepejal diperlukan, jadi ia mungkin tidak mempunyai banyak nilai perindustrian atau komersial panjang.
Polymorphs
Alano atau Alh3 Ia dapat membentuk sehingga tujuh polimorf: α, α ', β, γ, δ, ε dan ζ, yang mana α adalah yang paling stabil untuk perubahan suhu. Α-alh3 Ia dibezakan dengan mempunyai morfologi padu dan struktur kristal heksagon. Ia cenderung menjadi produk di mana polimorf lain berubah apabila mereka mengalami ketidakstabilan haba.
Morfologi γ-alh3, Sebaliknya, ia menonjol untuk menjadi jenis jarum. Itulah sebabnya ALH3 pepejal boleh mengandungi campuran lebih daripada dua polimorf, dan kristal yang berbeza -beza ke mikroskop.
Sifat
Penampilan fizikal
Aluminium hidrida adalah penampilan pepejal yang tidak berwarna atau putih, dengan kecenderungan untuk menunjukkan bentuk jarum.
Boleh melayani anda: asid sulfonik: struktur, nomenclature, sifat, kegunaanJisim molar
29.99 g/mol o 30 g/mol
Takat lebur
150 ºC. Tetapi ia mula pecah dari 105 ° C.
Kelarutan air
Tinggi, kemudian bertindak balas dengannya.
Kelarutan
Tidak larut dalam pelarut diethyléter dan apolar seperti benzena dan pentan. Bertindak balas dengan alkohol dan pelarut kutub yang lain.
Penguraian
Alh3 Ia terdedah kepada penguraian pada kelajuan yang berbeza bergantung kepada keadaan luaran, morfologi dan kestabilan terma kristal mereka, atau penggunaan pemangkin. Apabila ia berlaku, ia mengeluarkan hidrogen dan berubah menjadi aluminium logam:
2alh3 → 2al + 3h2
Malah, penguraian ini dan bukannya menjadi masalah, mewakili salah satu sebab mengapa Alano dianggap menarik dalam pembangunan teknologi tenaga baru.
Pembentukan tambahan
Apabila ALH3 Ia tidak bertindak balas dengan pelarut yang tidak dapat dipulihkan, ia menetapkan penambahan dengannya, iaitu sejenis kompleks. Sebagai contoh, anda boleh membentuk kompleks dengan trimethylamine, ALH3· 2n (CHO3)3, Dengan Tetrahydrofurano, ALH3· THF, atau dengan dietileter, ALH3· ET2Sama ada. Yang terakhir adalah yang paling terkenal ketika sintesis atau memperoleh Alano diperkenalkan pada tahun 1947.
Memperoleh
Penampilan pertama alh3 Mereka kembali ke tahun 1942 dan 1947, sebagai tahun lepas ketika sintesisnya dibentangkan menggunakan Lialh4 Dalam medium dietil:
3Lialh4 + ALCL3+ nEt2O → 4alh3 · nEt2O + 3licl
Penyelesaian Ethereal, ALH3 · nEt2Atau, dia terpaksa mengemukakan mengecewakan, dengan tujuan menghapuskan ET2Atau Dapatkan ALH3 Murni. Sebagai tambahan kepada masalah ini, LICL harus dihapuskan dari medium produk.
Oleh itu, dari tahun 1950 hingga 1977, sintesis baru direka untuk mendapatkan hasil alh yang lebih baik3, serta pepejal yang paling murni dan sifat terma dan morfologi yang lebih baik. Mengubah jumlah, langkah dan instrumen yang digunakan, adalah mungkin untuk memihak kepada polimorf di atas yang lain. Walau bagaimanapun, α-alh3 Biasanya produk majoriti.
Ia boleh melayani anda: Alilo: Unit Allyic, Carbocation, Radikal, ContohKaedah sintesis lain terdiri daripada penggunaan elektrokimia. Untuk melakukan ini, anod aluminium dan katod platinum digunakan. Dalam anod reaksi berikut berlalu:
3alh4- + Kepada3+ + nTHF → 4Alh3 · nTHF + 3E-
Semasa di natrium logam katod diperoleh. Kemudian ALH3 · nTHF juga mengalami kekecewaan untuk menghapuskan THF dan akhirnya mendapatkan ALH3.
Aplikasi
Mengurangkan ejen
Alh3 Ia berfungsi untuk mengurangkan kumpulan fungsi tertentu sebatian organik seperti asid karboksilik, keton, aldehid dan ester. Secara praktikal, apa yang dilakukannya ialah menambah hidrogen. Sebagai contoh, ster boleh dikurangkan kepada alkohol dengan kehadiran kumpulan nitro:
 Pengurangan ster dengan aluminium hidrida. Sumber: Halia / Domain Awam.
Pengurangan ster dengan aluminium hidrida. Sumber: Halia / Domain Awam. Takungan hidrogen
Aluminium Hydride mewakili alternatif untuk berfungsi sebagai takungan hidrogen, dan dengan itu, dapat mengeluarkannya secara mudah alih dalam peranti yang beroperasi dengan bateri hidrogen. Jumlah yang diperoleh dari h2 sesuai dengan jumlah yang lebih besar daripada dua daripada ALH3.
Mempunyai ALH3, dan menguraikannya dikawal, jumlah h yang diinginkan dapat dikeluarkan2 bila -bila masa. Oleh itu, ia boleh digunakan sebagai bahan bakar roket dan semua aplikasi tenaga yang berusaha memanfaatkan pembakaran hidrogen.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2020). Aluminium hidrida. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2020). Aluminium hidrida. Pangkalan data PUBCHEM., CID = 14488. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- J. Graetz et al. (2011). Aluminium hidrida sebagai bahan penyimpanan hidrogen dan tenaga: masa lalu, sekarang dan masa depan. Elsevier b.V.
- Xu Bo et al. (2014). Penyediaan dan sifat termal polimorf hidrida pelajar. doi.org/10.1016/j.Vakum.2013.05.009
- « Konsep variasi linear, contoh, latihan diselesaikan
- Bentuk bumi dan akibat fizikal dan astronominya »

