Struktur hidroksida aluminium, sifat, kegunaan, risiko
- 4524
- 506
- Ms. Micheal Rippin
Dia Aluminium hidroksida Ia adalah sebatian bukan organik yang formula kimia di (oh)3. Tidak seperti hidroksida logam lain, ia adalah satu amphotero, yang mampu bertindak balas atau berkelakuan seperti asid atau asas, bergantung pada medium. Ia adalah pepejal putih yang tidak larut di dalam air, jadi ia dapat digunakan sebagai komponen antacid.
Seperti mg (oh)2 atau brucita, yang mana ia berkongsi ciri -ciri kimia dan fizikal tertentu, semata -mata kelihatan seperti pepejal amorf dan bersinar; Tetapi apabila mengkristal dengan beberapa kekotoran memperoleh bentuk kristal seolah -olah mereka adalah mutiara. Di antara mineral ini, sumber semula jadi Al (OH)3, adalah Gibbsita.
 Khas Gibbsita Crystal. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)]
Khas Gibbsita Crystal. Sumber: Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)] Sebagai tambahan kepada gibbsite juga mineral bayerite, nordstrandite dan doleyíta, membentuk empat polimorf hidroksida aluminium. Secara strukturnya, mereka sangat serupa antara satu sama lain, membezakan antara satu sama lain dalam cara bagaimana lapisan atau lembaran ion terletak atau ditambah, serta jenis kekotoran yang terkandung.
Mengawal parameter pH dan sintesis, mana -mana polimorf ini boleh disediakan. Begitu juga, beberapa spesies kimia yang menarik dapat diselingi di antara lapisan mereka, sehingga bahan atau sebatian yang diselingi dibuat. Ini mewakili penggunaan lebih banyak pendekatan teknologi ke Al (OH)3. Kegunaan lain seperti antacid.
Sebaliknya, ia digunakan sebagai bahan mentah untuk mendapatkan alumina, dan nanopartikelnya telah digunakan sebagai sokongan pemangkin.
[TOC]
Struktur
Formula dan Octaedro
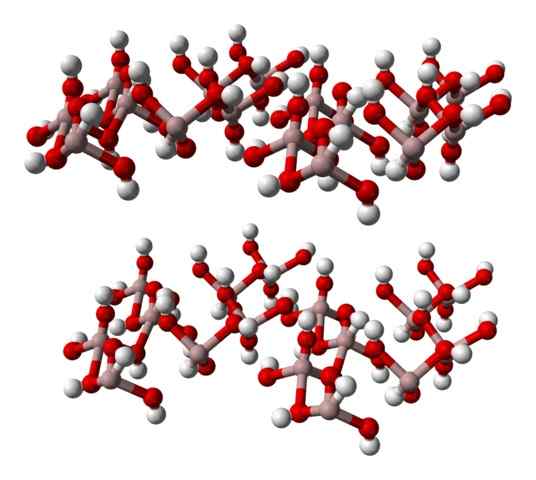
Formula Kimia di (OH)3 menunjukkan sekali hubungan dengan3+: Oh- Ia adalah 1: 3; iaitu, terdapat tiga anion oh- untuk setiap kation untuk3+, yang sama seperti mengatakan bahawa bahagian ketiga ionnya sepadan dengan aluminium. Jadi, al3+ Dan oh- Mereka berinteraksi secara elektrostatik sehingga tarikan-tarikan mereka menentukan kristal heksagon.
Walau bagaimanapun, Al3+ Ia tidak semestinya dikelilingi oleh tiga oh- tetapi enam; Oleh itu, terdapat perbincangan mengenai octahedron koordinasi, di (OH)6, di mana terdapat enam interaksi al-o. Setiap octahedron mewakili satu unit yang mana kaca dibina, dan sebilangan mereka mengamalkan struktur triklinik atau monoklinik.
Imej yang lebih rendah sebahagiannya mewakili octahedra ke (oh)6, kerana hanya empat interaksi yang diperhatikan3+ (sfera coklat muda).
 Gibbsite kaca heksagon, mineral hidroksida aluminium. Sumber: Benjah-bmm27 [domain awam].
Gibbsite kaca heksagon, mineral hidroksida aluminium. Sumber: Benjah-bmm27 [domain awam]. Jika struktur ini diperhatikan dengan teliti, yang sepadan dengan mineral gibbsite, mungkin direnungkan bahawa sfera putih mengintegrasikan "wajah" atau permukaan lapisan ion; Ini, atom hidrogen ion OH-.
Boleh melayani anda: menyewa halogenuros: sifat, mendapatkan, contohPerhatikan bahawa terdapat lapisan A dan lain B (spasial tidak sama), bersama antara satu sama lain oleh jambatan hidrogen.
Polymorphs
Lapisan A dan B tidak selalu digabungkan dengan cara yang sama, serta persekitaran fizikal mereka atau ion tetamu (garam) boleh berubah. Akibatnya, kristal Al (OH)3 Mereka berbeza dalam empat bentuk mineralogi atau, dalam kes ini, polimorfik.
Kemudian dikatakan bahawa aluminium hidroksida mempunyai sehingga empat polimorf: gibbsite atau hydragilite (monoklinik), bayerite (monoklinik), Doyleíta (tricycling) dan Nordstrandite (Trichlinic). Daripada polimorf ini, Gibbsita adalah yang paling stabil dan berlimpah; Yang lain diklasifikasikan sebagai mineral yang jarang berlaku.
Sekiranya kristal diperhatikan di mikroskop, dapat dilihat bahawa geometri mereka adalah heksagon (walaupun agak tidak teratur). PH memainkan peranan penting dalam pertumbuhan kristal sedemikian dan struktur yang dihasilkan; iaitu, diberi pH polimorf atau lain -lain boleh membentuk.
Contohnya, jika medium di mana al (oh) mendahului3 Ia mempunyai pH kurang daripada 5.8 Gibbsita terbentuk; Walaupun jika pH lebih besar daripada nilai ini, bayerita terbentuk.
Dalam media yang lebih asas, kristal Nordstrandita dan Doyleíta cenderung membentuk. Oleh itu, menjadi gibbsite yang paling banyak, ia adalah fakta yang mencerminkan keasidan persekitaran cuaca.
Sifat
Penampilan fizikal
Pepejal putih yang boleh datang dalam format yang berbeza: granulated atau serbuk, dan penampilan amorf.
Jisim molar
78.00 g/mol
Ketumpatan
2.42 g/ml
Takat lebur
300 ° C. Ia tidak mempunyai titik mendidih kerana hidroksida kehilangan air untuk berubah menjadi alumina atau aluminium oksida, ke2Sama ada3.
Kelarutan air
1 · 10-4 G/100 ml. Walau bagaimanapun, kelarutannya meningkat dengan penambahan asid (h3Sama ada+) atau alkali (oh-).
Produk kelarutan
Ksp = 3 · 10-34
Nilai kecil ini bermaksud bahawa hanya bahagian kecil yang larut dalam air:
Al (oh)3(Garam3+(Ac) +3OH-(Ac)
Dan sebenarnya kelarutan yang hina ini menjadikannya neutralizer keasidan yang baik, kerana ia tidak mendasarkan persekitaran gastrik terlalu banyak kerana tidak melepaskan hampir ion oh-.
Anfoterisme
Al (oh)3 Ia dicirikan oleh watak amphoternya; iaitu, ia boleh bertindak balas atau berkelakuan seolah -olah ia adalah asid atau asas.
Contohnya, bertindak balas dengan ion h3Sama ada+ (Sekiranya medium berair) untuk membentuk acuo kompleks [ke (oh2)6]3+; yang seterusnya dihidrolisiskan untuk mengasingkan alam sekitar, oleh itu Al3+ ion asid:
Boleh melayani anda: Reaksi Cannizzaro: Ciri, Mekanisme, ContohAl (oh)3(s) +3h3Sama ada+(ac) => [al (oh2)6]3+(Ac)
[Al (oh2)6]3+(Ac) +h2Atau (l) [al (oh2)5(Oh)]2+(Ac)+h3Sama ada+(Ac)
Apabila ini berlaku, dikatakan bahawa Al (oh)3 Ia berkelakuan seperti pangkalan, kerana ia bertindak balas dengan h3Sama ada+. Sebaliknya, anda boleh bertindak balas dengan oh-, berkelakuan seperti asid:
Al (oh)3(s) +oh-(ac) => ah (oh)4-(Ac)
Dalam reaksi ini, endapan putih Al (OH)3 Ia larut kepada lebihan ion oh-; Fakta yang tidak berlaku sama dengan hidroksida lain, seperti magnesium, mg (OH)2.
Al (oh)4-, ion aluminat, ia boleh dinyatakan dengan lebih sesuai sebagai: [al (oh2)2(Oh)4]-, menonjolkan nombor koordinasi 6 untuk kation3+ (Octaedro).
Ion ini dapat terus bertindak balas dengan lebih banyak oh- Sehingga octahedron koordinasi: [Al (oh)6]3-, dipanggil hexahidroxoaluminate ion.
Nomenclature
Nama 'aluminium hidroksida', yang paling banyak merujuk kepada sebatian ini, sepadan dengan yang diperintah oleh tatanama saham. (Iii) ditinggalkan pada akhirnya, kerana status pengoksidaan aluminium adalah +3 dalam semua sebatiannya.
Dua lagi nama yang mungkin untuk dirujuk kepada Al (oh)3 Mereka adalah: aluminium trihydroxide, mengikut tatanama sistematik dan penggunaan pengangka Yunani; dan aluminium hidroksida, berakhir dengan akhiran -ico kerana mempunyai keadaan pengoksidaan tunggal.
Walaupun dalam bidang kimia, tatanama Al (OH)3 Ia tidak mewakili sebarang cabaran atau kekeliruan, di luarnya cenderung bercampur dengan kekaburan.
Sebagai contoh, Gibbsita Mineral adalah salah satu polimorf semulajadi Al (OH)3, yang mereka juga namakan sebagai γ-al (OH)3 atau α-al (OH)3. Walau bagaimanapun, α-al (OH)3 Ia juga boleh sesuai dengan mineral Bayerita, atau β-al (OH)3, Menurut tatanama kristalografi. Sementara itu, polimorf Nordstrandita dan Doyleita biasanya ditetapkan sebagai (oh)3.
Senarai berikut jelas meringkaskan yang baru dijelaskan:
-Gibbsita: (γ atau α) -al (OH)3
-Bayerita: (α atau β) -al (OH)3
-Nordstrandita: Al (oh)3
-Doyleita: Al (oh)3
Aplikasi
Bahan mentah
Penggunaan segera untuk aluminium hidroksida adalah sebagai bahan mentah untuk pengeluaran alumina atau sebatian lain, bukan organik atau organik, aluminium; Contohnya: ALCL3, Oleh tidak3)3, Alf3 atau Naal (oh)4.
Sokongan pemangkin
Al (OH) Nanopartikel3 Mereka boleh bertindak sebagai sokongan pemangkin; iaitu, pemangkin bergabung dengan mereka untuk diperbaiki di permukaan mereka, di mana tindak balas kimia dipercepatkan.
Boleh melayani anda: Reaksi Sintesis: Jenis, Faktor, ContohSebatian Antarabangsa
Di bahagian struktur ia dijelaskan bahawa Al (OH)3 Ia terdiri daripada lapisan atau lembaran A dan B, ditambah untuk menentukan kristal. Di dalamnya, terdapat ruang octahedral kecil atau lubang yang boleh diduduki oleh molekul ion lain, logam atau organik, atau neutral.
Apabila kristal disintesis dari (oh)3 Dengan pengubahsuaian struktur ini, dikatakan bahawa sebatian interkalasi sedang disediakan; iaitu, diselingi atau meletakkan spesies kimia antara lembaran a dan b. Dengan berbuat demikian, bahan baru yang dihasilkan dari hidroksida ini timbul.
Retardant api
Al (oh)3 Ia adalah pengetuk api yang baik yang mendapati permohonan sebagai bahan pengisian banyak matriks polimer. Ini kerana ia menyerap haba untuk melepaskan wap air, seperti MG (OH)2 atau brucita.
Ubat
Al (oh)3 Ia juga merupakan keasidan yang meneutralkan, bertindak balas dengan HCl rembesan gastrik; Sekali lagi, sama seperti bagaimana ia berlaku dengan mg (oh)2 susu magnesia.
Kedua -dua hidroksida boleh dicampur dalam antacid yang berbeza, digunakan untuk melegakan gejala orang yang menderita gastritis atau ulser perut.
Penyerap
Apabila ia dipanaskan di bawah titik leburnya, aluminium hidroksida diubah menjadi alumina diaktifkan (serta karbon diaktifkan). Pepejal ini digunakan sebagai penyerap molekul yang tidak diingini, sama ada pewarna, kekotoran, atau mencemarkan gas.
Risiko
Risiko yang boleh mewakili aluminium hidroksida tidak disebabkan olehnya sebagai pepejal, tetapi sebagai ubat. Tiada protokol atau peraturan diperlukan untuk menyimpannya, kerana ia tidak bertindak balas dengan bersungguh -sungguh dengan ejen pengoksidaan, dan ia tidak mudah terbakar sama ada.
Apabila ditelan dalam antacid yang dicapai dalam farmasi, kesan sampingan yang tidak diingini mungkin muncul, seperti sembelit dan perencatan usus fosfat. Juga, dan walaupun tidak ada kajian untuk menunjukkannya, ia telah dikaitkan dengan gangguan neurologi seperti penyakit Alzheimer.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Aluminium hidroksida. Diperoleh dari: dalam.Wikipedia.org
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Aluminium hidroksida. Pangkalan data PUBCHEM. CID = 10176082. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Danielle Reid. (2019). Aluminium hidroksida: Formula & Kesan Sampingan. Kajian. Pulih dari: belajar.com
- Robert Schoen & Charles dan. Roberson. (1970). Struktur aluminium hidroksida dan implikasi geokimia. Mineralogi Amerika, Vol 55.
- Vitaly p. Isupov & Col. (2000). Sintesis, struktur, sifat, dan penggunaan sebatian interkalasi hidroksida aluminium. Kimia untuk Pembangunan Lestari 8,121-127.
- Dadah. (24 Mac, 2019). Kesan sampingan hidroksida aluminium. Pulih dari: dadah.com

