Struktur, sifat, sintesis, menggunakan kromium hidroksida kromium
- 1073
- 145
- Miss Elmer Hagenes
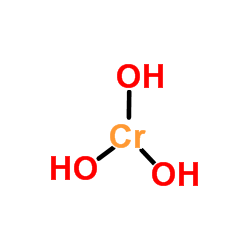
Dia Chromium hidroksida Ia adalah produk kompaun tak organik tindak balas asas dengan garam krom. Formula kimianya berbeza mengikut status pengoksidaan krom (+2 atau +3, untuk jenis sebatian ini). Dengan itu mempunyai Cr (oh)2 Untuk kromium hidroksida (II), dan Cr (OH)3 Untuk kromium hidroksida (III).
Atas sebab elektronik, CR2+ lebih tidak stabil daripada CR3+, Jadi cr (oh)2 Ia adalah ejen pengurangan (kehilangan elektron untuk bergerak ke +3). Oleh itu, walaupun kedua -dua hidroksida dapat diperoleh sebagai precipitates, Cr (OH)3 -Juga dipanggil kromik hidroksida- adalah sebatian utama.
 Penampilan Chromium Hydroxide
Penampilan Chromium Hydroxide Tidak seperti hidroksida yang diperolehi oleh pembubaran mudah oksida logam di dalam air, CR (OH)3 Ia tidak disintesis dengan laluan ini kerana kelarutan oksida kromik (CR2Sama ada3, gambar atas). Walau bagaimanapun, Cr (OH)3 Ia dianggap sebagai CR2Sama ada3· XH2Atau, digunakan sebagai pigmen hijau zamrud (guinet hijau).
Di makmal, ia berdasarkan krom logam, yang dibubarkan dalam larutan asid untuk pembentukan kompleks [CR (OH2)6]3+. Kompleks berair ini kemudian bertindak balas dengan asas (NaOH atau KOH) untuk membentuk hidroksida kromik yang sepadan.
Sekiranya langkah -langkah sebelumnya dijalankan di bawah syarat -syarat yang memastikan ketiadaan oksigen, reaksi berasal dari CR (OH)2 (Hidroksida krom). Selanjutnya pemisahan dan dehidrasi pepejal mendakan diperlukan. Akibatnya, Cr True (OH) adalah "dilahirkan"3, Serbuk hijau dengan struktur polimer dan tidak pasti.
[TOC]
Struktur kromium hidroksida
Imej atas adalah perwakilan paling mudah Cr (OH)3 dalam gas dan fasa terpencil. Juga dan mengandaikan sifat ionik semata -mata interaksi, dalam kation pepejal dapat divisualisasikan3+ berinteraksi dengan kuantiti tiga kali ganda anion-.
Boleh melayani anda: penyerap molarWalau bagaimanapun, sifat pautan CR-OH lebih kovalen, disebabkan oleh Kimia Penyelarasan CR3+.
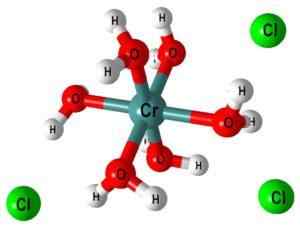
Sebagai contoh, kompleks [CR (OH2)6]3+ Ia menunjukkan bahawa pusat krom logam diselaraskan dengan enam molekul air; Oleh kerana ini adalah neutral, kompleks mempamerkan beban positif kation asal, Cr3+.
Octahedron dan pempolimeran
Di bahagian atas, struktur kompleks [CR (OH diwakili2)6]3+. Cl ion- Mereka boleh datang, sebagai contoh, dari asid hidroklorik sekiranya ia telah digunakan untuk pembubaran garam atau kromik oksida.
Apabila NaOH (atau KOH) ditambah ke medium tindak balas, OH ion- Uns a molekul kompleks ini, membentuk [cr (oh2)5(Oh)]2+ (Sekarang terdapat lima molekul air kerana keenam kehilangan proton).
Secara berturut -turut, kompleks dehidrat baru ini ke kompleks berair yang lain, mewujudkan Dímeros bersatu oleh jambatan hidroksida:
(H2Sama ada)5CR-OH-CR (OH2)5
Oleh kerana asas medium meningkat (pH naik) kompleks [CR (OH2)4(Oh)2]+, dan juga meningkatkan kebarangkalian jambatan hidroksida baru untuk membuat jeli -polimer. Sebenarnya, "jeli kelabu -kelabu" ini enggan mendakan secara teratur.
Akhirnya, Cr (oh2)3(Oh)3 Ia terdiri daripada octahedron dengan CR3+ Di tengah, dan dikaitkan dengan tiga molekul air dan tiga oh- yang meneutralkan caj positif mereka; Ini tanpa mempertimbangkan pempolimeran.
Semasa CR (oh2)3(Oh)3 Ia kering, air yang diselaraskan dengan CR dihapuskan3+, Dan kerana kation ini diselaraskan dengan enam spesies (ligan), struktur polimer timbul di mana pautan CR-CR terlibat.
Boleh melayani anda: lemak butyric: mendapatkan, jenis, komposisi, kegunaan, faedahJuga, apabila dehidrasi, strukturnya boleh dianggap sebagai jenis CR2Sama ada3· 3h2Sama ada; Dalam erti kata lain, oksida kromik yang terhidrat. Walau bagaimanapun, ia adalah kajian fizikokimia pepejal yang dapat memberi penjelasan pada struktur sebenar Cr (OH)3 Pada ketika ini.
Ciri -ciri fizikal dan kimia kromium hidroksida
CR (oh)3 Ia kelihatan seperti serbuk biru-hijau, tetapi apabila ia bersentuhan dengan air untuk membentuk jeli hijau kelabu.
Ia tidak larut di dalam air, tetapi larut dalam asid dan pangkalan yang kuat. Di samping itu, apabila dipanaskan ia rosak, menghasilkan wap oksida krom.
Anfoterisme
Mengapa Chromium Hydroxide Larut dalam Asid dan Penyelesaian Asas? Sebabnya disebabkan oleh watak amphoternya, yang membolehkan anda bertindak balas dengan kedua -dua asid dan pangkalan. Harta ini adalah ciri cr3+.
Apabila bertindak balas dengan asid, CR (OH2)3(Oh)3 Ia dibubarkan kerana jambatan hidroksil dipecahkan, bertanggungjawab untuk jellywoman dari endapan.
Sebaliknya, apabila lebih banyak pangkalan ditambah, oh- Mereka terus menggantikan molekul air, membentuk kompleks negatif [CR (OH2)2(Oh)4]-. Kompleks ini mengubah penyelesaian warna hijau muda, yang semakin meningkat apabila tindak balas berterusan.
Bila semua Cr (oh2)3(Oh)3 Anda telah bertindak balas, satu kompleks terakhir diperoleh seperti yang ditunjukkan oleh persamaan kimia:
CR (oh2)3(Oh)3 + 3 oh- [CR (OH)6] 3- + 3 jam2Sama ada
Kompleks negatif ini dikaitkan dengan kation sekitar (na+, Jika pangkalannya adalah NaOH), dan selepas penyejatan air, garam natrium kromito (NACRO2, warna hijau zamrud). Oleh itu, kedua -dua asid dan medium asas dapat membubarkan kromium hidroksida.
Boleh melayani anda: IndiaSintesis kromium hidroksida dalam bidang perindustrian
Dalam industri, ia dihasilkan oleh pemendakan sulfat krom dengan penyelesaian natrium atau hidroksida hidroksida. Begitu juga, kromium hidroksida dihasilkan oleh reaksi skema:
Cro72- + 3 Jadi2 + 2h+ => 2 cr3+ + 3 Jadi42- + H2Sama ada
Cr3+ + 3oh- => CR (oh)3
Seperti yang ditunjukkan dalam prosedur sebelumnya, pengurangan krom VI ke Chrome III mempunyai kepentingan ekologi yang besar.
Chromium III agak tidak berbahaya kepada Biota, manakala Chromium VI adalah toksik dan karsinogenik, sebagai tambahan kepada sangat larut, jadi penghapusan persekitarannya adalah penting.
Teknologi Rawatan Air dan Tanah termasuk pengurangan dari Cr (VI) hingga Cr (III).
Aplikasi
Chromium Hydroxide mempunyai pelbagai aplikasi:
- Formulasi solek.
- Pewarna rambut.
- Pengilat kuku.
- Produk penjagaan kulit.
- Produk pembersihan.
- Dalam penamat logam, yang mewakili 73 % penggunaannya dalam industri.
- Dalam pemeliharaan kayu.
Rujukan
- Whitten, Davis, Peck & Stanley. Kimia. (8th ed.). Pembelajaran Cengage, p 873, 874.
- Pubchem. Hidroksida kromik. Pulih dari pubchem.NCBI.NLM.NIH.Gov
- Sintesis, pencirian dan kestabilan Cr (III) dan Fe (III) hidroksida. Papassiopi, n., Vaxevanidou, k., Christou, c., Karagianni, e. dan antipas, g. J. Bahaya mater. 264: 490-497.
- Prebchem. Penyediaan kromium (iii) hidroksida. Pulih dari prepchem.com
- Wikipedia. (2018). Kromium (iii) hidroksida. Diambil dari.Wikipedia.org