Strontium Hydroxide (Sr (OH) ₂)

- 4071
- 367
- Ms. Edgar Carroll
 Strontium hidroksida
Strontium hidroksida Apa itu strontium hidroksida?
Dia Strontium hidroksida (Sr (OH) ₂) adalah sebatian kimia bukan organik yang dibentuk oleh ion strontium (SR) dan dua ion hidroksida (OH). Kompaun ini diperoleh dengan menggabungkan garam strol dengan asas yang kuat, mengakibatkan sebatian sifat alkali yang formula kimianya adalah SR (OH)2.
Secara umum, untuk penyediaan strontium hidroksida, natrium hidroksida (NaOH) atau kalium hidroksida (KOH) digunakan sebagai asas yang kuat. Sebaliknya, garam strontium (atau strontium ion) yang bertindak balas dengan asas yang kuat adalah nitrat strontium SR (tidak3)2 Dan prosesnya digambarkan oleh tindak balas kimia berikut:
2KOH + SR (Tidak3)2 → 2kno3 + Sr (oh)2
Dalam penyelesaian kation strontium (SR+) Dia berhubung dengan anion hidroksida (oh-) membentuk garam strontium ionik asas. Oleh kerana strontium adalah logam alkali, strontium hidroksida dianggap sebagai sebatian alkali kaustik.
Mendapatkan strontium hidroksida
Sebagai tambahan kepada proses yang dijelaskan sebelumnya, dapat dikatakan bahawa setelah reaksi dilakukan, SR (OH)2 mendakan dalam penyelesaian. Maka ini tertakluk kepada proses mencuci dan pengeringan, akhirnya mendapat serbuk putih yang sangat halus.
Kaedah alternatif untuk mendapatkan strontium hidroksida adalah dari pemanasan strontium karbonat (SRCO3) atau strontium sulfat (srso4), dengan stim pada suhu antara 500 ° C dan 600 ° C. Reaksi kimia berlaku seperti yang ditunjukkan di bawah:
Srco3 + H2O → sr (oh)2 + Co2
SRS + 2H2O → sr (oh)2 + H2S
Boleh melayani anda: asid sulfurStruktur kimia dan sifat fizikokimia
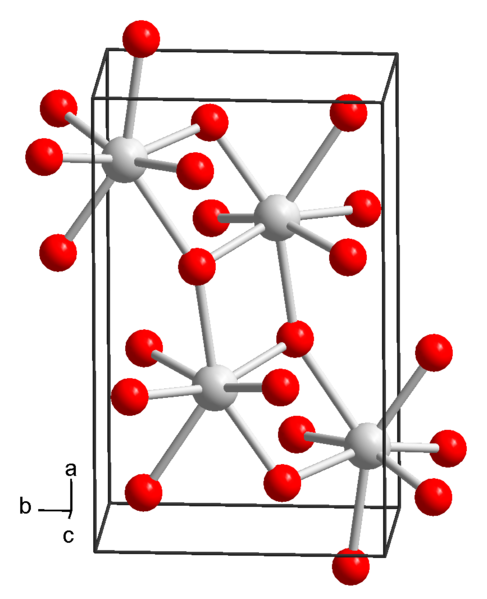 Struktur kimia strontium hidroksida. Sumber: Wikimedia Commons
Struktur kimia strontium hidroksida. Sumber: Wikimedia Commons Pada masa ini, 3 bentuk strontium hidroksida diketahui: octahydrate, monohydrate dan anhydrous.
Strontium hidroksida octonated
Dari penyelesaian dalam keadaan suhu dan tekanan normal (25 ° C dan 1 atm), strontium hidroksida mendahului dengan cara octahydrate, yang formula kimianya adalah SR (OH)2∙ 8h2Sama ada.
Kompaun ini mempunyai jisim molar sebanyak 265.76 g/mol, ketumpatan 1.90 g/cm dan precipitates sebagai kristal tetragonal (dengan kumpulan spatial P4/NCC) penampilan prisma kuadrangular dan tidak berwarna.
Begitu juga, strontium hidroksida oktonis mempunyai keupayaan untuk menyerap kelembapan atmosfera, kerana ia adalah sebatian yang mudah lazat.
Monohydrated strontium hidroksida
Menurut kajian mikroskopi optik (dijalankan oleh teknik difraksi x -ray), dengan menaikkan suhu kepada kira -kira 210 ° C - tekanan atmosfera yang berterusan - SR (OH)2∙ 8h2O Ia dehidrasi dan diubah menjadi strontium hidroksida monohydrated (SR (OH)2∙ h2Sama ada).
Bentuk kompaun ini mempunyai jisim molar sebanyak 139.65 g/mol dan suhu leburnya ialah -73.15 ° C (375k). Oleh kerana konfigurasi atomnya, ini menunjukkan kelarutan yang kurang dalam air daripada yang diterangkan dalam bentuk octahydrate.
Strontium hidroksida anhydrous
Dengan meneruskan peningkatan suhu sistem kepada kira -kira 480 ° C, dehidrasi berpanjangan sehingga hidroksida regangan anhydrous.
Tidak seperti bentuk terhidratnya, ia mempunyai jisim molar sebanyak 121.63 g/mol dan ketumpatan 3,625 g/cm3. Titik mendidihnya dicapai pada 710 ° C (1,310 ° F atau 983 K) manakala titik lebur berada pada 535 ° C (995 ° F atau 808 K).
Boleh melayani anda: Ididio 192Kelarutan
Strontium octahydrate hidroksida mempunyai kelarutan air 0.91 gram setiap 100 mililiter (diukur pada 0 ° C), manakala bentuk anhydrous pada keadaan suhu yang sama mempunyai kelarutan 0.41 gram setiap 100 mililiter.
Begitu juga, bahan ini dianggap tidak larut dalam aseton dan sepenuhnya larut dalam asid dan ammonium klorida.
Kereaktifan kimia
Strontium hidroksida tidak mudah terbakar, kereaktifan kimianya tetap stabil pada suhu dan tekanan sederhana, dan dapat menyerap karbon dioksida dari udara atmosfera, mengubahnya menjadi strontium karbonat.
Di samping itu, ia adalah sebatian yang sangat menjengkelkan jika anda berhubung dengan kulit, saluran pernafasan atau membran mukus lain.
Kegunaan strontium hidroksida
Oleh kerana ciri -ciri hygroscopic dan sifat asasnya, strontium hidroksida digunakan untuk aplikasi yang berbeza dalam industri:
- Pengekstrakan Moice dan Penapisan Gula dari Bit.
- Penstabil plastik.
- Lemak dan pelincir.
Pengekstrakan Moice dan Penapisan Gula Bit
Pada permulaan abad ke -21, di Jerman, regangan hidroksida mula digunakan untuk penapisan bit dari bit, melalui proses yang dipatenkan oleh Carl Scheibler pada tahun 1882.
Prosedur ini terdiri daripada campuran strontium hidroksida dan pulpa bit manis, yang mengakibatkan disaccharide yang tidak larut. Penyelesaian ini dipisahkan oleh penyembuhan dan apabila proses penapisan dijalankan, gula diperolehi sebagai produk akhir.
Walaupun prosedur ini masih digunakan, terdapat kaedah lain dengan lebih banyak permintaan untuk menjadi lebih murah, yang digunakan dalam kebanyakan penapisan gula di dunia. Sebagai contoh, kaedah barsil, yang menggunakan barium silikat, atau kaedah steffen, menggunakan kapur sebagai ejen pengekstrak.
Boleh melayani anda: karbon anomerik: apakah, ciri, contohLemak Strontium
Mereka adalah lemak pelincir yang mengandungi strontium hidroksida. Ini dapat mematuhi permukaan dengan ciri -ciri logam, tahan air dan menyokong perubahan suhu tiba -tiba.
Oleh kerana kestabilan fizikal dan kimia mereka yang baik, lemak ini digunakan sebagai pelincir industri.
Penstabil plastik
Sebilangan besar plastik, terdedah kepada faktor iklim seperti matahari, hujan dan oksigen atmosfera, mengubah suai sifat mereka dan merendahkan.
Kerana rintangan airnya yang besar, strontium hidroksida ditambah kepada polimer ini - semasa fasa gabungan - bertindak sebagai penstabil dalam pembuatan produk plastik untuk memanjangkan hayatnya yang berguna.
Aplikasi lain
- Dalam industri cat ia digunakan sebagai bahan tambahan penting untuk mempercepat proses pengeringan dalam lukisan komersial dan perindustrian.
- Dari strontium hidroksida, garam atau ion strontium diperoleh, yang digunakan sebagai bahan mentah untuk pengeluaran artikel piroteknik.
Rujukan
- Wikipedia (n.d.). Strontium hidroksida. Diambil dari.Wikipedia.org
- Pubchem (s.F.). Strontium hidroksida. Diperolehi dari Pubchem.NCBI.NLM.NIH.Gov
- Honeywell (s.F.). Stontium hidroksida octahydrate. Diperolehi dari Honeywell.com

