Ciri -ciri histidin, struktur, fungsi, makanan
- 4972
- 425
- Erick Krajcik
The Histidine (Dia, H) Ia adalah asid amino yang digunakan untuk sintesis protein. Ia adalah molekul hidrofilik, jadi secara amnya berorientasikan ke arah luar struktur protein ketika berada dalam medium cecair.
Ia dianggap sebagai asid amino penting untuk kanak -kanak yang semakin meningkat kerana mereka tidak menghasilkannya. Pada orang dewasa terdapat pengeluaran histidin kecil, tetapi tidak mencukupi untuk membekalkan keperluan harian sehingga dianggap sebagai asid amino separa.
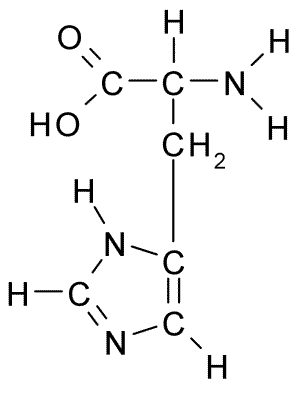
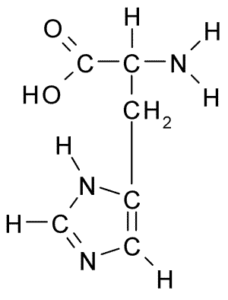 Struktur Kimia Asid Amino Histidin (Sumber: Borb, melalui Wikimedia Commons)
Struktur Kimia Asid Amino Histidin (Sumber: Borb, melalui Wikimedia Commons) Bagi haiwan dan manusia, histidin adalah asid amino yang penting atau sekurang -kurangnya separa, bagaimanapun, tumbuhan, kulat dan mikroorganisma dengan cekap menghasilkan histidin yang mereka perlukan dan merupakan sebahagian daripada sumber pemakanan histidin, sebagai tambahan kepada haiwan protein.
Histidine memenuhi fungsi fisiologi yang sangat penting dalam manusia seperti: yang menjadi sebahagian daripada pusat aktif banyak enzim, mengambil bahagian dalam pertumbuhan, dalam sistem imun dan dalam pembentukan myelin dalam gentian saraf, antara lain.
Biosintesis histidin adalah proses yang kompleks yang berlaku terutamanya di hati dan memerlukan 9 hingga 11 langkah enzimatik. Degradasinya berlaku di hati dan kulit dan melalui pembentukan glutamat, kemudian mengikuti jalan yang berbeza.
Banyak makanan kaya dengan histidin, seperti protein haiwan seperti produk daging dan tenusu, serta protein tumbuhan. Ini memberikan banyak keperluan histidin harian bahawa badan kita perlu berfungsi dengan baik.
Defisit atau histidin berlebihan yang disebabkan oleh mewarisi masalah metabolik atau pengangkutan, atau kegagalan diet dalam pengambilan, berkaitan dengan beberapa masalah penting yang mempengaruhi kesihatan pada kanak -kanak dan orang dewasa. Penggunaan histidin yang mencukupi membolehkan anda mengekalkan kehidupan yang sihat dan sihat dalam kebanyakan kes.
[TOC]
Ciri -ciri
Ciri -ciri penonjolan histidin adalah bahawa ia boleh ditukar menjadi histamin, bahan yang secara aktif mengambil bahagian dalam banyak reaksi alah dan keradangan.
Di dalam ikan yang terdedah kepada alam sekitar tanpa penyejukan yang mencukupi, bakteria dapat menukarkan histidin menjadi histamin dan itulah sebabnya, ketika ditelan, mereka menyebabkan keracunan makanan.
Satu lagi ciri asid amino ini adalah bahawa ia adalah salah satu daripada sedikit, antara 22 yang sedia ada, yang dalam julat pH fisiologi (sekitar 7.4) Ia diionkan dan, oleh itu, boleh secara aktif mengambil bahagian dalam tapak pemangkin banyak enzim.
Dalam molekul hemoglobin, histidin proksimal adalah salah satu ligan kumpulan hemo. Dalam erti kata lain, asid amino ini mengambil bahagian dalam fungsi pengangkutan oksigen hemoglobin dan sangat diperlukan untuk sintesis protein ini, serta untuk myoglobin, yang juga dikenali sebagai "hemoglobin otot".
Struktur
Histidine adalah asid amino Hidrofilik kutub penting, Diklasifikasikan dalam Asid Amino Essential, kerana ia tidak dapat disintesis oleh haiwan. Walau bagaimanapun, dan seperti yang dinyatakan sebelum ini, ia disintesis oleh bakteria, kulat dan tumbuhan.
Dalam kanak -kanak yang semakin meningkat, histidin sangat diperlukan; Orang dewasa boleh mensintesisnya, tetapi tidak jelas jika ini meliputi keperluan harian histidin, jadi ia mesti ditelan dengan diet.
Seperti semua asid amino, histidin mempunyai karbon α yang mana kumpulan amino, kumpulan karboksil, atom hidrogen dan rantaian sampingan disatukan.
Boleh melayani anda: Coxiella burnetiiRantaian sisi asid amino ini dibentuk oleh cincin imidazole yang, untuk pH fisiologi, proton dan memperoleh beban positif dan dipanggil "Imidazolio " disingkat sebagai IMH+.
Bersama Lysine dan Arginine, Histidine membentuk kumpulan asid amino asas. Daripada ketiga -tiga, histidine adalah yang paling tidak asas dan cincin imididoólicanya tidak dilindungi untuk pH hampir 6.
Oleh kerana histidin pH fisiologi boleh bertukar proton, ini biasanya mengambil bahagian dalam pemangkinan enzimatik yang melibatkan pemindahan proton. Di samping itu, kerana ia adalah asid amino kutub, biasanya terdapat di permukaan luar protein, di mana ia boleh menghidrat dalam medium berair.
Fungsi
Sebagai sebahagian daripada laman enzim aktif
Histidine diperlukan untuk sintesis banyak protein, terutamanya enzim yang pusat aktifnya mempunyai asid amino ini. Ia adalah sebahagian daripada pusat aktif aldlasase mamalia, di mana ia berfungsi sebagai penderma proton.
Ia terletak di pusat aktif Carboxipeptidase A, enzim pankreas yang mempunyai tapak aktif yang dibentuk oleh Zn dan histidine. Dalam enzim glikolitik mutasa phosphoglycerate terdapat dua sisa histidin di pusat aktifnya yang bertindak sebagai penerima atau penderma kumpulan fosforil.
Ia juga terdapat di tapak enzim aktif seperti gliseraldehid 3-fosfat dehidrogenase, laktat dehidrogenase, papain, chimotripsin, rnasa a dan ammonia liasa histidine (histidase). Di samping itu, ia adalah perencat enzim glutamin synthetase.
Fungsi lain
Asid amino ini sangat penting untuk organisma, kerana decarboxylase histidine decarn.
Histidine dihasilkan oleh neuron sistem saraf pusat dengan fungsi neuromodulator.
Adalah perlu untuk pembentukan gentian saraf myelin, jadi ia memenuhi peranan penting dalam penghantaran impuls elektrik di dalamnya.
Bersama -sama dengan hormon pertumbuhan dan asid amino lain, histidin menyumbang kepada mekanisme pembaikan tisu, terutamanya dalam sistem kardiovaskular.
Beberapa fungsi tambahan termasuk:
- Menyumbang dengan detoksifikasi beberapa logam berat kerana ia bertindak seperti chelating.
- Melindungi terhadap kerosakan yang disebabkan oleh sinaran.
- Mengambil bahagian dalam pembentukan sel darah merah dan putih.
- Ia perlu untuk pembentukan hemoglobin.
- Ia membantu melawan beberapa kesan negatif arthritis rheumatoid seperti keradangan dan kekurangan mobiliti.
- Ini adalah asid amino penting untuk pertumbuhan semula kapilari, pertumbuhan dan fungsi seksual.
Carnosine, Anserine dan Homocosin, dipéptides terbentuk dari histidin. Dua yang pertama ditemui di otot dan mempunyai fungsi penting seperti tamponer dan sebagai pengaktifan myosin atasa.
Homocosin dihasilkan di otak dalam jumlah 100 kali lebih tinggi daripada berisi otot rangka.
Biosintesis
Histidine memperoleh kerangka berkarbonatnya dari ribosa 5-fosfat. Dalam bakteria Dan. Coli, Asid amino ini berlaku dari sebatian tersebut dengan menggunakan 11 langkah enzimatik:
- Langkah pertama sintesis terdiri daripada pemindahan fosforribosil dari ATP ke karbon 1 ribosa 5-fosfat, menghasilkan 5-phosphorribosyl-1-pyrophosphate (PRPP) (PRPP). Enzim fosforribosil-pyrophosphate synthetase (PRPP synthetase) enzim memangkinkan tindak balas ini.
- Kemudian pemindahan kumpulan pyrophosphate karbon 1 ke N-1 dari ATP berlaku, dan N1- berlaku (5'-phosphorribosyl) -ATP. Enzim yang memangkinkan tindak balas ini adalah phosphoruseltransferase ATP.
- Dengan tindakan fosforribosil-top-pyrophosphate hydroxylase, pautan α, β-pyophosphate ATP adalah hidroksilase dan N1- terbentuk (5'-phosphorribosyl) -AMP.
- Enzim fosforribosil-peta hydroxylase membuka cincin purine antara N-1 dan C-6 dan ribonukleotida dibentuk N1- (5'-phosphorribosil formimino) -5-aminoimidazole-4-carboxamide-1-lribonukleotida.
- Kemudian, cincin ribofuranosa yang berasal dari PRPP dibuka dan isomerized kepada ketosa, membentuk formimin N1- (5'-phosphorribosyl) -5-aminoimidazole-4-carboxamide-1-lribonukleotide berkerjasama dengan enzim isomerase.
- Enzim aminotransferase memindahkan kumpulan glutamin di tengah-tengah glutamin, yang menjadi glutamat, dan memecahkan pautan formimine, jadi ia dikeluarkan 5-aminoimidazole-carboxamide-1-lribonucleotide dan imidazole-gliserol fosfat dihasilkan.
- Molekul air fosfat imidazole-gliserol dihapuskan dengan cara imidazole-gliserol fosfat dehydratase dan membentuk imidazole-asetol fosfat.
- Fosfat imidazole-asetol dipindahkan kumpulan amino melalui histidinol transaminase fosfat dan histidinol fosfat terbentuk.
- Kumpulan ester fosforik histidinol fosfat untuk membentuk histidinol dihidrolisis. Histidinol fosfat fospatase memangkinkan tindak balas ini.
- Kemudian, histidinol dioksidakan oleh histidinol dehydrogenase dan histidinal.
- Histidinol dehidrogenase yang sama mengoksidakan ke histidinal dan menjadikannya histidin.
Enzim pertama laluan biosintetik histidin dihalang oleh produk laluan, iaitu, histidin mengambil bahagian dalam perencatan alestrik ATP phosphorribosyltransferase, yang mewakili mekanisme utama peraturan laluan.
Degradasi
Histidine, proline, glutamat, arginine dan glutamin adalah asid amino yang apabila mereka akhirnya membentuk α-zotoglurate. Empat daripadanya menjadi glutamat, yang disebabkan oleh transaminasi menimbulkan α-ketoglorat.
Histidine, melalui histidinase, kehilangan kumpulan α-amino untuk menjadi urocanato. Kemudian, urocanase melembapkan kedudukan 1 dan 4 urocanato, membentuk 4-midazolone-5-propionate. Seterusnya, kumpulan imino dari 4-midazolone-5-propionato berlaku, membentuk N-formiminoglutamato.
Reaksi terakhir membayangkan pemindahan formil dari n-formiminoglutamate ke tetrahydropholate, yang berfungsi dengan pemindahan enzim glutamat. Produk akhir tindak balas ini adalah glutamat dan tetrahydropolate N5-formimino.
Α-ketoglutarate dibentuk oleh transaminasi glutamat. Α-ketoglutarate adalah perantara kitaran Krebs dan juga boleh memasuki laluan glukoneogenik untuk pembentukan glukosa.
Kumpulan amino glutamato memasuki kitaran pengeluaran urea untuk dihapuskan oleh air kencing. Semua tindak balas ini berlaku di hati dan sebahagian daripada mereka di kulit.
Makanan yang kaya dengan histidin
Keperluan histidin harian adalah kira -kira 10 hingga 11 mg per kg berat badan, sehari. Pada kanak -kanak yang semakin meningkat, histidin adalah asid amino penting yang mesti dibekalkan dengan diet.
Di haiwan lain, histidin juga merupakan asid amino penting dan yang dibesarkan di kandang harus menerima histidin untuk mengekalkan tahap hemoglobin biasa mereka.
Antara makanan yang kaya dengan histidin adalah:
- Daging lembu, kambing, daging babi, ayam dan ayam belanda. Ia juga terdapat dalam ikan seperti tuna (walaupun dalam tin), salmon, trout, pargo dan lubina, serta di makanan laut.
Boleh melayani anda: Budaya Darah: Apa itu, Yayasan, Prosedur, Hasil- Susu dan derivatifnya, terutamanya dalam keju matang seperti Parmesan, Gruyere, Keju Swiss, Gouda, antara lain. Di kalangan penduduk pribumi, dalam serum, dalam yogurt dan krim masam.
- Kacang soya dan kacang seperti kacang dan biji. Di bunga matahari, labu, tembikai, wijen, badam, pistachio, mentega kacang dan chia.
- Telur dan kacang atau kacang putih.
- Biji -bijian keseluruhan seperti quinoa, gandum, beras integral, dll.
Faedah pengambilan anda
Terdapat beberapa keadaan patologi di mana histidin boleh berguna sebagai pembantu untuk rawatan.
Di antara patologi ini, kita boleh menamakan arthritis rheumatoid, hipertensi arteri (kerana kesan hipotensi histidin telah diterangkan), dalam jangkitan, frigiditi dan jantina dan pendengaran, ulser dan anemia.
Di dalam kulit, kemerosotan histidin yang digunakan menghasilkan asid urocanic, yang mampu melindungi kulit kerana ia menyerap sinar ultraviolet.
Penggunaan berlebihan oleh individu yang sihat tidak menghasilkan perubahan besar, kerana ia cepat terdegradasi. Walau bagaimanapun, penggunaan suplemen pemakanan histidin pada pesakit yang mengalami masalah hati dan/atau buah pinggang yang teruk harus dihadkan.
Gangguan kekurangan
Defisit histidin berkaitan dengan perubahan dalam tindak balas imun.
Masalah tulang, pekak dan anemia yang dikaitkan dengan defisit histidin juga telah dilaporkan.
Penyakit Hartnup adalah keadaan keturunan yang mempengaruhi pengangkutan histidin dan tryptophan melalui mukosa usus nipis dan buah pinggang, yang menyebabkan defisit kedua -dua asid amino.
Manifestasi klinikal yang paling relevan adalah kemunculan lesi schegous dan merah pada kulit selepas pendedahan matahari, pelbagai tahap perubahan pergerakan dan beberapa gejala penyakit psikiatri.
Histidinemia adalah penyakit resesif autosomik yang dicirikan oleh defisit enzim histidase, yang menyebabkan peningkatan kepekatan histidin dalam darah dan air kencing.
Akibatnya, pesakit -pesakit ini tidak dapat merendahkan histidin kepada asid urocal di hati dan kulit. Penyakit ini disertakan dengan keterlambatan mental yang sederhana, kecacatan pertuturan dan memori pendengaran tanpa pekak.
Sekatan pengambilan histidin sebagai rawatan tidak berkesan dalam menghasilkan peningkatan klinikal dan memerlukan risiko menjana gangguan pertumbuhan pada kanak -kanak yang terjejas oleh penyakit ini.
Rujukan
- Mathews, c., Van holde, k., & Ahern, k. (2000). Biokimia (Edisi ke -3.). San Francisco, California: Pearson.
- Murray, r., Bender, d., Botham, k., Kennelly, ms., Rodwell, v., & Weil, p. (2009). Biokimia Illustrated Harper (Edisi ke -28.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Prinsip Biokimia Lehninger. Edisi Omega (Edisi ke -5.). doi.org
- Perecarz, ms., Farri, l., & Papageorgiou, a. (1983). Kesan susu manusia dan formula protein rendah pada kadar peralihan protein badan dan perkumuhan 3-methylhistidine kencing bayi preterm. Sains Klinikal, 64, 611-616.
- Lagu, b. C., Joo, n., Aldini, g., & Yeum, k. (2014). Fungsi Biologi Histidine-Dipeptides dan Sindrom Metabolik. Penyelidikan dan Amalan Pemakanan, 8(1), 3-10.

