Sifat oksigen, struktur, risiko, kegunaan

- 4585
- 1040
- Ismael Turner
Dia oksigen Ia adalah elemen kimia yang diwakili oleh simbol atau. Ia adalah gas yang sangat reaktif, yang mengetuai kumpulan 16: calcogens. Nama ini kerana sulfur dan oksigen hadir di hampir semua mineral.
Elektronegativiti yang tinggi menerangkan kekejamannya yang besar oleh elektron, yang membawa kepada bergabung dengan bilangan unsur yang tinggi; Ini adalah bagaimana pelbagai oksida mineral timbul yang memperkayakan kerak bumi. Oleh itu, baki oksigen menyusun dan menjadikan suasana bernafas.
 Oksigen biasanya sinonim dengan udara dan air, tetapi ia juga terdapat di batu dan mineral. Sumber: Pxhere.
Oksigen biasanya sinonim dengan udara dan air, tetapi ia juga terdapat di batu dan mineral. Sumber: Pxhere. Oksigen adalah elemen ketiga yang banyak di alam semesta, di belakang hidrogen dan helium, dan juga merupakan penyusun massa utama korteks bumi. Ia mempunyai peratusan jumlah sebanyak 20.8% atmosfera bumi, dan mewakili 89% daripada jisim air.
Biasanya mempunyai dua bentuk allotropik: oksigen diatomik (atau2), yang merupakan cara yang paling kerap, dan ozon (atau3), terdapat di stratosfera. Namun, terdapat dua orang lain (atau4 I8) yang wujud dalam fasa cecair atau pepejal, dan di bawah tekanan besar.
Oksigen sentiasa dihasilkan melalui proses fotosintesis, yang dilakukan oleh fitoplankton dan tumbuhan daratan. Setelah dihasilkan, ia dilepaskan supaya makhluk hidup dapat menggunakannya, sementara sebahagian kecilnya larut di lautan, menyokong kehidupan akuatik.
Oleh itu, ia adalah elemen penting untuk makhluk hidup; Bukan sahaja kerana ia terdapat dalam kebanyakan sebatian dan molekul yang membentuknya, tetapi juga campur tangan dalam semua proses metabolik mereka.
Walaupun secara kontroversi pengasingannya dikaitkan dengan Carl Scheele dan Joseph Priestley pada tahun 1774, terdapat petunjuk bahawa oksigen sebenarnya diasingkan untuk pertama kalinya pada tahun 1608, oleh Michael Sendivogius.
Gas ini digunakan dalam amalan perubatan untuk memperbaiki keadaan hidup pesakit yang mengalami masalah pernafasan. Begitu juga, oksigen digunakan untuk membolehkan orang memenuhi fungsi mereka dalam persekitaran di mana terdapat penurunan atau tidak ada akses kepada oksigen atmosfera.
Oksigen yang dihasilkan secara komersil digunakan terutamanya dalam industri metalurgi untuk penukaran besi ke dalam keluli.
[TOC]
Sejarah
Semangat nitroarial
Pada tahun 1500, Leonardo da Vinci, berdasarkan eksperimen Philo de Byzantium yang diadakan pada abad kedua hingga. C., Beliau menyimpulkan bahawa sebahagian udara dimakan semasa pembakaran dan pernafasan.
Pada tahun 1608, Cornelius Drebeble menunjukkan bahawa bilik pemanasan (nitrat perak, kno3) Gas berlaku. Gas ini, seperti yang diketahui kemudian, adalah oksigen; Tetapi Drebeble tidak dapat mengenalinya sebagai elemen baru.
Kemudian, pada tahun 1668, John Majow menegaskan bahawa sebahagian daripada udara yang dipanggilnya "Spiritus Nitroaerus" bertanggungjawab untuk kebakaran, dan ia juga dimakan semasa pernafasan dan pembakaran bahan. Majow mengamati bahawa bahan tidak mengatur dengan ketiadaan semangat nitroarial.
Majoow melakukan pembakaran antimoni, dan mengamati peningkatan berat antimoni semasa pembakarannya. Kemudian, Majow menyimpulkan bahawa antimoni digabungkan dengan semangat nitroarial.
Penemuan
Walaupun dia tidak menerima pengiktirafan dari komuniti saintifik, dalam kehidupan atau selepas kematiannya, Michael Sandivogius (1604) mungkin menjadi penemu oksigen yang benar.
Sandivogius adalah doktor alkimia, ahli falsafah dan doktor Sweden yang menghasilkan penguraian terma kalium nitrat. Eksperimennya membawanya ke pembebasan oksigen, yang dipanggil "Cibus Vitae": Makanan Kehidupan.
Antara 1771 dan 1772, ahli kimia Sweden Carl W Scheele menghangatkan beberapa sebatian: kalium nitrat, oksida mangan dan merkuri oksida. Scheele memerhatikan bahawa gas yang meningkatkan pembakaran dibebaskan dari mereka, dan yang mana dia memanggil "udara api".
Eksperimen Joseph Priestly
Pada tahun 1774, ahli kimia Inggeris Joseph Priestly menghangatkan merkuri oksida dengan menggunakan lensa peningkatan dua belas -inci yang memusatkan cahaya matahari. Mercury Oxide mengeluarkan gas yang menyebabkan lilin membakar lebih cepat daripada biasa.
Di samping itu, imam menguji kesan biologi gas. Untuk melakukan ini, dia diletakkan di dalam bekas tertutup tetikus yang dia harapkan untuk bertahan selama lima belas minit; Walau bagaimanapun, dengan kehadiran gas dia selamat sejam, lebih daripada yang dianggarkan.
Priestly menerbitkan hasilnya pada tahun 1774; Sementara Scheele melakukannya pada tahun 1775. Atas sebab ini, penemuan oksigen kepada imam biasanya dikaitkan.
Oksigen di udara
Antoine Lavoisier, ahli kimia Perancis (1777), mendapati bahawa udara mengandungi oksigen 20% dan apabila bahan terbakar, ia sebenarnya menggabungkan dengan oksigen.
Lavoisier menyimpulkan bahawa penambahan berat badan yang jelas bahawa bahan yang dialami semasa pembakaran adalah disebabkan oleh penurunan berat badan yang berlaku di udara; Oleh kerana oksigen digabungkan dengan bahan -bahan ini dan, oleh itu, jisim reaktan dipelihara.
Ini membolehkan Lavoisier menetapkan undang -undang pemuliharaan bahan. Lavoisier mencadangkan nama oksigen yang berasal dari pembentukan asid "oxys" dan "gen" akar. Kemudian oksigen bermaksud 'asid bekas'.
Nama ini salah, kerana tidak semua asid mengandungi oksigen; Contohnya, halogenida hidrogen (HF, HCL, HBR dan HI).
Dalton (1810) yang diberikan kepada air formula kimia dan oleh itu, berat atom oksigen adalah 8. Sekumpulan bahan kimia, termasuk: Davy (1812) dan Berzelius (1814) membetulkan pendekatan Dalton dan menyimpulkan bahawa formula air yang betul adalah H2O dan berat atom oksigen adalah 16.
Boleh melayani anda: air disonisasiSifat fizikal dan kimia
Penampilan
Tanpa warna, tandas dan gas yang tidak enak; Walaupun ozon mempunyai bau ekar. Oksigen nikmat pembakaran, tetapi dengan sendirinya ia bukan bahan bakar.
 Oksigen cecair. Sumber: Kakitangan Sgt. Nika glover, u.S. Tentera Udara [Domain Awam]
Oksigen cecair. Sumber: Kakitangan Sgt. Nika glover, u.S. Tentera Udara [Domain Awam] Dalam bentuk cecairnya (imej atas) ia pucat biru, dan kristalnya juga kebiruan; Tetapi mereka boleh memperoleh nada merah jambu, oren, dan juga kemerahan (seperti yang akan dijelaskan di bahagian struktur mereka).
Berat atom
15,999 u.
Nombor atom (z)
8.
Takat lebur
-218.79 ºC.
Takat didih
-182,962 ºC.
Ketumpatan
Dalam keadaan biasa: 1,429 g/l. Oksigen adalah gas paling padat daripada udara. Di samping itu, ia adalah konduktor haba dan elektrik yang buruk. Dan pada titik mendidihnya (cecair), ketumpatan adalah 1,141 g/ml.
Triple Point
54,361 K dan 0.1463 kPa (14.44 atm).
Titik kritikal
154,581 K dan 5,043 MPa (49770.54 ATM).
Haba Fusion
0.444 kJ/mol.
Haba pengewapan
6.82 kJ/mol.
Kapasiti kalori molar
29,378 j/(mol · k).
Tekanan wap
Pada suhu 90 K mempunyai tekanan stim 986.92 atm.
Keadaan pengoksidaan
-2, -1, +1, +2. Status pengoksidaan yang paling penting ialah -2 (atau2-).
Elektronegativiti
3.44 pada skala Pauling
Tenaga pengionan
Pertama: 1.313.9 kJ/mol.
Kedua: 3.388.3 kJ/mol.
Ketiga: 5.300.5 kJ/mol.
Urutan magnet
Paramagnetic.
Kelarutan air
Kelarutan oksigen dalam air berkurangan apabila suhu meningkat. Contohnya: 14.6 ml oksigen/l air dibubarkan pada 0 ºC dan 7.6 ml oksigen/L air pada 20 ºC. Kelarutan oksigen dalam air minuman lebih besar daripada air laut.
Dalam keadaan suhu 25 ºC dan pada tekanan 101.3 kPa, air minuman boleh mengandungi 6.04 ml oksigen/L air; Sementara air laut hanya 4.95 ml oksigen/l air.
Reaktiviti
Oksigen adalah gas yang sangat reaktif yang bertindak balas secara langsung dengan hampir semua elemen pada suhu bilik dan suhu tinggi; kecuali logam yang mempunyai potensi pengurangan yang lebih tinggi daripada tembaga.
Anda juga boleh bertindak balas dengan sebatian, mengoksidakan unsur -unsur yang ada di dalamnya. Inilah yang berlaku apabila ia bertindak balas dengan glukosa, sebagai contoh, untuk menghasilkan air dan karbon dioksida; atau ketika kayu atau hidrokarbon terbakar.
Oksigen boleh menerima elektron dengan pemindahan lengkap atau separa, jadi dianggap sebagai ejen pengoksidaan.
Nombor pengoksidaan yang paling biasa atau status pengoksidaan ialah -2. Dengan nombor pengoksidaan ini terdapat di dalam air (h2O), sulfur dioksida (begitu2) dan karbon dioksida (CO2).
Juga, dalam sebatian organik seperti aldehid, alkohol, asid karboksilik; asid biasa seperti h2SW4, H2Co3, Hno3; dan dalam garam yang diperolehi: na2SW4, Na2Co3 Ok tidak3. Dalam kesemuanya, kewujudan O dapat diandaikan2- (yang tidak benar untuk sebatian organik).
Oksida
Oksigen hadir sebagai atau2- Dalam struktur kristal oksida logam.
Sebaliknya, dalam superoksida logam, seperti kalium superoxide (KO2), oksigen seperti ion atau2-. Semasa dalam peroksida logam, untuk mengatakan barium peroksida (bao2), oksigen dibentangkan sebagai ion atau22- (BA2+Sama ada22-).
Isotop
Oksigen mempunyai tiga isotop stabil: 16Atau, dengan kelimpahan 99.76%; Dia 17Atau, dengan 0.04%; dan juga 18Atau, dengan 0.20%. Perhatikan bahawa dia 16Atau ia adalah isotop yang paling stabil dan berlimpah.
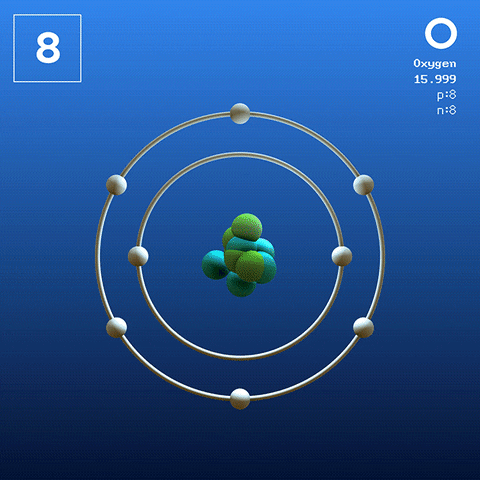
Struktur dan konfigurasi elektronik
Molekul dan interaksi oksigen
 Molekul oksigen diatomik. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Molekul oksigen diatomik. Sumber: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Oksigen dalam keadaan basalnya adalah atom yang konfigurasi elektroniknya adalah:
[Dia] 2s2 2 p4
Menurut Teori Pautan Valencia (TEV), dua atom oksigen dikaitkan dengan kovalen supaya kedua -duanya melengkapkan oktet Valencia secara berasingan; Selain dapat mengawan dua elektron kesepian mereka dari orbital 2p.
Dengan cara ini, molekul diatomik oksigen muncul, atau2 (Imej yang lebih tinggi), yang mempunyai ikatan berganda (O = O). Kestabilan tenaga adalah sedemikian rupa sehingga oksigen tidak pernah dijumpai sebagai atom individu dalam fasa gas tetapi sebagai molekul.
Kerana o2 Dia adalah homonuklear, linear dan simetri, tidak mempunyai momen dipole kekal; Oleh itu, interaksi intermolecularnya bergantung kepada jisim molekulnya dan daya penyebaran London. Daya ini agak lemah untuk oksigen, yang menjelaskan mengapa ia adalah gas dalam keadaan daratan.
Walau bagaimanapun, apabila suhu turun atau meningkatkan tekanan, molekul atau2 Mereka terpaksa bersatu padu; Sehingga interaksi mereka menjadi penting dan membenarkan pembentukan oksigen cecair atau pepejal. Untuk cuba memahaminya secara molekul, perlu untuk tidak kehilangan pandangan o2 sebagai unit struktur.
Ozon
Oksigen boleh mengamalkan struktur molekul lain yang stabil; Iaitu, terdapat dalam alam semula jadi (atau di dalam makmal) dalam pelbagai bentuk allotropik. Ozon (imej yang lebih rendah), atau3, Contohnya, ia adalah alotrope kedua oksigen yang paling terkenal.
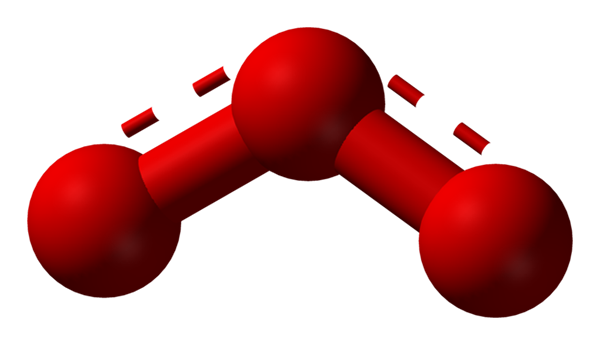 Struktur hibrid resonans yang diwakili oleh model sfera dan bar untuk molekul ozon. Sumber: Ben Mills melalui Wikipedia.
Struktur hibrid resonans yang diwakili oleh model sfera dan bar untuk molekul ozon. Sumber: Ben Mills melalui Wikipedia. Sekali lagi, Tev memegang, menerangkan dan menunjukkan bahawa di atau3 Mesti ada struktur resonans yang menstabilkan beban formal positif oksigen pusat (garis -garis yang berwarna merah); Walaupun oksigen dari akhir bumerang beban negatif diedarkan, menyebabkan jumlah beban untuk ozon.
Boleh melayani anda: Peraturan Kelarutan: Aspek dan Peraturan UmumDengan cara ini, pautan tidak mudah, tetapi tidak berganda. Contoh hibrid resonans sangat biasa dalam banyak molekul atau ion bukan organik.
O2 I3, Akibatnya struktur molekul mereka berbeza, perkara yang sama berlaku untuk sifat fizikal dan kimia mereka, fasa cecair atau kristal (walaupun kedua -dua atom oksigen). Mereka berteori bahawa sintesis pada skala besar ozon kitaran mungkin, yang strukturnya menyerupai segitiga kemerahan dan oksigen.
Setakat ini "alotrop biasa" oksigen tiba. Walau bagaimanapun, terdapat dua orang lain yang perlu dipertimbangkan: o4 I8, dijumpai atau dicadangkan dalam oksigen cecair dan pepejal.
Oksigen cecair
Oksigen gas tidak berwarna, tetapi apabila suhu turun hingga -183 ºC, memeluk cecair biru pucat (celestial serupa). Interaksi antara molekul atau2 Sekarang walaupun elektron mereka dapat menyerap foton di rantau merah spektrum yang kelihatan untuk mencerminkan warna biru ciri -cirinya.
Walau bagaimanapun, telah berteori bahawa dalam cecair ini terdapat lebih daripada molekul mudah atau2, tetapi juga molekul atau4 (gambar yang lebih rendah). Nampaknya seolah -olah ozon telah "melekatkan" atom oksigen lain yang entah bagaimana syafaat oleh beban formal yang baru digambarkan.
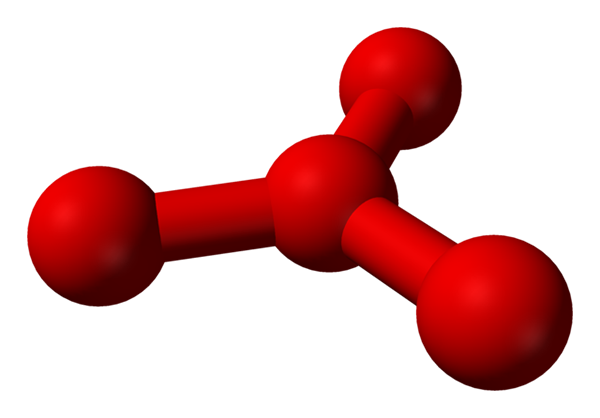 Model yang dicadangkan struktur dengan sfera dan bar untuk molekul tetraoksigen. Sumber: Benjah-bmm27 [domain awam]
Model yang dicadangkan struktur dengan sfera dan bar untuk molekul tetraoksigen. Sumber: Benjah-bmm27 [domain awam] Masalahnya ialah mengikut simulasi komputer dan molekul, kata struktur untuk O4 Ia tidak stabil; Walau bagaimanapun, mereka meramalkan bahawa mereka wujud sebagai unit (atau2)2, iaitu, dua molekul o2 Mereka mendekati begitu banyak sehingga mereka membentuk sejenis bingkai yang tidak teratur (atom atau tidak sejajar dengan satu sama lain).
Oksigen pepejal
Setelah suhu turun ke -218.79 ºC, oksigen mengkristal dalam struktur padu mudah (γ fasa). Apabila suhu jatuh lebih banyak, kaca padu mengalami peralihan ke fasa β (Rhomboédica dan pada -229.35 ºC) dan α (Monoclinic dan pada -249.35 ºC).
Semua fasa kristal oksigen pepejal berlaku pada tekanan ambien (1 atm). Apabila tekanan meningkat kepada 9 GPa (~ 9000 atm), fasa Δ muncul, yang kristalnya oren. Sekiranya tekanan terus meningkat kepada 10 GPa, oksigen pepejal merah muncul atau fasa ε (sekali lagi monoklinik).
Fasa ε adalah istimewa kerana tekanannya sangat besar sehingga molekul atau2 Bukan sahaja mereka ditempatkan sebagai unit atau4, tetapi juga atau8:
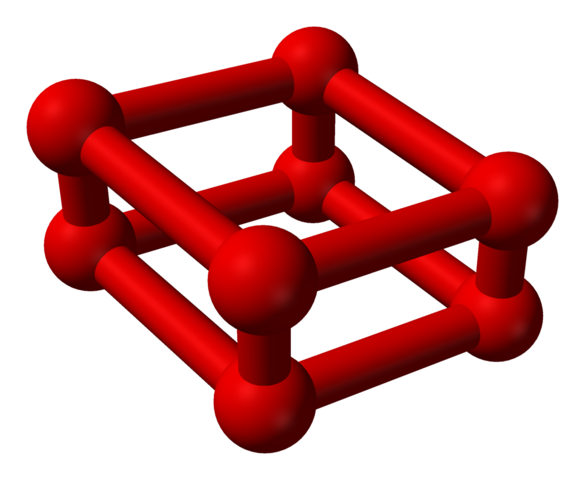 Struktur model dengan sfera dan bar untuk molekul oktaoksigen. Sumber: Benjah-bmm27 [domain awam]
Struktur model dengan sfera dan bar untuk molekul oktaoksigen. Sumber: Benjah-bmm27 [domain awam] Perhatikan bahawa ini atau8 Ia terdiri daripada dua unit atau4 di mana rangka kerja yang tidak teratur sudah dijelaskan. Ia juga sah untuk menganggapnya sebagai empat atau2 diselaraskan dengan teliti dan dalam kedudukan menegak. Walau bagaimanapun, kestabilannya adalah seperti di bawah tekanan ini bahawa atau4 I8 Mereka adalah dua alotrop tambahan untuk oksigen.
Dan akhirnya kita mempunyai fasa ζ, logam (untuk tekanan lebih besar daripada 96 GPa), di mana tekanan membuat elektron tersebar di dalam kaca; Seperti logam.
Di mana dan pengeluaran
Mineral
Oksigen adalah secara besar -besaran elemen ketiga alam semesta, di belakang hidrogen dan helium. Ia merupakan unsur yang paling banyak dari kerak bumi, yang mewakili kira -kira 50% jisimnya. Ia terutamanya digabungkan dengan silikon, dalam bentuk silikon oksida (SIO2).
Oksigen menjadi sebahagian daripada mineral yang tidak terhitung jumlahnya. Begitu juga, ia terletak sebagai sebahagian daripada banyak sebatian seperti karbonat, fosfat, sulfat, nitrat, dll.
Udara
Oksigen membentuk 20.8% udara atmosfera dalam jumlah. Di troposfera ia terutamanya seperti molekul oksigen diatomik. Semasa di stratosfera, lapisan gas antara 15 dan 50 km permukaan bumi, seperti ozon.
Ozon dihasilkan oleh kejutan elektrik pada molekul o2. Alotrope oksigen ini menyerap cahaya ultraviolet sinaran suria, menyekat tindakan berbahaya terhadap manusia, yang dalam kes -kes yang melampau dikaitkan dengan penampilan melanoma.
Air segar dan asin
Oksigen adalah komponen utama air laut dan air tawar dari tasik, sungai dan air bawah tanah. Oksigen adalah sebahagian daripada formula kimia air, menguasai 89% daripadanya.
Sebaliknya, walaupun kelarutan oksigen di dalam air agak rendah, jumlah oksigen yang dibubarkan dalam ini adalah penting untuk kehidupan akuatik, yang termasuk banyak spesies haiwan dan alga.
Makhluk hidup
Manusia terbentuk, kira -kira 60% air dan pada masa yang sama, kaya dengan oksigen. Tetapi di samping itu, oksigen adalah sebahagian daripada pelbagai sebatian, seperti fosfat, karbonat, asid karboksilik, keton, dll., yang penting untuk hidup.
Oksigen juga terdapat dalam polisakarida, lipid, protein dan asid nukleik; iaitu makromolekul biologi yang begitu banyak.
Ia juga merupakan sebahagian daripada pembaziran aktiviti manusia yang berbahaya, contohnya: karbon dioksida dan dioksida, serta sulfur dioksida.
Pengeluaran biologi
 Tumbuhan bertanggungjawab untuk memperkayakan udara oksigen sebagai pertukaran untuk karbon dioksida yang kami menghembus nafas. Sumber: Pexels.
Tumbuhan bertanggungjawab untuk memperkayakan udara oksigen sebagai pertukaran untuk karbon dioksida yang kami menghembus nafas. Sumber: Pexels. Oksigen berlaku semasa fotosintesis, proses di mana fitoplankton marin dan tumbuh -tumbuhan terestrial menggunakan tenaga ringan untuk bertindak balas karbon dioksida dengan air, menyebabkan glukosa dan melepaskan oksigen.
Dianggarkan bahawa lebih daripada 55% oksigen yang dihasilkan oleh fotosintesis adalah disebabkan oleh tindakan fitoplankton laut. Oleh itu, ia merupakan sumber utama penjanaan oksigen di bumi dan bertanggungjawab untuk penyelenggaraan kehidupan di dalamnya.
Pengeluaran industri
Pencairan udara
Kaedah pengeluaran oksigen industri utama dicipta pada tahun 1895, secara bebas oleh Karl Paul Gottfried von Linde dan William Hamson. Kaedah ini sedang menggunakan beberapa pengubahsuaian.
Boleh melayani anda: butanone: struktur, sifat dan kegunaanProses ini bermula dengan mampatan udara untuk memeluk wap air dan dengan itu menghapuskannya. Kemudian, udara ditapis apabila dijalankan oleh campuran zeolit dan gel silika, untuk penghapusan karbon dioksida, hidrokarbon berat dan selebihnya air.
Selanjutnya, komponen udara cair dipisahkan melalui penyulingan pecahan, mencapai pemisahan gas yang terdapat dalam titik mendidih yang berbeza. Dengan kaedah oksigen ini diperoleh dengan kesucian 99%.
Elektrolisis air
Oksigen dihasilkan oleh elektrolisis air yang sangat dimurnikan, dan dengan kekonduksian elektrik yang tidak melebihi 1 μs/cm. Air dipisahkan oleh elektrolisis dalam komponennya. Hidrogen sebagai kation bergerak ke katod (-); Semasa oksigen bergerak ke arah anod (+).
Elektrod mempunyai struktur khas untuk mengumpul gas dan seterusnya menghasilkan cecair mereka.
Penguraian terma
Penguraian haba sebatian seperti merkuri oksida dan tuan rumah (kalium nitrat), melepaskan oksigen, yang boleh dikumpulkan untuk digunakan. Peroksida juga digunakan untuk tujuan ini.
Kertas Biologi
Oksigen dihasilkan oleh fitoplankton dan loji tanah melalui fotosintesis. Ia melintasi dinding pulmonari dan dalam darah ia ditangkap oleh hemoglobin, yang mengangkutnya ke organ yang berbeza dan kemudian digunakan dalam metabolisme sel.
Dalam proses ini oksigen digunakan semasa metabolisme karbohidrat, asid lemak dan asid amino, akhirnya menghasilkan karbon dioksida dan tenaga.
Pernafasan boleh skema seperti berikut:
C6H12Sama ada6 + Sama ada2 => Co2 + H2Atau +tenaga
Glukosa dimetabolisme dalam satu set proses kimia berurutan, termasuk glikolisis, kitaran Krebs, rantaian pengangkutan elektronik dan fosforilasi oksidatif. Siri peristiwa ini menghasilkan tenaga yang terkumpul sebagai ATP (Adenosín triposphate).
ATP digunakan dalam pelbagai proses dalam sel yang termasuk pengangkutan ion dan bahan lain melalui membran plasma; penyerapan usus bahan; penguncupan sel -sel otot yang berbeza; Metabolisme molekul yang berbeza, dll.
Leukosit polimorfonuklear dan makrofag adalah sel fagositik yang mampu menggunakan oksigen untuk menghasilkan ion superoxide, hidrogen peroksida dan oksigen tunggal, yang digunakan untuk memusnahkan mikroorganisma.
Risiko
Oksigen bernafas ke tekanan tinggi boleh menyebabkan mual, pening, kekejangan otot, kehilangan penglihatan, sawan dan kehilangan kesedaran. Di samping itu, bernafas oksigen tulen untuk jangka masa yang panjang menyebabkan kerengsaan paru -paru, yang ditunjukkan oleh batuk dan pemendekan pernafasan.
Ia juga boleh menjadi punca pembentukan edema pulmonari: keadaan yang sangat serius yang mengehadkan fungsi pernafasan.
Atmosfera dengan kepekatan oksigen yang tinggi boleh berbahaya, kerana ia memudahkan perkembangan kebakaran dan letupan.
Aplikasi
Doktor
Oksigen diberikan kepada pesakit yang mengalami kegagalan pernafasan; Ini adalah kes pesakit yang terjejas oleh radang paru -paru, edema pulmonari atau emfisema. Mereka tidak dapat menghirup oksigen alam sekitar kerana mereka akan terjejas serius.
Pesakit dengan kegagalan jantung dalam apa yang dibentangkan pengumpulan cecair di alveoli juga memerlukan oksigen untuk dibekalkan; Seperti pesakit yang mengalami kemalangan vaskular yang teruk (strok).
Keperluan pekerjaan
Pemadam kebakaran yang memerangi kebakaran di persekitaran dengan pengudaraan yang tidak sesuai, memerlukan penggunaan topeng dan botol oksigen yang membolehkan mereka memenuhi fungsi mereka, tanpa meletakkan nyawa mereka dalam risiko yang lebih besar.
Kapal selam dilengkapi dengan peralatan pengeluaran oksigen yang membolehkan pelaut tinggal di persekitaran tertutup tanpa akses udara atmosfera.
Para penyelam melakukan kerja mereka tenggelam di dalam air dan, oleh itu, terpencil dari udara atmosfera. Mereka bernafas oleh oksigen yang dipam oleh tiub yang disambungkan ke imbasan mereka atau penggunaan bombon yang dilampirkan pada badan kapal selam.
Angkasawan menjalankan aktiviti mereka dalam persekitaran yang dilengkapi dengan penjana oksigen yang membolehkan kelangsungan hidup semasa perjalanan ruang angkasa dan di stesen angkasa.
Perindustrian
Lebih daripada 50% oksigen yang dihasilkan secara industri dimakan dalam transformasi besi ke dalam keluli. Besi tuang disuntik dengan jet oksigen untuk menghapuskan sulfur dan karbon hadir; bertindak balas untuk menghasilkan begitu gas2 dan co2, masing -masing.
Acetylene digunakan dalam kombinasi dengan oksigen untuk memotong plat logam dan juga untuk menghasilkan kimpalannya. Oksigen juga digunakan dalam pengeluaran kaca, meningkatkan pembakaran dalam penaiknya untuk meningkatkan ketelusannya.
Spektrofotometri penyerapan atom
Gabungan asetilena dan oksigen digunakan untuk membakar sampel asal yang berbeza dalam spektrofotometer penyerapan atom.
Semasa prosedur, pancaran cahaya dari lampu dipengaruhi oleh api, yang khusus untuk elemen yang dikehendaki untuk mengukur. Api menyerap cahaya lampu, yang membolehkan kuantifikasi elemen.
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Wikipedia. (2019). Oksigen. Diperoleh dari: dalam.Wikipedia.org
- Richard Van Noordden. (13 September 2006). Hanya fasa yang cantik? Oksigen merah pepejal: tidak berguna tetapi menggembirakan. Pulih dari: alam semula jadi.com
- Azonano. (4 Disember 2006). Struptur kristal e-fasa oksigen pepejal ditentukan di sepanjang penemuan kluster oksigen O8. Pulih dari: azonano.com
- Pusat Kebangsaan Maklumat Bioteknologi. (2019). Molekul oksigen. Pangkalan data PUBCHEM. CID = 977. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Dr. Doug Stewart. (2019). Fakta unsur oksigen. Chemicool. Pulih dari: chemicool.com
- Robert c. Brazted. (9 Julai 2019). Oksigen: elemen kimia. Encyclopædia Britannica. Pulih dari: Britannica.com
- Anak -anak wiki. (2019). Keluarga oksigen: sifat melalui elemen. Pulih dari: hanya.Sains
- Advameg, Inc. (2019). Oksigen. Pulih dari: MadeHow.com
- Lentech b.V. (2019). Jadual Tempoh: Oksigen. Pulih dari: lentech.com
- Jabatan Kesihatan dan Perkhidmatan Kanan New Jersey. (2007). Oksigen: lembaran fakta bahan bahaya. [Pdf]. Pulih dari: NJ.Gov
- Yamel Mattarollo. (26 Ogos 2015). Aplikasi perindustrian oksigen perindustrian. Pulih dari: altecdust.com

