Immunoglobulins
- 3503
- 95
- Clarence Greenholt DDS
 Ilustrasi immunoglobulin
Ilustrasi immunoglobulin Apa itu immunoglobulin?
The Immunoglobulins Mereka adalah molekul yang mengeluarkan limfosit B dan sel plasma yang bekerjasama dengan pertahanan organisma. Mereka terdiri daripada biomolekul glikoprotein yang dimiliki oleh sistem imun. Mereka adalah salah satu protein yang paling banyak dari serum darah, selepas albumin.
Antibodi adalah nama lain yang menerima immunoglobulin, dan dianggap globulin kerana tingkah laku mereka dalam elektroforesis serum darah yang mengandungi mereka. Molekul immunoglobulin boleh menjadi mudah atau kompleks, bergantung kepada sama ada persembahan anda sebagai monomer atau polimerisasi.
Struktur biasa immunoglobulin adalah serupa dengan huruf "y". Terdapat lima jenis immunoglobulin yang mempunyai perbezaan morfologi, berfungsi dan lokasi dalam badan. Perbezaan struktur antibodi tidak dalam bentuk, tetapi dari segi komposisi mereka; Setiap jenis mempunyai objektif tertentu.
Tanggapan imun yang dipromosikan oleh immunoglobulin sangat spesifik dan merupakan mekanisme yang sangat kompleks. Rangsangan untuk rembesannya oleh sel diaktifkan dengan kehadiran agen pelik kepada badan, seperti bakteria. Fungsi immunoglobulin adalah untuk menyertai elemen pelik dan menghapuskannya.
Imunoglobulin atau antibodi mungkin terdapat dalam darah dan di permukaan membran organ. Biomolekul ini mewakili unsur -unsur penting dalam sistem pertahanan tubuh manusia.
Struktur immunoglobulin

Struktur antibodi mengandungi asid amino dan karbohidrat, oligosakarida. Kehadiran asid amino yang utama, kuantiti dan pengedarannya adalah apa yang menentukan struktur immunoglobulin.
Seperti mana -mana protein, immunoglobulin mempunyai struktur utama, menengah, tertiari dan kuartal, menentukan penampilan biasa mereka.
Sebagai tindak balas kepada bilangan asid amino yang mereka sampaikan, immunoglobulin mempunyai dua jenis rantai: rantai berat dan rantai cahaya. Di samping.
Rantai berat
Rantaian berat immunoglobulin sesuai dengan unit polipeptida yang terdiri daripada urutan asid 440 amino.
Setiap immunoglobulin mempunyai 2 rantai berat, dan masing -masing mempunyai rantau yang berubah -ubah dan kawasan yang tetap. Rantau malar mempunyai 330 asid amino dan pembolehubah 110 asid amino disusun.
Struktur rantai berat berbeza untuk setiap immunoglobulin. Mereka adalah sejumlah 5 jenis rantai berat yang menentukan jenis immunoglobulin.
Jenis rantai berat dikenal pasti dengan huruf Yunani γ, μ, α, ε, δ untuk IgG, IgM, IgA, IgE dan Igd Immunoglobulins, masing -masing.
Kawasan berterusan rantai berat ε dan μ dibentuk oleh empat domain, manakala yang sepadan dengan α, γ, δ mempunyai tiga. Kemudian, setiap rantau malar akan berbeza untuk setiap jenis immunoglobulin, tetapi biasa dengan immunoglobulin jenis yang sama.
Boleh melayani anda: otot sternocleidohioidKawasan berubah rantai berat dibentuk oleh domain immunoglobulin tunggal. Rantau ini mempunyai urutan 110 asid amino, dan akan berbeza bergantung kepada kekhususan antibodi oleh antigen.
Dalam struktur rantai berat, angulasi atau fleksi dapat diperhatikan - engsel - yang mewakili kawasan fleksibel rantai.
Rantai cahaya
Rantai cahaya immunoglobulin adalah polipeptida yang terdiri daripada kira -kira 220 asid amino. Terdapat dua jenis rantai cahaya di manusia: kappa (κ) dan lambda (λ), yang terakhir dengan empat subtipe. Domain tetap dan berubah mempunyai urutan sebanyak 110 asid amino.
Antibodi boleh mempunyai dua rantai cahaya κ (κκ) atau sepasang rantai λ (λλ) tetapi tidak mungkin memiliki satu jenis pada setiap masa yang sama.
Segmen FC dan Fab
Oleh kerana setiap immunoglobulin mempunyai bentuk yang serupa dengan "y" boleh dibahagikan kepada dua segmen. Segmen "lebih rendah", asas, dipanggil pecahan kristal atau FC; manakala lengan "y" membentuk fab, atau pecahan yang menyatukan antigen. Setiap bahagian struktur immunoglobulin ini melaksanakan fungsi yang berbeza.
Segmen FC
Segmen FC mempunyai dua atau tiga domain berterusan rantai berat immunoglobulin.
FC boleh menyertai protein atau penerima tertentu dalam basofil, eosinofil atau sel barli, jadi ia mendorong tindak balas imun tertentu yang akan menghapuskan antigen. FC sepadan dengan akhir karboksil immunoglobulin.
Segmen Fab
Pecahan atau segmen fabik antibodi mengandungi domain berubah -ubah di hujungnya, sebagai tambahan kepada domain tetap rantai berat dan ringan.
Domain berterusan rantai berat berterusan dengan domain segmen FC yang membentuk engsel. Ia sepadan dengan terminoglobulin terminal amino.
Kepentingan segmen fab adalah bahawa ia membolehkan kesatuan dengan antigen, bahan pelik dan berpotensi berbahaya.
Domain berubah setiap immunoglobulin menjamin kekhususan mereka oleh antigen yang diberikan; Ciri ini juga membolehkan penggunaannya dalam diagnosis penyakit keradangan dan berjangkit.
Jenis immunoglobulin
 Oleh Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], melalui Wikimedia Commons
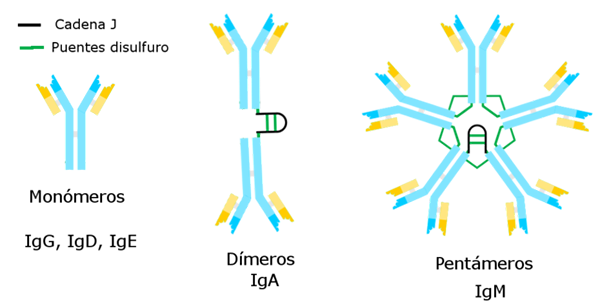
Oleh Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/lesen/by-sa/3.0)], melalui Wikimedia Commons Immunoglobulin yang diketahui setakat ini mempunyai rantai berat tertentu yang tetap bagi setiap ini dan perbezaan dari yang lain.
Terdapat lima jenis rantai berat yang menentukan lima jenis immunoglobulin, yang fungsinya berbeza.
Immunoglobulin G (IgG)
Immunoglobulin g adalah variasi yang paling banyak. Ia mempunyai rantai gamma yang berat dan dibentangkan dalam bentuk yang tidak penting atau monomerik.
IgG adalah yang paling banyak dalam serum darah dan di ruang tisu. Perubahan minimum dalam urutan asid amino rantaian beratnya menentukan pembahagiannya menjadi subtipe: 1, 2, 3 dan 4.
Boleh melayani anda: sarcomroImmunoglobulin G mempunyai urutan 330 asid amino dalam segmen FC dan berat molekul 150,000, di mana 105,000 sesuai dengan rantai beratnya.
Immunoglobulin M (IGM)
Immunoglobulin M adalah pentage yang rantai beratnya μ. Berat molekulnya tinggi, kira -kira 900,000.
Urutan asid amino rantai beratnya adalah 440 dalam pecahan FC. Ia kebanyakannya dalam serum darah, yang mewakili 10 hingga 12 % immunoglobulin. IGM mempunyai subtipe tunggal.
Immunoglobulin A (IGA)
Rantaian berat α sepadan dengannya, dan mewakili 15 % daripada jumlah immunoglobulin. IGA ditemui dalam kedua -dua darah dan rembesan, walaupun dalam susu ibu, menyampaikan dalam bentuk monomer atau dimer. Berat molekul imunoglobulin ini adalah 320,000 dan mempunyai dua subtipe: IGA1 dan IGA2.
Immunoglobulin E (IgE)
Immunoglobulin E terdiri daripada jenis rantaian berat ε dan sangat terhad dalam serum, sekitar 0.002 %.
IGE mempunyai berat molekul 200,000 dan hadir sebagai monomer terutamanya dalam serum, lendir hidung dan air liur. Ia juga biasa untuk mencari immunoglobulin ini dalam sel basofil dan tiang.
Immunoglobulin D (IGD)
Pelbagai rantai berat δ sepadan dengan immunoglobulin D, yang mewakili 0.2 % daripada jumlah immunoglobulin. IGD mempunyai berat molekul 180,000 dan berstruktur dalam bentuk monomer.
Ia berkaitan dengan limfosit B, dilampirkan pada permukaannya. Walau bagaimanapun, fungsi IGD tidak jelas.
Jenis perubahan
Immunoglobulins mungkin mengalami perubahan jenis struktur, kerana keperluan untuk mempertahankan terhadap antigen.
Perubahan ini disebabkan oleh fungsi limfosit B antibodi pembuatan oleh harta imuniti adaptif. Perubahan struktur berada di kawasan tetap rantai berat, tanpa mengubah rantau pembolehubah.
Perubahan kelas atau kelas boleh menyebabkan IgM lulus ke IgG atau IgE, dan ini berlaku sebagai tindak balas yang disebabkan oleh interferon gamma atau IL-4 dan IL-5 interleucins.
Fungsi imunoglobulin
Peranan yang dimainkan oleh immunoglobulin dalam sistem imun sangat penting untuk mempertahankan organisma.
Immunoglobulins adalah sebahagian daripada sistem imun humoral; iaitu, mereka adalah bahan yang dirembeskan oleh sel untuk perlindungan terhadap patogen atau agen berbahaya.
Mereka menyediakan cara pertahanan yang berkesan, berkesan, spesifik dan sistematik, yang bernilai tinggi sebagai sebahagian daripada sistem imun. Mereka mempunyai fungsi umum dan khusus dalam imuniti:
Fungsi umum
Antibodi atau imunoglobulin memenuhi kedua -dua fungsi bebas dan mengaktifkan respons effector dan penyembur yang dimediasi oleh sel.
Kesatuan Antigen-Tantierpo
Immunoglobulins mempunyai fungsi menyertai agen antigen secara khusus dan selektif.
Pembentukan kompleks antigen-antibodi adalah fungsi utama immunoglobulin dan, oleh itu, adalah tindak balas imun yang dapat menghentikan tindakan antigen. Setiap antibodi boleh menyertai dua atau lebih antigen pada masa yang sama.
Boleh melayani anda: tulang alveolarFungsi yang berkesan
Kebanyakan masa kompleks antigen-antibodi berfungsi sebagai permulaan untuk mengaktifkan tindak balas selular tertentu atau memulakan urutan peristiwa yang menentukan penghapusan antigen. Dua tindak balas effector yang paling biasa adalah kesatuan sel dan pengaktifan pelengkap.
Kesatuan selular bergantung pada kehadiran reseptor tertentu untuk segmen immunoglobulin FC, setelah ia bergabung dengan antigen.
Sel seperti sel mast, eosinofil, basofil limfosit dan fagosit mempunyai reseptor ini dan menyediakan mekanisme penghapusan antigen.
Pengaktifan air terjun pelengkap adalah mekanisme kompleks yang melibatkan permulaan urutan, jadi hasil akhir adalah rembesan bahan toksik yang menghapuskan antigen.
Fungsi khusus
Pertama, setiap jenis immunoglobulin mengembangkan fungsi pertahanan tertentu:
Immunoglobulin g
- Immunoglobulin G memberikan kebanyakan pertahanan terhadap agen antigen, termasuk bakteria dan virus.
- Mekanisme aktif IgG seperti pelengkap dan fagositosis.
- Perlembagaan IgG khusus untuk antigen adalah tahan lama.
- Satu -satunya antibodi yang boleh dipindahkan ibu kepada kanak -kanak semasa kehamilan ialah IgG.
Immunoglobulin m
- IGM adalah antibodi tindak balas cepat sebelum ejen berbahaya dan berjangkit, kerana ia memberikan tindakan segera sehingga ia digantikan oleh IgG.
- Antibodi ini mengaktifkan tindak balas selular yang dimasukkan ke dalam membran limfosit humoral dan tindak balas seperti pelengkap.
- Ia adalah immunoglobulin pertama yang mensintesiskan manusia.
Immunoglobulin a
- Ia bertindak sebagai penghalang pertahanan terhadap patogen, ketika terletak di permukaan membran mukus.
- Ia terdapat dalam mukosa pernafasan, sistem pencernaan, saluran kencing dan juga dalam rembesan seperti air liur, lendir hidung dan air mata.
- Walaupun pengaktifan pelengkapnya rendah, ia boleh dikaitkan dengan kelancaran untuk menghapuskan bakteria.
- Kehadiran immunoglobulin d kedua -duanya dalam susu ibu dan di Caloster membolehkan bayi yang baru lahir untuk memperolehnya semasa menyusu.
Immunoglobulin e
- Immunoglobulin dan menyediakan mekanisme pertahanan yang kuat terhadap pengeluar alahan yang menghasilkan.
- Interaksi IgE dan alergen akan membuat bahan keradangan yang bertanggungjawab terhadap gejala alahan, seperti bersin, batuk, sarang, peningkatan air mata dan lendir hidung.
- IgE juga boleh ditambah ke permukaan parasit melalui segmen FCnya, menghasilkan reaksi yang menghasilkan kematian ini.
Immunoglobulin d
- Struktur monomerik IgD dikaitkan dengan limfosit B yang tidak berinteraksi dengan antigen, jadi mereka melaksanakan fungsi reseptor.
- Fungsi IGD tidak jelas.

