Ciri -ciri leucine, struktur, fungsi, biosintesis
- 4014
- 752
- Delbert Dare
The Leucine Ia adalah salah satu daripada 22 asid amino yang membentuk protein organisma hidup. Ini adalah salah satu daripada 9 asid amino penting yang tidak disintesis oleh badan dan mesti dimakan dengan makanan yang ditelan dalam diet.
Leucina pertama kali diterangkan pada tahun 1818 oleh ahli farmasi dan ahli kimia Perancis. L. Proust, yang menyebutnya "Kasasan Oksida". Kemudian, Erlenmeyer dan Kunlin, menyiapkannya dari α-benzoilamido-β-isopropilacrylic acid, yang formula molekulnya ialah C6H13NO2NO2.
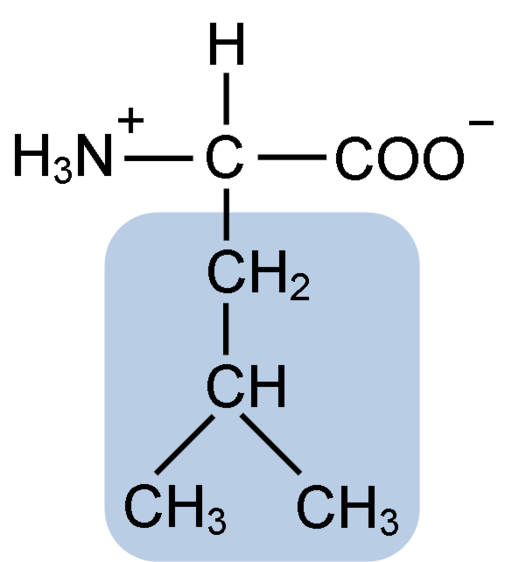
 Struktur Kimia Asid Amino Leucine (Fuene: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons)
Struktur Kimia Asid Amino Leucine (Fuene: Clavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] melalui Wikimedia Commons) Leucine adalah kunci semasa penemuan rasa terjemahan protein, kerana struktur hidrofobiknya membenarkan biokimia Howard Dentzis untuk menandakan hidrogen karbon 3 dan memerhatikan makna di mana asid amino dimasukkan ke dalam sintesis peptida hemoglobin.
Protein yang dikenali sebagai "zip" atau "penutupan" Leucina, bersama -sama dengan "jari zink", faktor transkripsi yang paling penting bagi organisma eukariotik. Zipper leucine dicirikan oleh interaksi hidrofobik mereka dengan DNA.
Umumnya, protein yang kaya dengan leucine atau yang dibentuk oleh asid amino bercabang tidak dimetabolisme di hati, sebaliknya, mereka pergi terus ke otot di mana mereka cepat digunakan untuk sintesis protein dan mendapatkan tenaga.
Leucine adalah asid amino rantai bercabang yang diperlukan untuk biosintesis protein dan asid amino susu, yang disintesis dalam kelenjar payudara. Anda boleh menemui sejumlah besar asid amino percuma ini di dalam susu ibu.
Di antara semua asid amino yang membentuk protein, leucine dan arginine adalah yang paling banyak dan kedua -duanya telah dikesan dalam protein semua kerajaan yang membentuk pokok kehidupan.
[TOC]
Ciri -ciri
Leucine dikenali sebagai asid amino penting rantai bercabang, ia berkongsi struktur biasa dengan asid amino yang lain. Walau bagaimanapun, ia dibezakan kerana rantaian sampingannya atau kumpulan r mempunyai dua karbon yang dikaitkan, dan yang terakhir dikaitkan dengan atom hidrogen dan dua kumpulan metil.
Ia tergolong dalam kumpulan asid amino kutub tanpa beban, substituen atau kumpulan R asid amino ini adalah sifat hidrofobik dan bukan -polar. Asid amino ini adalah yang bertanggungjawab utama untuk interaksi hidrofobik intra-proteik dan cenderung menstabilkan struktur protein.
Semua asid amino, yang mempunyai karbon pusat yang kiral (karbon α), iaitu, ia mempunyai empat substituen bersatu yang berbeza, mereka boleh didapati dalam dua cara yang berbeza; Oleh itu, terdapat d- dan l-leucina, yang terakhir dalam struktur protein.
Kedua -dua bentuk setiap asid amino mempunyai sifat yang berbeza, mengambil bahagian dalam laluan metabolik yang berbeza dan bahkan dapat mengubah ciri -ciri struktur yang mana mereka adalah sebahagian.
Contohnya, leucine di l-leucina mempunyai rasa yang sedikit pahit, sementara dalam bentuk d-leucinnya sangat manis.
Bentuk asid amino lebih mudah untuk dimetabolisme oleh badan mamalia. L-Leucina mudah terdegradasi dan dieksploitasi untuk pembinaan dan perlindungan protein.
Struktur
Leucine terdiri daripada 6 atom karbon. Karbon pusat, biasa dalam semua asid amino, dikaitkan dengan kumpulan karboksil (COOH), kumpulan amino (NH2), atom hidrogen (H) dan rantaian sampingan atau kumpulan r yang terdiri daripada 4 atom karbon.
Boleh melayani anda: MesothelioAtom karbon dalam asid amino dapat dikenal pasti dengan huruf Yunani. Penomboran bermula dari karbon asid karboksilik (COOH), sementara penjelasan dengan abjad Yunani bermula dari karbon pusat.
Leucine mempunyai sebagai kumpulan substituen dalam r rantai R ke kumpulan isobutil atau 2-methylpropil yang dihasilkan oleh kehilangan atom hidrogen, dengan pembentukan radikal alkil; Kumpulan ini muncul sebagai ramalan dalam struktur asid amino.
Fungsi
Leucine adalah asid amino yang boleh berfungsi sebagai prekursor ketogenik sebatian lain yang terlibat dalam kitaran asid sitrik. Asid amino ini merupakan sumber penting untuk sintesis asetil-CoA atau acetoacetyl-CoA, yang merupakan sebahagian daripada laluan pembentukan badan keton dalam sel hati.
Telah diketahui bahawa leucine sangat diperlukan dalam laluan isyarat insulin, yang mengambil bahagian dalam permulaan sintesis protein dan mengelakkan kehilangan protein akibat kemerosotan.
Biasanya, struktur dalaman protein terdiri daripada asid amino hidrofobik seperti leucin, valine, isoleucine dan metodin. Struktur sedemikian biasanya dipelihara untuk enzim biasa di kalangan organisma hidup, seperti dalam kes cytochrome c.
Leucine boleh mengaktifkan laluan metabolik dalam sel kelenjar susu untuk merangsang sintesis laktosa, lipid dan protein yang memenuhi fungsi seperti molekul isyarat dalam peraturan homeostasis tenaga muda dalam mamalia.
Domain kaya leucine adalah bahagian penting dari protein mengikat DNA tertentu, yang umumnya diameter struktur dalam cara yang sangat mendaftar dan yang dikenali sebagai "protein zip leucine".
Protein ini mempunyai ciri tersendiri corak leucin yang berulang -ulang bersama -sama dengan asid amino hidrofobik lain yang bertanggungjawab untuk mengawal selia kesatuan faktor transkripsi kepada DNA dan antara faktor transkripsi yang berbeza.
Protein zip leucin boleh membentuk homo-atau heterodimer yang membolehkan mereka.
Biosintesis
Semua asid amino rantai bercabang, termasuk leucine, terutamanya disintesis dalam tumbuh -tumbuhan dan bakteria. Dalam tumbuhan berbunga terdapat peningkatan yang ketara dalam pengeluaran leucine, kerana ia merupakan pendahulu penting untuk semua sebatian yang bertanggungjawab untuk aroma bunga dan buah -buahan.
Salah satu faktor yang dikaitkan dengan kelimpahan leucine yang besar dalam peptida bakteria yang berbeza ialah 6 kodon kod genetik yang berlainan untuk leucine (UUA-UUG-UUG-UCU-CUC-CUA-CUG), yang sama juga berlaku untuk arginine.
Leucine disintesis dalam bakteria dari laluan lima langkah yang digunakan sebagai titik permulaan Ketacid yang berkaitan dengan valin.
Proses ini dikawal dari secara alosterik, sehingga apabila terdapat lebihan leucine di dalam selular, ia menghalang enzim yang mengambil bahagian dalam laluan dan menghentikan sintesis.
Boleh melayani anda: Indeks Simpson: Formula, Tafsiran dan ContohLaluan biosintetik
Biosintesis leucine dalam bakteria bermula dengan penukaran ketacid derivatif valin, 3-methyl-2-oxobutanoat dalam (2s) -2-isopropilmalate, terima kasih kepada tindakan enzim 2-isopropilmalto synta, yang menggunakan acetyl -Coa dan air untuk tujuan itu.
(2s) -2-isopropilmalaate kehilangan molekul air dan diubah menjadi 2-isopropilmaleate oleh 3-isopropylmalate dehydratase. Seterusnya, enzim yang sama menambah molekul air lain dan mengubah 2-isopropilmaleato ke (2R-3s) -3-isopropilm.
Kompaun yang kedua tertakluk kepada tindak balas oksidora yang merangkumi penyertaan molekul NAD+, yang menghasilkan (2S) -2-isopropil-3-oxosuccination, yang mungkin dengan penyertaan enzim 3- isopropilmalato delebrogenase.
The (2s) -2-osopropyl-3-oxosuccination kehilangan atom karbon dalam bentuk CO2 secara spontan, menghasilkan 4-metil-2-oxopentanoate yang, dengan tindakan transaminase asid amino rantai bercabang (transaminase leucine, khususnya) Dan dengan pembebasan bersamaan L-glutamat dan 2-oxoglutarate, ia menghasilkan L-leucina.
Degradasi
Peranan utama leucine adalah bertindak sebagai isyarat yang memberitahu sel bahawa terdapat asid amino yang mencukupi dan tenaga untuk memulakan sintesis protein otot.
Degradasi asid amino rantai bercabang sebagai leucine bermula dengan transaminasi. Ini dan kedua -dua langkah enzimatik berikutnya dipangkin oleh tiga enzim dalam kes leucine, isoleucine dan valine.
Transaminasi tiga asid amino menghasilkan derivatif α-ecotoacidic ini, yang tertakluk kepada decarboxylation oksidatif untuk menghasilkan acyl-CoA thioés yang α, β-disshydrogenated untuk melaksanakan thioés de acil-coa α, β-sation.
Semasa katabolisme leucine, acyl-CoA yang sepadan, β-insaturated β-insatura (HMG-CoA), yang merupakan perantara dalam biosintesis kolesterol dan isoprenoid lain.
Laluan katabolik Leucina
Dari pembentukan paman acyl-CoA α, β-instritated yang berasal dari leucine laluan katabolik asid amino ini dan valin dan isoleucine menyimpang dengan ketara.
Acyl-CoA Ucion α, leucina yang ditetapkan β diproses hiliran oleh tiga enzim yang berbeza yang dikenali sebagai (1) 3-methylcrotonyl-CoA carboxylase, (2) 3-methylglutonil-CoA hydratasa dan (3) 3-hydroxi -3-methylglutaril -Coa liasa.
Dalam bakteria, enzim-enzim ini bertanggungjawab untuk penukaran 3-methylcrotonyl-CoA (derivatif leucine) dalam 3-methylglutaconil-CoA, dalam 3-hydroxy-3-methylglutaril-CoA dan dalam acetoacetate dan acetyl-CoA, masing-masing.
Leucine yang terdapat dalam darah dieksploitasi untuk sintesis protein otot/myofibrillary (MPS). Ini bertindak sebagai faktor pengaktifan proses ini. Juga, berinteraksi secara langsung dengan insulin, mempengaruhi bekalan
Makanan kaya leucine
Penggunaan protein asid amino yang kaya sangat diperlukan untuk fisiologi selular organisma hidup dan leucine tidak terkecuali di kalangan asid amino penting.
Protein yang diperolehi dari serum tenusu dianggap paling kaya dalam sisa L-Leucina. Walau bagaimanapun, semua makanan dengan kandungan protein yang tinggi seperti ikan, ayam, telur dan daging merah memberikan banyak leucine untuk badan.
Boleh melayani anda: Pengeluaran semula virus: fasa dan ciriJagung dalam bijirin adalah miskin dalam asid amino lisin dan tryptophan, ia mempunyai struktur tersier yang sangat tegar untuk pencernaan dan mempunyai sedikit nilai dari sudut pemakanan, bagaimanapun, ia mempunyai tahap leucine dan isoleucin yang tinggi.
Buah -buahan tumbuhan kacang tanah kaya dengan hampir semua asid amino penting: lysine, treonine, isoleucine, leucine, phenylalanine dan valine, tetapi mempunyai sedikit kandungan metodin dan sistein.
Leucine diekstrak, disucikan dan tertumpu dalam tablet sebagai suplemen makanan untuk atlet persaingan yang tinggi dan dipasarkan sebagai ubat. Sumber utama untuk pengasingan asid amino ini sepadan dengan tepung soya soya.
Terdapat suplemen pemakanan yang digunakan oleh atlet untuk pertumbuhan semula otot yang dikenali sebagai BCAA (Bahasa Inggeris "Asid amino rantai bercabang "). Ini memberikan kepekatan tinggi asid amino rantai bercabang: leucina, valina dan isoleucine.
Faedah pengambilan anda
Makanan kaya leucine membantu mengawal obesiti dan penyakit metabolik lain. Ramai pakar pemakanan menunjukkan bahawa makanan yang kaya dengan suplemen leucine dan pemakanan berdasarkan asid amino ini menyumbang kepada peraturan selera makan dan kecemasan pada orang dewasa.
Semua protein leucin -rich merangsang sintesis protein otot; Telah ditunjukkan bahawa peningkatan dalam perkadaran leucine yang ditelan berkenaan dengan asid amino penting yang lain dapat membalikkan pelemahan sintesis protein dalam otot pesakit tua.
Malah orang yang mempunyai gangguan makula yang serius yang lumpuh dapat menghentikan kehilangan kekuatan massa dan otot dengan suplemen leucine oral yang betul, selain menggunakan latihan sistemik rintangan otot.
Leucine, valine dan isoleucine adalah komponen penting jisim yang membentuk otot rangka haiwan vertebrata, jadi kehadiran mereka adalah penting untuk sintesis protein baru atau untuk pembaikan pra -sedia ada.
Gangguan kekurangan
Kekurangan atau kecacatan kompleks dehidrogenase α-zo-stoat, yang bertanggungjawab untuk memetabolisme leucine, valine dan isoleucine pada manusia, boleh menyebabkan gangguan mental yang teruk.
Di samping itu, terdapat keadaan patologi yang berkaitan dengan metabolisme asid amino rantai bercabang ini yang disebut "penyakit air kencing dengan bau sirap arce".
Sehingga kini, kewujudan kesan buruk terhadap penggunaan leucine yang berlebihan belum ditunjukkan. Walau bagaimanapun, dos maksimum 550 mg/kg setiap hari adalah disyorkan, kerana tidak ada kajian panjang yang berkaitan dengan pendedahan tisu yang berlebihan kepada asid amino tersebut.
Rujukan
- Álava, m. D. C., Camacho, m. Dan., & Delgadillo, J. (2012). Kesihatan otot dan pencegahan sarcopenia: kesan protein, leucin dan ß-hydroxy-methylbutirate. Majalah Metabolisme Tulang dan Mineral, 10(2), 98-102.
- Phenheme, atau. R. (1993). Kimia Makanan (Tidak. 664: 543). Rayuan.
- Massey, l. K., Sokatch, j. R., & Conrad, r. S. (1976). Rantaian bercabang Catabolisme asid aminino dalam bakteria. Ulasan Bacteriological, 40(1), 42.
- Mathews, c. K., & Ahern, k. G. (2002). Biokimia. Pendidikan Pearson.
- Mere, a. (1999). Suplemen leucine dan latihan intensif. Perubatan Sukan, 27(6), 347-358.
- Munro, h. N. (Ed.). (2012). Metabolisme protein mamalia (Vol. 4). Elsevier
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Prinsip Biokimia Lehninger. Macmillan.

