Formula dan Unit Undang -undang Charles, Eksperimen, Latihan

- 2771
- 673
- Erick Krajcik
The Charles Law Atau Guy-Lussac adalah salah satu yang membolehkan pernyataan salah satu sifat keadaan gas: jumlah yang menduduki gas berkadar terus dengan suhu pada tekanan malar.
Perkadaran ini adalah linear untuk semua julat suhu jika gas yang dipersoalkan adalah ideal; Gas -gas diraja, sebaliknya, menyimpang dari trend linear pada suhu yang dekat dengan titik pemeluwapan mereka. Walau bagaimanapun, ini tidak membatasi penggunaan undang -undang ini untuk aplikasi yang tidak berkesudahan di mana gas mengambil bahagian.
 Lentera Cina atau keinginan. Sumber: Pxhere.
Lentera Cina atau keinginan. Sumber: Pxhere. Salah satu kecemerlangan undang -undang Charles adalah kehadiran dalam belon aerodinamik. Belon lain yang lebih mudah, seperti keinginan, juga dikenali sebagai lampu Cina.
Mengapa tekanan berterusan? Kerana jika tekanan meningkat, ini bermakna bahawa bekas di mana gas terletak ditutup dengan ketat; Dan dengan ini, perlanggaran atau kesan zarah gas terhadap dinding dalaman bekas tersebut (Boyle-Maleotte Law) akan meningkatkan perlanggaran atau kesan zarah dalaman (Boyle-Maleotte Law).
Oleh itu, tidak akan ada perubahan dalam jumlah yang diduduki oleh gas, dan undang -undang Charles tidak akan menjadi ketat. Bertentangan dengan bekas hermetik, tisu belon keinginan mewakili penghalang mudah alih, yang mampu mengembang atau berkontrak bergantung kepada tekanan yang dikenakan oleh gas di dalamnya.
Walau bagaimanapun, apabila tisu belon mengembang, tekanan dalaman gas tetap berterusan kerana ia meningkatkan kawasan di mana zarahnya berlanggar. Semakin tinggi suhu gas, semakin besar tenaga kinetik zarah, dan oleh itu, bilangan perlanggaran.
Dan apabila dunia berkembang lagi, perlanggaran terhadap dinding dalamannya tetap malar (idealnya).
Oleh itu, semakin panas gas, semakin besar pengembangan dunia dan semakin meningkat. Hasilnya: lampu kemerahan (walaupun berbahaya) digantung di langit pada waktu malam Disember.
[TOC]
Apa itu Undang -undang Charles?
Penyata
Undang-undang Charles atau Undang-undang Gay-Lussac yang dipanggil Berkenaan Ketergantungan yang Ada Di antara Jumlah yang Diduduki oleh Gas dan Nilai Suhu Mutlak atau Suhu Kelvin.
Undang -undang boleh dinyatakan seperti berikut: Jika tekanan tetap malar, ia dipenuhi bahawa "untuk jisim gas yang diberikan, ia meningkatkan jumlahnya sebanyak 1/273 kali kira ) yang meningkatkan suhunya ".
Pekerjaan
Kerja-kerja penyelidikan yang membolehkan penubuhan undang-undang dimulakan pada tahun 1780-an oleh Jacques Alexander Cesar Charles (1746-1823). Walau bagaimanapun, Charles tidak menerbitkan hasil siasatannya.
Selanjutnya, John Dalton pada tahun 1801 berjaya secara eksperimen menentukan bahawa semua gas dan wap, yang dikaji olehnya, mengembangkan antara dua suhu yang ditentukan dalam jumlah yang sama. Keputusan ini disahkan oleh gay-lussac pada tahun 1802.
Kerja-kerja penyelidikan Charles, Dalton dan Gay-Lussac, dibenarkan untuk menegaskan bahawa jumlah yang diduduki oleh gas dan suhu mutlaknya berkadar terus. Oleh itu, terdapat hubungan linear antara suhu dan jumlah gas.
Ia dapat melayani anda: Kaedah pemisahan campuran heterogenGraf
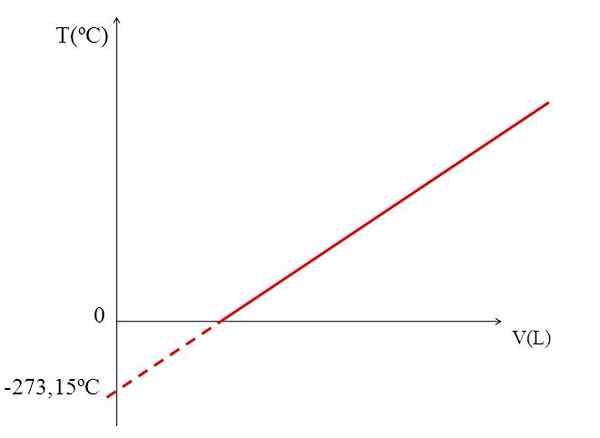 Graf t vs v untuk gas yang ideal. Sumber: Gabriel Bolívar.
Graf t vs v untuk gas yang ideal. Sumber: Gabriel Bolívar. Kesedaran graf (imej atas) dari jumlah gas terhadap suhu menghasilkan garis lurus. Persimpangan garis dengan paksi x, pada suhu 0 ºC, membolehkan untuk mendapatkan isipadu gas pada 0 ºC.
Begitu juga, persimpangan garis dengan paksi x, akan memberikan maklumat mengenai suhu yang mana jumlahnya diduduki oleh gas akan menjadi sifar "0". Dalton menganggarkan nilai ini pada -266 ºC, dekat dengan nilai yang dicadangkan oleh Kelvin untuk mutlak (0) mutlak.
Kelvin mencadangkan skala suhu yang sifarnya harus suhu di mana gas yang sempurna akan mempunyai jumlah sifar. Tetapi pada suhu rendah ini gas -gas cair.
Itulah sebabnya kita tidak boleh bercakap mengenai jumlah gas seperti itu, mendapati bahawa nilai untuk sifar mutlak harus -273.15 ºC.
Formula dan Unit Pengukuran
Formula
Undang -undang Charles dalam versi modennya menunjukkan bahawa jumlah dan suhu gas berkadar terus.
Jadi:
V / t = k
V = jumlah gas. T = suhu Kelvin (k). K = pemalar berkadar.
Untuk volum v1 dan suhu t1
k = v1 / T1
Juga, untuk volum v2 dan suhu t2
k = v2 / T2
Kemudian, memadankan dua persamaan untuk k yang anda ada
V1 / T1 = V2 / T2
Formula ini boleh ditulis seperti berikut:
V1 · T2 = V2 · T1
Membersihkan v2, Formula diperoleh:
V2 = V1 · T2 / T1
Unit
Jumlah gas boleh dinyatakan dalam liter atau di mana -mana unit yang diperolehi. Begitu juga, jumlahnya boleh dinyatakan dalam meter padu atau di mana -mana unit yang diperoleh. Suhu mesti dinyatakan dalam suhu mutlak atau suhu kelvin.
Oleh itu, jika suhu gas dinyatakan dalam skala Celsius atau Celsius, untuk melakukan pengiraan dengan mereka, jumlah 273.15 ºC perlu ditambah kepada suhu, untuk membawa mereka ke suhu mutlak atau Kelvin.
Sekiranya suhu dinyatakan dalam darjah Farenheit, ia harus ditambah kepada suhu tersebut 459.67 ºR, untuk membawa mereka ke suhu mutlak pada skala Rankine.
Satu lagi formula undang -undang Charles yang diketahui, dan secara langsung berkaitan dengan kenyataannya, adalah seperti berikut:
Vt = VSama ada (1 + t/273)
Di mana vt Ia adalah jumlah yang diduduki oleh gas pada suhu tertentu, dinyatakan dalam liter, cm3, dan lain-lain.; dan vSama ada Ia adalah jumlah yang diduduki oleh gas pada 0 ºC. Bagi bahagiannya, T adalah suhu di mana pengukuran kelantangan dibuat, dinyatakan dalam darjah Celsius (ºC) (ºC).
Dan akhirnya, 273 mewakili nilai sifar mutlak pada skala suhu Kelvin.
Percubaan untuk menunjukkan undang -undang
Pemasangan
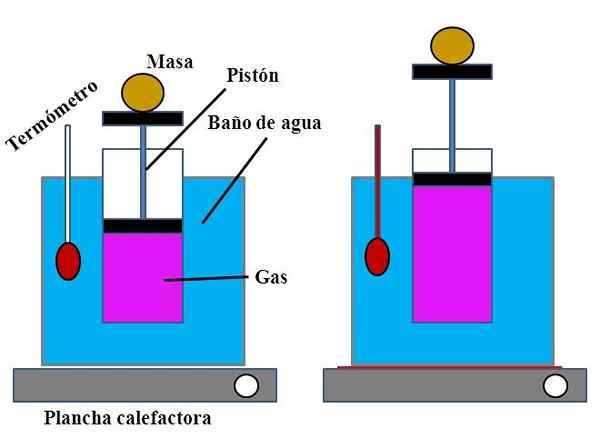 Perhimpunan percubaan untuk menunjukkan undang -undang Charles. Sumber: Gabriel Bolívar.
Perhimpunan percubaan untuk menunjukkan undang -undang Charles. Sumber: Gabriel Bolívar. Di dalam bekas air, yang memenuhi fungsi mandi air, silinder terbuka diletakkan di bahagian atasnya, dengan pelocok yang disesuaikan dengan dinding dalaman silinder (imej unggul).
Pelocok ini (dibentuk oleh omboh dan dua pangkalan hitam) boleh bergerak ke bahagian atas atau bawah silinder bergantung pada jumlah gas yang terkandung.
Mandi air boleh dipanaskan dengan menggunakan loji pemanasan atau pemanasan, yang membekalkan haba yang diperlukan untuk meningkatkan suhu bilik mandi dan oleh itu, suhu silinder yang dilengkapi dengan pelocok.
Boleh melayani anda: kalsium hidroksida (Ca (OH) 2): struktur, sifat, mendapatkan, menggunakanPada pelocok jisim tertentu diletakkan untuk memastikan percubaan itu dijalankan pada tekanan tetap. Suhu bilik mandi dan silinder diukur dengan menggunakan termometer yang diletakkan di dalam mandi air.
Walaupun mungkin silinder tidak mempunyai tamat pengajian untuk memvisualisasikan jumlah udara, ini dapat dianggarkan dengan mengukur ketinggian jisim yang diletakkan pada pelocok dan permukaan pangkalan silinder.
Pembangunan
Jumlah silinder diperoleh dengan mengalikan permukaan pangkalannya dengan ketinggiannya. Permukaan asas silinder boleh diperolehi dengan menggunakan formula: s = pi x r r2.
Walaupun ketinggian diperoleh dengan mengukur jarak dari pangkal silinder, ke omboh di mana dohnya terletak.
Apabila suhu bilik mandi meningkat oleh haba yang dihasilkan oleh lebih ringan, diperhatikan bahawa pelocok naik di dalam silinder. Kemudian, mereka membaca suhu di dalam mandi air di termometer, yang sesuai dengan bahagian dalam silinder.
Mereka juga mengukur ketinggian doh pada plunger, dapat menganggarkan jumlah udara yang sesuai dengan suhu yang diukur. Dengan cara ini mereka membuat beberapa pengukuran suhu dan anggaran jumlah udara yang sepadan dengan setiap suhu.
Ini akhirnya dapat menegaskan bahawa jumlah yang diduduki oleh gas berkadar terus dengan suhunya. Kesimpulan ini dibenarkan untuk menyatakan undang -undang Charles yang dipanggil.
Globo dengan ais pada musim sejuk
Sebagai tambahan kepada eksperimen sebelumnya, terdapat lebih mudah dan lebih kualitatif: balon dengan ais pada musim sejuk.
Jika pada musim sejuk belon penuh helium di dalam bilik dengan pemanasan diletakkan, dunia akan mempunyai jumlah tertentu; Tetapi, jika kemudian berpindah ke bahagian luar rumah dengan suhu yang rendah, ia akan diperhatikan bahawa belon helium mengecut, mengurangkan jumlahnya mengikut undang -undang Charles.
Latihan yang diselesaikan
Latihan 1
Anda mempunyai gas yang menduduki jumlah 750 cm3 pada 25 ºC: Apakah kelantangan gas ini menduduki 37 ºC jika tekanan malar dikekalkan?
Perlu terlebih dahulu mengubah unit suhu ke Kelvin:
T1 Dalam darjah Kelvin = 25 ºC + 273.15 ºC = 298.15 k
T2 Dalam darjah Kelvin = 37 ºC + 273.15 ºC = 310.15 k
Kerana ia dikenali v1 Dan pembolehubah lain, ia membersihkan v2 Dan ia dikira dengan persamaan berikut:
V2 = V1 · (T2 / T1)
= 750 cm3 · (310.15 K / 298.15 K)
= 780.86 cm3
Latihan 2
Apa yang akan menjadi suhu dalam darjah Celsius yang mana 3 liter gas harus dipanaskan hingga 32 ° C, sehingga jumlahnya berkembang hingga 3.2 liter?
Sekali lagi, darjah Celsius di Kelvin berubah:
T1 = 32 ºC + 273.15 ºC = 305.15 k
Dan seperti dalam latihan sebelumnya, t dibersihkan2 Bukan v2, dan kemudian mengira:
T2 = V2 · (T1 / V1)
= 3.2 l · (305.15 K / 3 l)
= 325.49 k
Tetapi pernyataan itu meminta ijazah Celsius, jadi unit t diubah2:
T2 Dalam darjah Celsius = 325, 49 º C (k) - 273.15 ºC (k)
Boleh melayani anda: suntikan pascal= 52.34 ºC
Latihan 3
Sekiranya gas pada 0 ºC menduduki jumlah 50 cm3, Jumlah kelantangan yang akan ditempati pada 45 ºC?
Menggunakan formula asal Undang -undang Charles:
Vt = VSama ada (1 + t /273)
Teruskan untuk mengira vt secara langsung apabila anda melupuskan semua pembolehubah:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (k))
= 58.24 cm3
Sebaliknya, jika masalah diselesaikan menggunakan strategi contoh 1 dan 2, kita akan mempunyai:
V2 = V1 · (T2 / T1)
= 318 K · (50 cm3 / 273 k)
= 58.24 cm3
Hasilnya, menerapkan dua prosedur, adalah sama kerana mereka akhirnya berdasarkan prinsip yang sama dari Charles Law.
Aplikasi
Wishe galls
Belon hasrat (sudah disebut dalam pengenalan) dilengkapi dengan bahan tekstil yang diresapi dengan cecair mudah terbakar.
Apabila kebakaran membakar bahan ini, terdapat peningkatan suhu udara yang terkandung di dunia, yang menyebabkan peningkatan jumlah gas mengikut undang -undang Charles.
Oleh itu, dengan meningkatkan jumlah udara di dunia, ketumpatan udara berkurangan di dalamnya, yang dibuat kurang daripada ketumpatan udara sekitar, dan itulah sebabnya dunia naik.
Termometer atau ayam belanda pop timbul
Seperti yang ditunjukkan dengan namanya mereka digunakan semasa memasak ayam belanda. Thermometer mempunyai bekas yang penuh dengan udara tertutup dengan tudung dan ditentukur sedemikian rupa sehingga ketika mencapai suhu memasak yang optimum, tudung itu diangkat dengan memancarkan bunyi.
Termometer diletakkan di dalam ayam belanda, dan apabila suhu meningkat di dalam ketuhar, udara di dalam termometer berkembang, meningkatkan jumlahnya. Oleh itu, apabila jumlah udara mencapai nilai tertentu, ia menjadikan angkat termometer mengangkat.
Pemulihan bentuk bola ping-pong
Bola ping-pong bergantung kepada keperluan penggunaannya, mempunyai berat ringan dan dinding plastik mereka sedikit tebal. Ini menjadikan mereka terpengaruh oleh raket yang mengalami deformasi.
Dengan meletakkan bola cacat dalam air panas, udara di dalamnya dipanaskan dan pengembangannya berlaku, yang membawa kepada peningkatan jumlah udara. Ini juga menyebabkan dinding bola ping-pong, yang membolehkan pemulihan bentuk asalnya.
Penjelasan paes
Ragi dimasukkan ke dalam tepung gandum yang digunakan untuk membuat roti dan mempunyai keupayaan untuk menghasilkan gas karbon dioksida.
Dengan meningkatkan suhu roti semasa memasak, jumlah karbon dioksida meningkat. Kerana ini pengembangan roti berlaku sehingga jumlah yang dikehendaki dicapai.
Rujukan
- Clark J. (2013). Undang -undang Gas Oter - Undang -undang Boyle dan Undang -undang Charles. Pulih dari: chemguide.co.UK
- Staroscik Andrew. (2018). Undang -undang Charles. Diperolehi dari: ScientePrimer.com
- Wikipedia. (2019). Charles Law. Diperoleh dari: dalam.Wikipedia.org
- Helmestine, Todd. (27 Disember 2018). Apakah formula untuk undang -undang Charles? Pulih dari: Thoughtco.com
- Prof. N. Daripada singa. (s.F.). Undang -undang Gas Rendah: Charles Law. C 101 Nota Kelas. Pulih dari: iun.Edu
- Briceño Gabriela. (2018). Charles Law. Pulih dari: euston96.com
- Morris, j. G. (1974). Fizikokimia untuk ahli biologi. (2memberi edisi). Editorial reverté, s.Ke.
- « Empat belas titik latar belakang Wilson dan bagaimana ia mempengaruhi Jerman
- Aplikasi konsep tenaga, kuasa, kekuatan, kerja »

