Undang -undang Henry

- 4826
- 1295
- Horace Gulgowski
 Undang -undang Henry menerangkan minuman ringan
Undang -undang Henry menerangkan minuman ringan Apa itu undang -undang Henry?
The Undang -undang Henry Ini adalah hubungan yang menggambarkan kesan tekanan terhadap kelarutan gas. Undang -undang ini menetapkan bahawa kelarutan gas yang bersentuhan dengan permukaan cecair pada suhu tertentu adalah berkadar terus dengan tekanan separa gas tersebut pada cecair.
Ini bermakna, semakin besar tekanan gas pada cecair, semakin besar jumlah gas yang dapat dibubarkan di dalamnya, dengan itu memperoleh kepekatan yang lebih besar (iaitu, semakin besar kelarutan).
Undang -undang Henry kita melihatnya dalam tindakan setiap kali kita mendedahkan minuman soda. Ditutup, tekanan tinggi di dalam botol menyimpan gas karbonik dibubarkan. Tetapi dengan mengungkapnya, tekanan gas berkurangan, yang mengurangkan kelarutannya dan melarikan diri dari gelembung dan effervescence.
Formula Hukum Henry
Dalam bentuk matematik, undang -undang Henry dinyatakan sebagai undang -undang yang berkadar:
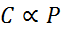
Undang -undang berkadar ini berubah menjadi:
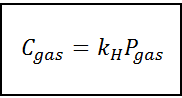
Di mana C Ia merujuk kepada kepekatan maksimum gas dalam cecair, iaitu kelarutannya; Pgas Ia adalah tekanan separa gas yang bersentuhan dengan cecair dan kH Ia adalah pemalar berkadar yang dipanggil Undang -undang Henry tetap.
Kepekatan gas boleh dinyatakan dalam unit yang berbeza seperti molariti, moleity atau pecahan molar. Walau bagaimanapun, dalam kebanyakan kes, bahan kimia menggunakan kepekatan dalam unit molariti (dalam mol/l), sementara tekanan dinyatakan dalam atmosfera.
Boleh melayani anda: anthracene: apakah, struktur, sifat, kegunaanPemalar undang -undang Henry (kH)
Pemalar kH Terangkan interaksi antara gas dan pelarut. Semakin kuat interaksi ini, semakin besar pemalar dan, oleh itu, semakin besar kelarutan gas dalam pelarut pada suhu dan tekanan tertentu.
Secara numerik, nilai kH mewakili kelarutan gas pada suhu yang diberikan, apabila tekanan separa yang sama adalah 1 atm.
Bergantung pada unit kepekatan dan tekanan yang digunakan dalam persamaan, pemalar ini boleh mempunyai unit mol/l.ATM, mol/kg.atm, dll.
Jadual berikut menunjukkan nilai -nilai pemalar undang -undang Henry untuk beberapa gas biasa di dalam air pada suhu 25 ° C:

Nilai -nilai ini berkurangan dengan suhu, kerana kelarutan gas secara umum berkurangan pada suhu yang lebih tinggi.
Penjelasan Undang -undang Henry
Undang -undang Henry sangat mudah difahami dari sudut pandangan mikroskopik. Kita boleh membayangkan gas sebagai satu set zarah yang sangat kecil memantul di semua permukaan yang dimainkan. Apabila mereka bertembung dengan permukaan cecair, beberapa zarah akan melantun, sementara yang lain akan menyeberangi permukaan yang terperangkap (iaitu, mereka akan membubarkan).
Begitu juga untuk zarah gas yang dibubarkan. Mereka melantun dengan dinding bekas dan juga boleh mencapai permukaan cecair, di mana ada yang akan melantun sementara yang lain akan menyeberangi permukaan dan melarikan diri ke fasa gas.
Apabila keseimbangan dicapai, kelajuan yang gas larut dalam pelarut dan yang mana ia melarikan diri adalah sama, jadi kepekatan tetap tetap.
Boleh melayani anda: Sifat mekanikal logam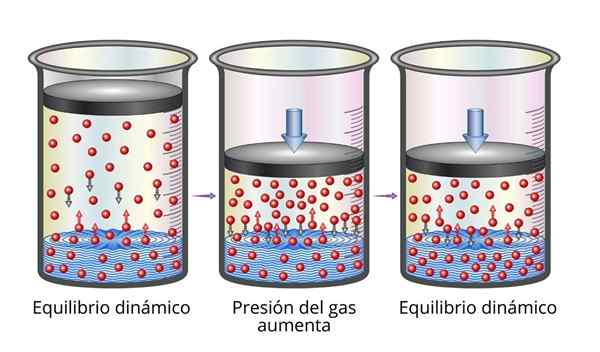 Penjelasan Undang -undang Henry
Penjelasan Undang -undang Henry Apabila kita meningkatkan tekanan gas, apa yang kita lakukan adalah untuk meningkatkan kekerapan yang mana zarah gas bertabrakan dengan permukaan cecair. Ini menjadikan kelajuan yang gas larut meningkat. Apabila keseimbangan baru dicapai, kepekatan gas baru akan lebih besar.
Pengecualian terhadap undang -undang Henry
Penting untuk menyerlahkan bahawa undang -undang Henry adalah undang -undang yang ideal, yang hanya menggambarkan tingkah laku penyelesaian gas sebenar dalam keadaan tertentu. Oleh itu, undang -undang Henry hanya boleh digunakan apabila:
- Suhu tetap berterusan.
- Gas seimbang dengan penyelesaiannya.
- Tekanan gas agak rendah.
- Gas tidak bertindak balas dengan pelarut.
Walaupun begitu, walaupun dalam beberapa kes di mana gas bertindak balas dengan pelarut, undang -undang ini boleh digunakan lebih kurang.
Contoh permohonan undang -undang Henry
Contoh 1: Penentuan Undang -undang Henry yang Pemalar
Ia secara eksperimen ditentukan bahawa kepekatan larutan berair seimbang dengan neon pada tekanan 3.00 atm dan 25 ° C ialah 0.00135 mol/l. Tentukan pemalar undang -undang Henry untuk neon di dalam air pada suhu 25 ° C.
Penyelesaian:
Menurut undang -undang Henry:
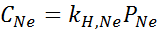
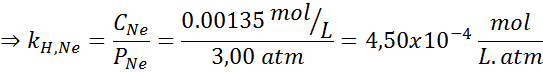
Oleh itu, undang -undang Henry tetap untuk neon di dalam air pada suhu 25 ° C ialah 4.50 × 10-4 mol/l.Atm.
Contoh 2: Penentuan Kelarutan Gas
Menggunakan pemalar undang -undang Henry yang disediakan dalam jadual sebelumnya, tentukan kelarutan karbon dioksida udara di dalam air di paras laut, mengetahui bahawa pecahan molar gas di udara adalah 3.14 × 10-4.
Penyelesaian:
Di paras laut, tekanan udara adalah 1 atm, dan tekanan separa CO2 Ia diberikan oleh:
Ia boleh melayani anda: asid hypoyodous (HIO)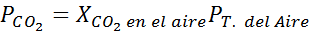
Menggantikan ungkapan ini dalam undang -undang Henry:
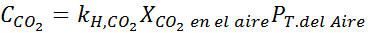
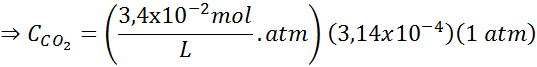
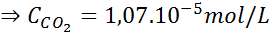
Contoh 3: Gas menyelam
Apabila penyelam tidak ada kedalaman lebih besar daripada 30 meter, campuran udara mesti bernafas dengan gas lengai lain seperti helium atau argon, kerana peningkatan kepekatan nitrogen dalam darah yang diramalkan oleh undang -undang Henry mempunyai kesan narkotik yang menyebabkan disorientasi, kekeliruan dan penglihatan masalah.
Kesan ini mula memerhatikan semasa bernafas udara (xN2= 0.78) pada tekanan 4.00 atm. Sekiranya penyelam merancang untuk turun sehingga 100 meter jauh?
Penyelesaian:
Berdasarkan pernyataan, kita boleh menyimpulkan bahawa kepekatan maksimum nitrogen adalah apa yang berlaku apabila tekanan udara adalah 4.00 atm. Menurut undang -undang Henry dan menggunakan hubungan antara tekanan total dan tekanan separa contoh sebelumnya:
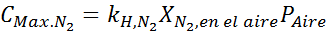
Ini mestilah kepekatan maksimum yang sama pada sebarang tekanan. Jadi, 100 meter:
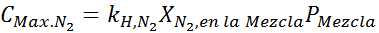
Menyamakan kedua -dua persamaan, kita dapat mencari pecahan molar maksimum nitrogen dalam campuran:
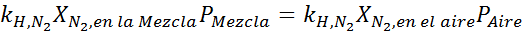
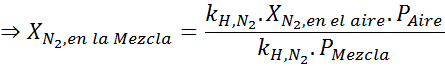
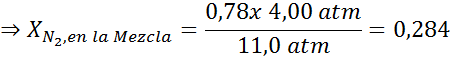
Ini bermaksud bahawa penyelam tidak boleh menggunakan campuran yang mengandungi lebih daripada 28.4% nitrogen jika merancang untuk menyelam sehingga 100 meter dalam.

