Undang -undang Penjelasan Hess, Aplikasi, Contoh
- 1030
- 91
- Julius Dibbert
The Undang -undang Hess Ini adalah satu lagi manifestasi undang -undang pemuliharaan tenaga yang membolehkan untuk menentukan, melalui jumlah algebra yang mudah, entalpi reaksi kimia. Difahami oleh entalpi sebagai haba yang dikeluarkan atau diserap, pada tekanan malar, yang dikaitkan dengan sebarang tindak balas kimia atau fenomena kimia.
Enthalpies, ΔH, ditentukan secara eksperimen menggunakan kalorimetri. Walau bagaimanapun, terdapat tindak balas yang sukar untuk dipelajari dengan teknik ini. Apabila ini berlaku, tindak balas lain digunakan bahawa enthalpies khusus mereka mempunyai, dan yang memiliki kepentingan atau sebatian yang menarik minat.
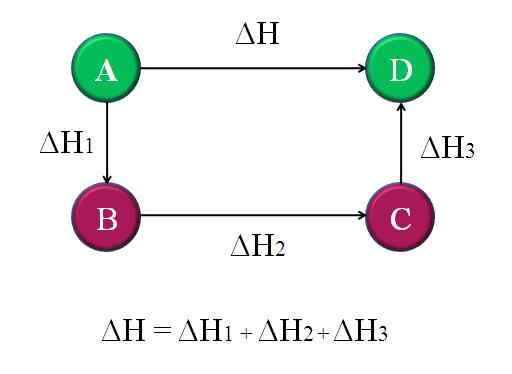
 Gambarajah ringkas dan umum di mana undang -undang hess untuk empat tindak balas kimia digunakan. Sumber: Gabriel Bolívar.
Gambarajah ringkas dan umum di mana undang -undang hess untuk empat tindak balas kimia digunakan. Sumber: Gabriel Bolívar. Dengan cara ini, "tidak diketahui" ΔH tindak balas dapat dikira. Contohnya, rajah teratas membantu memahami idea ini. Terdapat empat reaksi: A-D, A-B, B-C dan C-D. Reaksi A-D adalah yang mempunyai ΔH terbesar, kerana di mana ia berlaku, jadi untuk bercakap, perubahan kimia yang paling terkenal.
Reaksi lain, sementara, mempunyai ΔH yang lebih kecil, kerana ia terdiri daripada langkah alternatif atau reaksi alternatif untuk mencapai produk yang sama d. Oleh itu, jumlah ΔH1, ΔH2 dan ΔH3, Ia akan sama dengan ΔH. Mengetahui ini, ΔH, atau mana -mana entalpi lain, boleh dikira dengan menggunakan penjelasan mudah. Ini adalah undang -undang Hess.
Undang -undang Hess sangat berguna apabila mengira enthalpi reaksi, serta enthalpies latihan untuk sebatian yang berbeza atau perantara yang tidak stabil.
[TOC]
Penjelasan Undang -undang Hess
Pengiraan entalpi reaksi
Sebab mengapa ia dipenuhi:
ΔH = ΔH1 + ΔH2 + ΔH3
Kerana entalpi, atau perubahan entalpi, adalah fungsi negara. Ini bermaksud bahawa nilai mereka tidak diubah suai dengan bilangan langkah, peringkat atau reaksi perantara. Sebagai contoh, ΔH akan tetap sama walaupun terdapat ΔH10 yang harus dipertimbangkan dalam jumlah algebra.
Enthalpies dapat divisualisasikan sebagai puncak beberapa gunung. Tidak kira bagaimana langkah -langkah ke arah mereka diarahkan, ketinggian yang memisahkan mereka dari tahap Mar. Dan tepatnya ketinggian yang ditambah atau dikurangkan untuk menentukan ketinggian gunung yang tidak diketahui di sekitarnya.
Kembali ke rajah sebelumnya: A, ia adalah gunung, gunung lain, dan sebagainya. Perbezaan ketinggian antara puncak A dan D, adalah yang terbesar. Menambah ketinggian antara A-B, B-C dan C-D, ia akan memberi sama dengan ketinggian A-D. Inilah yang dilakukan dengan enthalpies reaksi kimia masing -masing.
Boleh melayani anda: kumpulan fosfatEnthalpy reaksi dari enthalpies pembentukan
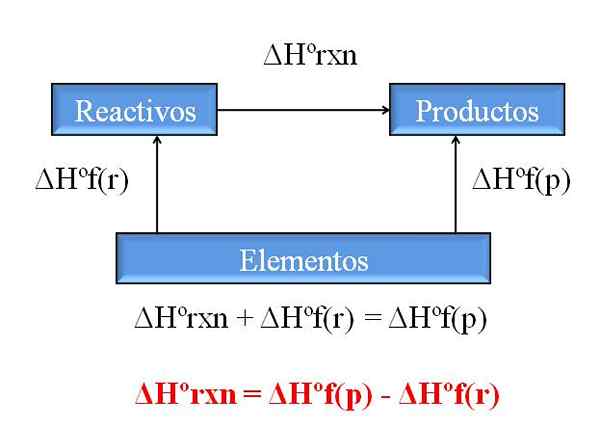 Gambar rajah umum untuk mengira entalpi tindak balas dari enthalpies pembentukan. Sumber: Gabriel Bolívar.
Gambar rajah umum untuk mengira entalpi tindak balas dari enthalpies pembentukan. Sumber: Gabriel Bolívar. Salah satu akibat yang paling berharga dari undang -undang Hess adalah bahawa ia membolehkan penentuan enthalpies sebarang tindak balas kimia, mengambil enthalpies latihan semua sebatian (reagen dan produk) yang terlibat.
Imej unggul menggambarkan perkara ini. Difahami oleh entalpi pembentukan haba yang berkaitan apabila sebatian terbentuk dari unsur -unsurnya. Entalpi ini akan menjadi perbezaan maksimum antara reagen dan produk, tanpa perlu berunding dengan tindak balas kimia lain; Sekurang -kurangnya, di luar latihan sebatian yang berasingan.
Bagaimana anda membaca rajah kali ini? Caranya selalu menambah enthalpies ketika masuk ke arah anak panah, dan tolak mereka ketika anak panah berada di jalan yang bertentangan. Oleh itu, ΔHºrxn, entalpi reaksi standard, menambah kepada ΔHºF (reagen), entalpi standard pembentukan reagen, dan mereka dikurangkan ΔHºF (produk), entalpi standard pembentukan produk produk.
Reaksi Jumlah
Gambar rajah boleh menjadi sangat rumit untuk mentafsir, terutamanya apabila terdapat banyak reaksi yang mesti dipertimbangkan. Oleh itu, jumlah reaksi digunakan. Kaedah ini sangat memudahkan pengiraan enthalpies, dan mempercepat pemahaman undang -undang Hess.
Katakan sebagai contoh bahawa anda ingin menentukan ΔHºrxn reaksi berikut:
A + B + C → ABC
Dan kami juga mempunyai dua reaksi lain:
A + B → AB (ΔHº1)
AB + C → ABC (ΔHº2)
Sangat menarik bahawa A + B + C berada di sebelah kiri (reagen) dan ABC berada di sebelah kanan (produk). Kemudian, kami hanya meneruskan untuk menambah dua reaksi terakhir:
A + b → ab
AB + C → ABC
A + AB + C → ABC + AB
Kerana ab dari kedua belah pihak, ia dihapuskan. Oleh itu, kita ada:
A + B + C → ABC
ΔHºrxn = ΔHº1 + ΔHº2
Menambah tindak balas, penggunaan mana -mana rajah ditinggalkan.
Permohonan undang -undang Hess
Undang -undang Hess membenarkan, tanpa memerlukan eksperimen, enthalpies untuk tindak balas atau fenomena kimia yang berlainan. Sebahagian daripada mereka disenaraikan:
- Enthalpies latihan untuk sebatian atau perantara yang tidak stabil, seperti yang biasanya kita ada dalam kimia organik.
-Enthalpies peralihan fasa, dalam kajian pepejal kristal.
Boleh melayani anda: Kompaun kimia-Enthalpies peralihan allotropic, seperti antara grafit dan berlian.
Begitu juga, undang -undang Hess digunakan untuk menentukan tenaga retikular pepejal, dan pertalian elektronik beberapa atom.
Contoh: Latihan yang diselesaikan
- Contoh 1
Kirakan ΔHRXN tindak balas berikut:
2hcl (g) + f2(g) → 2hf (l) + cl2(g)
Jika anda mempunyai reaksi berikut dan enthalpies masing -masing:
4hcl (g) + atau2(g) → 2h2Atau (l) + 2cl2(g) (ΔH = -202.4 kJ/mol)
1/2h2(g) + 1/2f2(g) → HF (l) (ΔH = -600.0 kJ/mol)
H2(g) + 1/2o2(g) → h2Atau (l) (ΔH = -285.8 kJ/mol)
Pesanan Persamaan
Untuk memulakan, kita mesti menambah reaksi sedemikian rupa sehingga HCl dan F2 berada di sebelah kiri, dan HF dan Cl2, Di sebelah kanan. Tetapi yang lebih penting, ia menyedari bahawa begitu banyak h2 sebagai h2Atau tidak dalam persamaan minat. Oleh itu, kita mesti membatalkannya dalam jumlah, dan membuat pekali stoikiometri bertepatan dengan pendaraban:
2hcl (g) + 1/22(g) → h2Atau (l) + cl2(g) (ΔH = -202.4 kJ/mol) * (1/2)
Persamaan ini didarabkan dengan 1/2 untuk mempunyai 2hcl dan bukannya 4HCl
H2(g) + f2(g) → 2hf (l) (ΔH = -600.0 kJ/mol) * (2)
Persamaan ini didarabkan dengan 2 untuk mempunyai f2 dan tiada 1/2f2
H2Atau (l) → h2(g) + 1/2o2(g) (ΔH = -285.8 kJ/mol) * (-1)
Sementara itu, yang terakhir didarab dengan -1 untuk "menghidupkannya". Oleh itu, kami mempunyai persamaan yang diperintahkan dan bersedia untuk menambah.
Jumlah persamaan
Menambah semuanya memberi kita:
2hcl (g) + 1/22(g) → h2Atau (l) + cl2(g) (ΔH = -101.2 kJ/mol)
H2(g) + f2(g) → 2hf (l) ΔH = -1200.0 kJ/mol)
H2Atau (l) → h2(g) + 1/2o2(g) (ΔH = 285.8 kJ/mol)
2hcl (g) + f2(g) → 2hf (l) +cl2(g)
Perhatikan bahawa istilah 1/22, H2Atau dan h2 Mereka dibatalkan kerana mereka berada di kedua -dua belah anak panah. Enthalpies juga ditambah, memberi:
ΔHrx = 285.8 kJ/mol + (-101.2 kJ/mol) + (-1200.0 kJ/mol)
Ungkapan ini sama dengan permulaan:
ΔH = ΔH1 + ΔH2 + ΔH3
Oleh itu, kita mempunyai ΔHrx adalah sama dengan:
ΔHrx = -1015.4 kJ/mol
- Contoh 2
Dalam contoh ini, dapat dilihat bahawa enthalpies reaksi alternatif sesuai dengan enthalpies pembentukan sebatian kepentingan.
Ia dikehendaki untuk menentukan ΔHRXN untuk tindak balas penguraian seterusnya:
2SO3(g) → 2so2(g) + atau2(g)
Dan enthalpies latihan sebatian begitu dikira di tangan3 Dan juga2:
S (s) + o2(g) → begitu2(g) (ΔH = -296.8 kJ/mol)
Boleh melayani anda: isopreno: struktur, sifat, aplikasiS (s) + 3/2o2(g) → begitu3(g) (ΔH = -395.6 kJ/mol)
Pesanan Persamaan
Latihan ini akan diselesaikan dengan cara yang sama seperti contoh sebelumnya. Semestinya begitu3 betul, dan kalikan dengan 2. Untuk itu, kita mesti "menghidupkan" persamaan pembentukan SO3 Mengalikannya dengan -1, dan kemudian dengan mengalikannya dengan 2:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = -395.6 kJ/mol) * (-2)
Persamaan pembentukan SO2 Kami juga membiaknya dengan 2:
2s (s) + ke -22(g) → 2so2(g) (ΔH = -296.8 kJ/mol) * (2)
Jumlah persamaan
Sekarang persamaan ditambah:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = 791.2 kJ/mol)
2s (s) + ke -22(g) → 2so2(g) (ΔH = -593.6 kJ/mol)
2SO3(g) → 2so2(g) + atau2(g)
Perhatikan bahawa istilah 2s dihapuskan kerana ia berada di kedua -dua belah anak panah. Juga, ke -32 2O ditolak2 memberi o2. Jumlah enthalpies, dan oleh itu, nilai ΔHRXN akan menjadi:
ΔH = ΔHRXN = 791.2 kJ/mol + (-593.6 kJ/mol)
= 197.6 kJ/mol
Seperti apa -apa tindak balas penguraian, ia adalah endotermik, jadi entalpinya positif.
Kaedah alternatif
Terdapat kaedah untuk mencapai hasil yang sama dengan cara yang lebih langsung dan mudah. Ini disebutkan di bahagian sebelumnya.
2SO3(g) → 2so2(g) + atau2(g)
Untuk menentukan ΔHRXN tindak balas ini, kita mesti mengira ΔHºF (reagen) dan ΔHºF (produk). ΔHºF (begitu3) sama dengan -395.6 kJ/mol, manakala ΔHºF (begitu2) sama dengan -296.8 kJ/mol. ΔHºF (atau2) sama dengan 0, kerana oksigen asas wujud sebagai molekul o2 dan bukan sebagai atom atau bebas.
Jadi, kita ada:
Δhrxn = ΔHºF (produk) - ΔHºF (reagen)
= [ΔHºF (begitu2) + ΔHºF (atau2)] - ΔHºF (begitu3)
= ΔHºF (begitu2) - ΔHºF (begitu3)
Walau bagaimanapun, kita mesti membiak kedua -dua enthalpies latihan sebanyak 2, untuk memadankan pekali stoikiometrik berkenaan dengan persamaan kimia:
Δhrxn = 2ΔHºF (begitu2) - 2ΔHºF (begitu3)
Dan mengira kita ada:
ΔHRXN = 2 (-296.8 kJ/mol) - 2 (-395.6 kJ/mol)
= 197.6 kJ/mol
Malah, ini adalah cara biasanya lebih disukai untuk menyelesaikan semua latihan di mana undang -undang hess digunakan.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Wikipedia. (2020). Undang -undang Hess. Diperoleh dari: dalam.Wikipedia.org
- Cohen Shelly. (18 Mei 2020). Undang -undang Hess. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- Clark Jim. (2010). Pengiraan Perubahan Undang -Undang dan Entalpi Hess. Pulih dari: chemguide.co.UK
- Helmestine, Anne Marie, Ph.D. (11 Februari 2020). Definisi Undang -undang Hess. Pulih dari: Thoughtco.com
- Foist Laura. (2020). Undang -undang Hess: Definisi, Formula & Contoh. Kajian. Pulih dari: belajar.com
- Quimitube. (2014). Teori 14 Thermochemistry: Pengiraan entalpi reaksi oleh undang -undang Hess. Pulih dari: quimitube.com
- « Ujian ketegangan bagaimana ia dilakukan, sifat, contoh
- Ujian mampatan bagaimana ia dilakukan, sifat, contoh »

