Undang -undang pelbagai perkadaran
- 2646
- 275
- Horace Gulgowski
Apakah undang -undang pelbagai perkadaran?
The Undang -undang pelbagai perkadaran Ia menegaskan bahawa jika dua elemen membentuk lebih daripada satu kompaun apabila mereka bertindak balas antara satu sama lain, maka perkadaran orang ramai yang mana satu daripadanya digabungkan dengan jisim tetap yang lain, ia sama dengan hubungan bilangan kecil.
Pernyataan undang -undang mungkin kelihatan rumit jika anda tidak mempunyai contoh di tangan. Oleh itu, pertimbangkan beberapa kuki Oreos, terdiri daripada dua penutup coklat dan jalur krim manis: t2C (t = tudung dan c = krim). Sekiranya kami ingin mencipta kuki Oreo yang lebih mantap, kami akan menambah satu lagi krim, untuk mempunyai krim berganda (t2C2 atau TC).
 Dalam pencuci mulut, seperti kuki Oreos, kita mempunyai perkadaran yang boleh diubah hanya untuk menyediakan versi lain dari mereka. Sumber: Brokensphere, CC BY-SA 3.0 https: // creativeCommons.Org/lesen/by-sa/3.0 melalui Wikimedia Commons
Dalam pencuci mulut, seperti kuki Oreos, kita mempunyai perkadaran yang boleh diubah hanya untuk menyediakan versi lain dari mereka. Sumber: Brokensphere, CC BY-SA 3.0 https: // creativeCommons.Org/lesen/by-sa/3.0 melalui Wikimedia Commons Kami juga boleh menambah satu lagi, sehingga kuki mempunyai tiga kali lebih krim daripada kuki konvensional (t2C3). Bagaimana jika kita meletakkan tudung coklat lain di tengah -tengah jalur putih (t3C2)? Pilihan tidak terhad; Tetapi kami sentiasa menambah tudung atau unit krim. Kami tidak memikirkan separuh tudung (1/2 t), atau kelima krim (1/5 c), kerana ia tidak sesuai.
Dengan cara yang sama ia berlaku dengan unsur -unsur kimia: atom mereka tidak membahagikan untuk membentuk sebatian. Oleh itu, jisim t atau c di antara sebatian mereka "selalu" hubungan yang sederhana.
Penjelasan
Perkadaran
Undang -undang pelbagai perkadaran, bersama -sama dengan undang -undang perkadaran yang ditetapkan, mendahului stoikiometri dan formula kimia pertama. Mari lupakan kuki, tapi mari kita simbol -simbol mereka: t dan c. Melalui eksperimen, didapati bahawa unsur -unsur t dan c membentuk beberapa sebatian: t2C, tc dan t2C3.
Sebelum formula kimia, mustahil untuk mengetahui sekaligus yang merupakan perkadaran massa T dan C dalam sebatian tersebut. Terpaksa menentukan mereka terlebih dahulu. Dalam sebatian, didapati bahawa jisim T berganda dengan C; Untuk mengatakan, 2 gram t digabungkan dengan 1 gram c.
Boleh melayani anda: kapasitans: unit, formula, pengiraan, contohKemudian, di sebatian lain, jisim T dan C harus dipadankan: 2 gram T kini digabungkan dengan 2 gram C. Di sini persoalannya timbul: Bagaimana jika T dan C masih boleh membentuk sebatian lain? Jika ya, ia pasti akan dibentuk dengan 2 gram T, tetapi kali ini mereka akan digabungkan dengan 3 gram C (1 gram + 1 gram + 1 gram).
Hubungan massa mudah
Perkadaran massa yang mana T dan C bertindak balas membolehkan untuk menubuhkan formula kimia mereka: t2C (2 gram T: 1 gram C), TC (2 gram T: 2 gram C) dan T2C3 (2 gram t: 3 gram c). Sekiranya kita mahu membandingkan hubungan massa T atau C dalam sebatian ini, adalah perlu bahawa salah satu daripada jisimnya tetap malar; Dalam kes ini t: 2 gram.
Oleh itu, kita akan menentukan perkadaran jisim C dalam tiga sebatian ini:
- T2C: 1 gram c/2 gram t
- TC: 2 gram c/2 gram t
- T2C3: 3 gram c/2 gram t
Kita akan mempunyai hubungan untuk jisim c sama dengan 1: 2: 3. Iaitu, terdapat 2 kali lebih banyak c dalam tc daripada t2C, dan 3 kali lebih banyak c dalam t2C3 daripada t2C. Seperti yang dapat dilihat, 1: 2: 3 adalah nombor keseluruhan kecil (mereka tidak melebihi sedozen).
Contoh undang -undang pelbagai perkadaran
Untuk contoh -contoh berikut, langkah -langkah sebelumnya yang sama akan digunakan, tetapi kami akan mengambil kira massa molar unsur -unsur masing -masing, dengan mengandaikan satu tahi lalat.
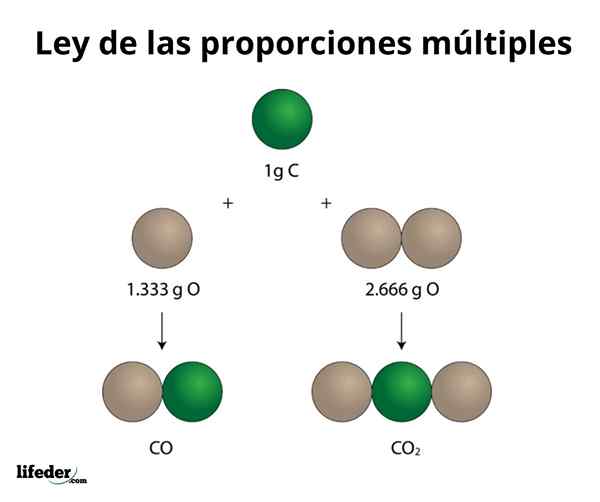
Kelapa2

Contoh ini menerangkan dengan cara yang mudah bagaimana undang -undang pelbagai perkadaran berfungsi; Di CO (karbon monoksida), terdapat 1.333 gram oksigen untuk setiap gram karbon. Dalam karbon dioksida (CO₂), terdapat 2.666 gram oksigen untuk setiap gram karbon. Oleh itu, perkadaran oksigen dalam kedua -dua sebatian adalah 1: 2, nombor integer kecil.
H2O-H2Sama ada2
Undang -undang perkadaran berganda terpakai kepada sepasang h2O-H2Sama ada2.
Boleh melayani anda: 30 contoh penggantungan kimiaDalam mol h2Atau, 2 gram hidrogen digabungkan dengan 16 gram oksigen. Sementara itu, dalam mol h2Sama ada2, 2 gram hidrogen digabungkan dengan 32 gram oksigen. Untuk mengesahkan jika undang -undang ini dipenuhi, kita mesti menetapkan jisim yang sama untuk salah satu elemen dalam kedua -dua sebatian. Kali ini hidrogen: 2 gram.
Perkadaran massa untuk h2Atau dan h2Sama ada2 adalah:
- H2O: 16 gram atau/2 gram h
- H2Sama ada2: 32 gram atau/2 gram h
Nisbah jisim O akan menjadi 16:32. Walau bagaimanapun, kita dapat memudahkannya dengan membahagikan 16, tinggal 1: 2. Sekali lagi, hubungan akhir terdiri daripada nombor kecil yang kecil.
SW2-SW3
Dalam mol SO2, 32 gram sulfur digabungkan dengan 32 gram oksigen. Sementara itu, dalam mol3, 32 gram sulfur digabungkan dengan 48 gram oksigen. Jisim sulfur adalah sama untuk kedua -dua sebatian, jadi kita boleh membandingkan perkadaran oksigen secara langsung:
- SW2: 32 gram atau
- SW3: 48 gram atau
Menjadi nisbah jisim oksigen antara kedua -dua sebatian bersamaan dengan 32:48 atau 1: 1.5. Tetapi tidak ada yang harus ada nombor keseluruhan? Hubungan 1: 1.5 (1/1.5) Ia juga boleh ditulis sebagai 2: 3 (0.6), dan sekali lagi kita akan mempunyai nombor kecil yang kecil: 2 dan 3.
Perhatikan bahawa kita juga boleh menulis hubungan itu sebagai 48:32 atau 1.5: 1, hasilnya 3: 2. Undang -undang tidak berubah, hanya tafsiran hubungan: ada 1.5 atau 3/2 kali lebih banyak oksigen di SO3 yang begitu2; yang sama untuk mengatakan bahawa terdapat 2/3 atau 0.6 kali kurang oksigen di SO2 yang begitu3.
TIDAK TIDAK2-N2O-N2Sama ada3-N2Sama ada5
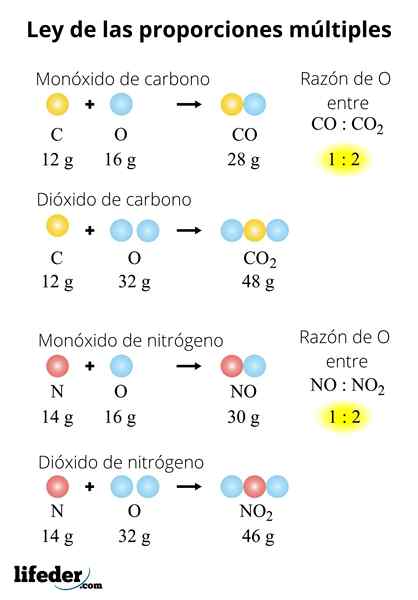
Undang -undang juga boleh digunakan untuk satu siri sebatian. Pertimbangkan oksida nitrogen: tidak-tidak2-N2O-N2Sama ada3-N2Sama ada5. Untuk menilai undang -undang ini di dalamnya, kita mesti menetapkan jisim nitrogen: 28 gram. Kerana? Kerana tidak dan tidak2 Mereka mempunyai atom nitrogen kurang daripada oksida lain:
- 2 (tidak): 28 gram n/32 gram atau
- 2 (tidak2): 28 gram n/64 gram atau
- N2O: 28 gram n/ 16 gram atau
- N2Sama ada3: 28 gram n/ 48 gram atau
- N2Sama ada5: 28 gram n/ 80 gram atau
Marilah kita lupa tentang nitrogen dan fokus pada gram oksigen:
- 2 (tidak): 32 gram atau
- 2 (tidak2): 64 gram atau
- N2O: 16 gram atau
- N2Sama ada3: 48 gram atau
- N2Sama ada5: 80 gram atau
Menjadi nisbah massa atau sama dengan 32: 64: 16: 48: 80. Untuk memudahkannya, kita membahagikan semua bilangannya di antara yang terkecil, 16, yang menjadi 2: 4: 1: 3: 5.
Ia2Atau, 4 kali lebih banyak oksigen dalam no2 bahawa di n2Atau, 3 kali lebih banyak oksigen dalam n2Sama ada3 bahawa di n2Atau, dan 5 kali lebih banyak oksigen dalam n2Sama ada5 bahawa di n2Sama ada. Sekali lagi, kami mempunyai nombor kecil yang kecil, antara 1 hingga 5.
Batasan
Undang -undang pelbagai perkadaran tidak selalu dipenuhi. Sebagai contoh, massa molar atau berat atom unsur -unsur tidak keseluruhan angka, tetapi mempunyai banyak perpuluhan. Ini benar -benar mengubah hubungan yang dikira, yang tidak mudah.
Begitu juga, undang -undang tidak dipenuhi untuk sebatian berat, seperti beberapa hidrokarbon. Sebagai contoh, undecano, csebelasH24, mempunyai 1.0083 atau 121/120 kali lebih banyak hidrogen daripada dekan, c10H22, yang hubungannya terdiri daripada 121 dan 120, yang melebihi sedozen; Mereka bukan nombor kecil.
Dan akhirnya, undang -undang gagal dengan sebatian bukan stoikiometrik, seperti banyak oksida dan sulfida.
Kesimpulan
Undang -undang perkadaran berganda menyatakan bahawa apabila dua elemen membentuk lebih dari satu kompaun, jisim yang berlainan dari unsur yang bergabung dengan jisim yang sama dari elemen lain adalah dalam sebilangan kecil.
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage.
- Wikipedia. (2020). Undang -undang pelbagai perkadaran. Diperoleh dari: dalam.Wikipedia.org
- Editor enyclopaedia Britannica. (2020). Undang -undang pelbagai perkadaran. Pulih dari: Britannica.com
- Kimia. (4 Jun, 2019). Undang -undang Pelbagai Perkadaran oleh Dalton. Pulih dari: Kimiagod.com
- Garcia Nissa. (2020). Undang -undang Pelbagai Perkadaran: Definisi & Contoh. Kajian. Pulih dari: belajar.com

