Raault Prinsip dan Undang -undang Formula, Contoh, Latihan
- 4410
- 940
- Erick Krajcik
The Undang -undang Rauolt Ia adalah salah satu yang digunakan untuk menjelaskan keturunan atau pengurangan tekanan stim, hadir pada penyelesaian, disebabkan oleh pembubaran larut yang tidak berubah -ubah, seperti garam atau sebatian organik.
Undang -undang ini juga digunakan untuk menganalisis dan menggambarkan komposisi pelarut yang tidak menentu dalam fasa gas, yang terletak di ruang dengan larutan yang membentangkan campurannya. Undang-undang menamakan namanya sebagai penghormatan kepada penciptanya, François-Marie Rauolt (1830-1901).
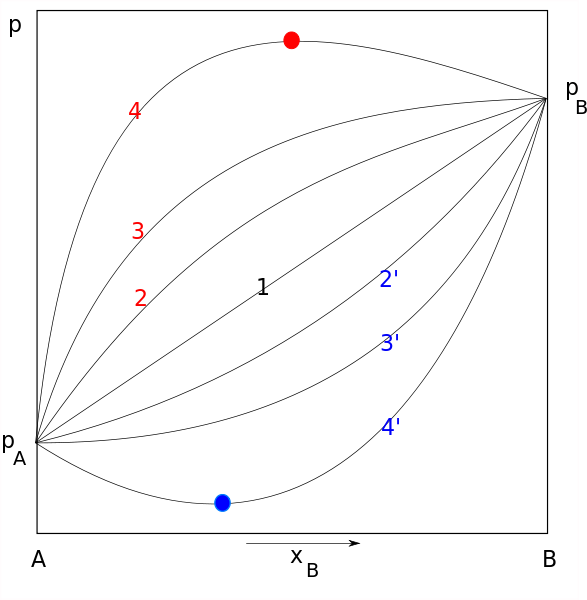
 Rajah Undang -undang Raault. Baris 1 mewakili tingkah laku yang ideal, manakala merah dan biru sesuai dengan penyimpangan positif dan negatif. Sumber: Joanna Kośmider / Domain Awam
Rajah Undang -undang Raault. Baris 1 mewakili tingkah laku yang ideal, manakala merah dan biru sesuai dengan penyimpangan positif dan negatif. Sumber: Joanna Kośmider / Domain Awam Undang -undang Rauolt terpakai untuk penyelesaian ideal yang mematuhi beberapa ciri, termasuk yang berikut: daya intermolecular antara molekul yang sama (daya kohesif) mestilah sama dengan daya intermolecular antara molekul yang berbeza atau berbeza (daya pelekat).
Banyak penyelesaian tidak sesuai, yang menerangkan penyimpangan undang -undang Rauolt yang diperhatikan dalam beberapa campuran pelarut yang tidak menentu. Contohnya, campuran kloroform (CH3Cl) dan aseton (pilih3COCH3), membentangkan penyimpangan negatif dari undang -undang Raoul.
 François-Marie Raault
François-Marie Raault Tekanan stim dalam fasa gas dalam kes sedemikian kurang daripada yang diramalkan oleh undang -undang, yang boleh dijelaskan oleh pembentukan jambatan hidrogen antara komponen campuran.
[TOC]
Prinsip dan formula
Undang -undang Rauolt menunjukkan bahawa tekanan stim separa yang dikenakan oleh komponen yang tidak menentu atau pelarut campuran gas, di atas larutan, berkaitan dengan tekanan stim yang dikenakan oleh komponen atau pelarut yang tidak menentu, dan pecahan molar masing -masing.
Boleh melayani anda: nepelometriPersamaan berikut meringkaskan perkara di atas:
PSv = PSvº · xSv
Di mana pSv Ia adalah tekanan separa pelarut yang tidak menentu dalam campuran soda, pSvº Tekanan pelarut yang tidak menentu murni, dan xSv pecahan molar dalam larutan pelarut yang tidak menentu.
Campuran pelarut yang tidak menentu
Sekiranya anda mempunyai campuran dua pelarut yang tidak menentu (a dan b) dalam larutan, anda boleh mengira tekanan stim yang berasal dari fasa gas, di atas larutan. Ini akan menjadi jumlah tekanan separa yang dikenakan oleh gas a dan b:
PKe = XKe · PKeº
PB = XB · PBº
Jadi menambah tekanan A dan B kita mendapat tekanan P Total:
P = xKe · PKeº +xB · PBº
Di mana p ialah tekanan stim campuran soda di atas larutan, xKe dan xB pecahan molar pelarut yang tidak menentu a dan b dalam campuran, dan pKeº dan pBº Tekanan wap pelarut yang tidak menentu a dan b.
Tekanan menurun dalam fasa gas disebabkan oleh kehadiran larut yang tidak berubah -ubah
Tekanan separa pelarut yang tidak menentu dalam fasa gas diberikan oleh ungkapan:
P = pKeº · xKe
Dengan kehadiran larut B dalam larutan, pecahan molar B dinyatakan seperti berikut:
XB = 1 -xKe
Kemudian, melalui rawatan matematik yang mudah, ungkapan dicapai:
ΔP = pKeº · xB (1)
Di mana ΔP adalah penurunan tekanan separa pelarut dalam fasa gas.
Ekspresi matematik (1) menunjukkan penurunan tekanan wap pelarut kerana kehadiran larut B yang tidak berubah -ubah. Penurunan tekanan wap pelarut telah dijelaskan kerana lokasi molekul larut B pada permukaan larutan.
Ia boleh melayani anda: Kumpulan Carbonyl: Ciri -ciri, Harta, Tatanama, KereaktifanKehadiran molekul larut B akan menghasilkan penurunan kepekatan pelarut A molekul pada permukaan larutan, mengehadkan penyejatannya; Dan dengan itu menjelaskan, penurunan tekanan stim dalam fasa gas.
Contoh
Undang -undang Raault berfungsi untuk mengira tekanan wap komponen penyelesaian yang tidak menentu, seperti etanol, benzena, toluena, etana, propana, dll., dalam ruang penyelesaian.
Ia boleh digunakan untuk mengira tekanan stim yang dihasilkan dalam ruang larutan, sebagai akibat daripada campuran cecair yang tidak menentu, sama ada benzena dan toluena, etana dan propana, aseton dan etanol, dll.
Juga, dengan undang -undang ini, anda dapat menentukan apa yang akan menjadi penurunan tekanan stim jika, sebagai contoh, ia akan membubarkan sukrosa di dalam air, sebagai larutan yang tidak menonjol.
Latihan yang diselesaikan
Latihan 1
Kirakan tekanan wap penyelesaian yang disediakan dengan membubarkan 60 g natrium klorida (NaCl) dalam 400 g air (h (h2Sama ada). Tekanan wap air (pH2Oº) A 37 ºC ialah 47.1 mmHg. Berat molekul h2O = 18 g/mol dan berat molekul NaCl = 58.5 g/mol.
Kami mula -mula mengira tahi lalat air dan natrium klorida untuk menentukan pecahan molar mereka:
Moles H2O = gram h2O / pm h2Sama ada
= 400 g / (18 g / mol)
= 22.22 Moles
Moles of NaCl = g NaCl / Pm NaCl
= 60 g / (58.5 g / mol)
= 1.03 mol
NaCl adalah sebatian elektrolitik yang memisahkan diri dalam NA+ + Cl-. Oleh itu, 1.03 tahi lalat NaCl memisahkan diri dalam 1.03 tahi lalat Na+ dan 1.03 tahi lalat Cl-.
Ia dapat melayani anda: Reaksi MaillardKami mempunyai ungkapan:
Pv = XH2O · PH2Oº
Oleh itu, kami tidak mempunyai pecahan molar air:
XH2O = Tahi lalat h2O / (tahi lalat h2O +tahi lalat na+ + Moles of Cl-)
= 22.2 Moles / 22.22 Moles +1.03 Moles +1.03 Moles
= 0.896
Dan kami mengira pv:
Pv = 47.1 mmhg · 0.896
Pv = 42.20 mmHg
Menjadi penurunan tekanan stim kerana kehadiran natrium klorida:
ΔPv = 47.1 mmHg - 42.20 mmHg
= 4.9 mmHg
Latihan 2
Pada suhu -100 ºC etana (pilih3Ch3) dan propana (cho3Ch2Ch3) Mereka cecair. Pada suhu itu, tekanan wap etana tulen (pEtanoº) adalah 394 mmHg, manakala tekanan wap propana tulen (ppropanaº) adalah 22 mmHg. Apa yang akan menjadi tekanan stim pada penyelesaian yang mengandungi jumlah equimolar kedua -dua sebatian?
Pendekatan masalah menunjukkan bahawa penyelesaiannya mengandungi jumlah equimolar sebatian. Ini menunjukkan bahawa pecahan molar sebatian dan sebatian propana semestinya sama dengan 0.5.
Sekali lagi, penyelesaiannya datang dengan ungkapan:
Pv = PEtano + Ppropana
Kami mengira tekanan separa kedua -dua etana dan propana:
PEtano = PEtanoº · xEtano
= 394 mmhg · 0.5
= 197 mmHg
Ppropana = Ppropanaº · xpropana
= 22 mmhg · 0.5
= 11 mmHg
Dan jadi kami akhirnya mengira pv:
Pv = PEtano + Ppropana
= 197 mmhg +11 mmhg
= 208 mmHg
Rujukan
- Whitten, Davis, Peck & Stanley. (2008). Kimia. (8th ed.). Pembelajaran Cengage
- Wikipedia. (2020). Undang -undang Rault. Diperoleh dari: dalam.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (11 Februari 2020). Definisi Undang -undang Rault dalam Kimia. Pulih dari: Thoughtco.com
- Encyclopædia Britannica. (2020). Undang -undang Rault. Pulih dari: Britannica.com
- Clark J., Ly i., & Khan s. (18 Mei 2020). Undang -undang Rault. Kimia Librettexts. Pulih dari: chem.Libretxts.org
- « Kuantiti momentum sudut, pemuliharaan, contoh, latihan
- Konsep, Ciri dan Contoh Objek Objek Objek »

