Logam Alkali Sifat Fizikal dan Kimia, Kegunaan, Memperoleh
- 3222
- 723
- Donnie Ryan
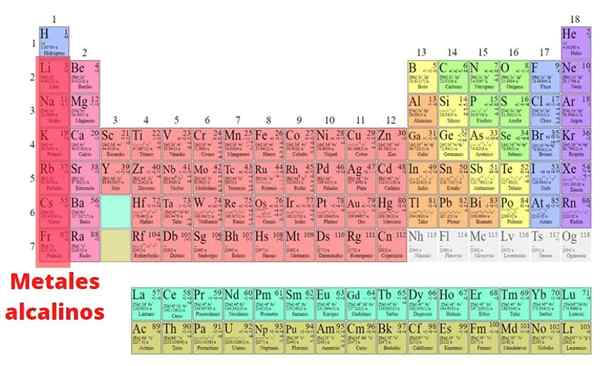
The Logam Alkali Ini adalah unsur -unsur yang merupakan sebahagian daripada kumpulan I dari jadual berkala, kecuali hidrogen: litium (li), natrium (na), kalium (k), rubidid. Tidak seperti kebanyakan logam, mereka mempunyai kepadatan yang rendah dan sangat reaktif. Oleh kerana kereaktifan kimia yang hebat ini, mereka tidak pernah dijumpai dalam bentuk asasnya.
Logam ini membentuk sebatian ionik yang mudah dan stabil yang, untuk sebahagian besar, larut dalam air; Logam alkali biasanya digabungkan dengan ion halogenida, sulfat, karbonat dan silikat. Walau bagaimanapun, beberapa elemen membentuk sebilangan kecil sebatian kompleks dan organometali.

Secara umum, sifat fizikal dan kimia logam alkali telah dikaji dengan baik, kecuali Francio kerana sifat radioaktifnya.
[TOC]
Ciri-ciri fizikal
- Logam alkali adalah perak, kecuali cesium, yang emas. Mereka menjalankan elektrik dan haba, dan mempunyai titik lebur yang rendah yang juga berkurangan dengan peningkatan bilangan atom, kerana hubungan antara atom lemah dengan meningkatkan jejari atom.
- Fakta hanya mempunyai satu elektron Valencia oleh Atom juga menjadikan ikatan logamnya lemah. Oleh itu, logam alkali juga cukup lembut untuk memotongnya dengan pisau atau spatula.
- Semua elemen mengamalkan struktur padu yang berpusat pada badan. Kerana jenis struktur kristal ini tidak dibungkus dan radio atom logam alkali besar, mereka mempunyai kepadatan yang rendah berbanding logam lain. Malah, litium, natrium dan kalium terapung di dalam air.
- Perbezaan tenaga antara orbital lapisan logam alkali Valencia bertepatan dengan panjang gelombang cahaya yang kelihatan. Kerana ini, ketika memanaskan sebatian yang dibentuk oleh logam ini dalam api, warna ciri dihasilkan.
Ia boleh melayani anda: trinitrotolueno (TNT): struktur, sifat, kegunaan, risiko, letupan- Dalam urutan menurun, garam lithium memberikan warna merah, garam natrium warna kuning, kalium warna ungu, rubidium warna merah kebiruan dan menghentikan warna biru.
Sifat kimia
Semua logam alkali mempunyai persamaan dalam sifat kimia mereka.
- Mereka mempunyai konfigurasi elektronik Valencia NS1, yang diterjemahkan ke dalam keadaan pengoksidaan +1. Sebaliknya, ini bermakna mereka dengan mudah kehilangan elektron untuk mencapai konfigurasi gas mulia.
- Secara umum, logam alkali mempunyai tenaga pengionan terendah dari semua unsur, yang juga berkurangan apabila jejari atom meningkat dalam kumpulan kerana lapisan Valencia semakin jauh dari nukleus. Ini menerangkan kereaktifan logam alkali dan pembentukan ion m+ dalam keadaan yang mudah berair.
- Kecenderungan termodinamik untuk membentuk ion m+ disahkan oleh potensi standard pasangan m+/m, yang semuanya besar dan negatif. Trend sedemikian menunjukkan bahawa logam alkali mengoksidakan dengan mudah dan boleh bertindak sebagai ejen pengurangan yang kuat.
- Unsur -unsur ini mesti disimpan dalam minyak yang tidak aktif untuk mengelakkan tindak balas dengan oksigen atmosfera. Walaupun litium, natrium dan kalium dapat dimanipulasi di udara untuk tempoh yang singkat, rubidium dan cesium mesti ditangani di bawah atmosfera lengai pada setiap masa.
Mendapatkan logam alkali
Natrium

Cara terbaik untuk mendapatkan natrium logam melibatkan elektrolisis natrium klorida cair. Kerana titik lebur natrium klorida agak tinggi (808 ° C) dan banyak tenaga diperlukan untuk mengekalkan sejumlah besar bahan cair, kalsium klorida (CaCl2) biasanya ditambah untuk mengurangkan titik lebur hingga sekitar 600 ° C.
Boleh melayani anda: turbidimetriNatrium diperolehi dalam keadaan cair dalam katod dengan kesucian 99.95% di bawah suasana lengai.
Lithium dan kalium
Lithium juga boleh didapati dari klorida yang dilemparkan oleh elektrolisis, tetapi bukan kes kalium kerana ia terlalu larut dalam klorida (KCl) dan tidak terapung di permukaan sel. Di samping itu, ia dengan mudah menguap ke suhu operasi, jadi ia mewujudkan keadaan berbahaya.
Oleh itu, kalium diperolehi dengan pengurangan kcl cair dengan natrium cecair. Natrium yang terdapat di kalium dihapuskan dengan memeluwap stim pada 892 ° C dan menjalankan penyulingan pecahan logam cecair.
Rubidio dan Cesio
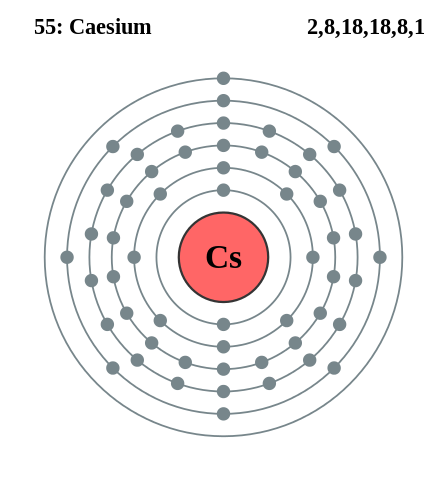 Konfigurasi Cesium Elektronik. Sumber: Pumbaa (karya asal oleh Greg Robson) / cc by-sa 2.0 UK (https: // creativeCommons.Org/lesen/by-sa/2.0/UK/Akta.dalam)
Konfigurasi Cesium Elektronik. Sumber: Pumbaa (karya asal oleh Greg Robson) / cc by-sa 2.0 UK (https: // creativeCommons.Org/lesen/by-sa/2.0/UK/Akta.dalam) Rubidio dan Cesium boleh diperoleh sama, tetapi menggunakan kalsium sebagai ejen pengurangan. Kassium logam juga boleh didapati oleh elektrolisis cesium cesium cecair (CSCN).
Penggunaan dan aplikasi utama
Natrium sebagai ejen pengurangan
Oleh kerana natrium sangat mudah dioksidakan, aplikasi yang paling penting adalah sebagai ejen pengurangan untuk mendapatkan logam seperti Titanium, Surround dan Hafnio. Ia juga digunakan sebagai penukar haba dalam reaktor nuklear dalam keadaan cairnya.
Kalium sebagai baja
 Kalium klorida, baja. Sumber: Abbas cucaniensis/cc by-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)
Kalium klorida, baja. Sumber: Abbas cucaniensis/cc by-SA (https: // creativeCommons.Org/lesen/by-sa/4.0) Sebilangan besar kalium yang diproses pergi ke baja dalam bentuk kalium klorida. Sebaliknya, klorida digunakan dalam pengeluaran sebatian dan penyelesaian lain seperti kalium hidroksida, yang digunakan dalam pembuatan sabun cecair.
Kalium sianida digunakan untuk pengekstrakan logam atau salutan untuk memudahkan tembaga, perak dan pemendapan emas. Kalium juga boleh didapati di beberapa bahan peledak dan sebagai pewarna bunga api.
Boleh melayani anda: radio: struktur, sifat, kegunaan, mendapatkanLithium sebagai ejen aloi
Lithium logam digunakan sebagai agen aloi dalam pengeluaran aloi aeronautik dan magnesium dan aeroangkasa magnesium. Tetapi dengan peredaran masa, ia telah menemui peningkatan utiliti sebagai anod bateri alkali.
Litium logam juga membolehkan mengurangkan suhu lebur dan sintering jenis kaca dan seramik tertentu, selain mengurangkan pekali pengembangannya. Lithium karbonat digunakan secara meluas untuk merawat keadaan bipolar, manakala litium stearate adalah pelincir yang digunakan secara meluas dalam industri automotif.
Rubidio dan Cesio
Rubidio dan Cesium biasanya digunakan dalam aplikasi yang sama, jadi salah satu elemen ini dapat digantikan oleh yang lain. Aplikasi termasuk kaca gentian optik dalam industri telekomunikasi, peralatan penglihatan malam dan sel fotoelektrik. Jam cesio (jam atom) digunakan untuk ukuran masa standard antarabangsa dan untuk definisi kedua.
Rujukan
- Chang, R., & Goldsby, k. Ke. (2016). Kimia (ed ke -12.). New York: Mc-Graw Hill.
- Halka, m., & Nordstrom, b. (2010). Logam Bumi Alkali dan Alkali. New York: Penerbitan Infobase.
- Miesler, g. L., Fischer, ms. J., & Tarr, D. Ke. (2014). Kimia bukan organik (ed ke -5.). New York: Pearson.
- Mishra, b., & Majumdar, g. (2017). Pengeluaran Logam Alkali (Li, Na, K). Modul Rujukan dalam Kejuruteraan Sains dan Bahan Bahan. Elsevier.
- Petrucci, r. H., Herring, f. G., Bissonnette, c., & Matang, j. D. (2017). Kimia Umum: Prinsip dan Aplikasi Moden (ed 11.). New York: Pearson.
- Shriver, d., Weller, m., Overton, t., Rourke, J., & Armstrong, f. (2014). Kimia bukan organik (ed 6th.). New York: W. H. Freeman.
- « Di mana benua terdapat kepekatan penduduk yang lebih besar?
- Ciri -ciri Zaman Gangsa, Tempoh, Alat dan Penciptaan »

