Model Atom Bohr

- 1487
- 457
- Erick Krajcik
Dia Model Atom Bohr Ia adalah konsepsi ahli fizik Denmark Niels Bohr (1885-1962) mengenai struktur atom, yang diterbitkan pada tahun 1913. Di atom Bohr, elektron di sekitar nukleus hanya menduduki orbit yang dibenarkan, terima kasih kepada sekatan yang dipanggil kuantisasi.
Bagi Bohr, imej atom sebagai sistem suria kecil, dengan elektron dengan mengorbit sekitar nukleus, ia tidak sepenuhnya konsisten dengan fakta bahawa caj elektrik, apabila mereka dipercepat, memancarkan tenaga.

Atom seperti itu tidak stabil, kerana ia akan berakhir runtuh lambat laun kerana elektron akan mendakan secara rohani ke nukleus. Dan pada masa itu, 50 tahun yang lalu corak cahaya ciri yang memancarkan hidrogen dan gas lain ketika pemanasan.
Corak atau spektrum terdiri daripada satu siri garis cerah dari panjang gelombang yang sangat spesifik. Dan atom hidrogen tidak runtuh dengan memancarkan cahaya.
Untuk menjelaskan mengapa atom stabil walaupun dapat memancarkan tenaga elektromagnet, Bohr mencadangkan bahawa momentum sudut hanya dapat mengadopsi nilai -nilai tertentu, dan oleh itu tenaga juga. Inilah yang difahami dengan kuantisasi.
Menerima bahawa tenaga telah dikira, elektron akan mempunyai kestabilan yang diperlukan untuk tidak tergesa -gesa ke arah nukleus memusnahkan atom.
Dan atom hanya memancarkan tenaga cahaya apabila elektron membuat peralihan dari satu orbit ke yang lain, selalu dalam kuantiti diskret. Dengan cara ini kehadiran corak pelepasan dalam hidrogen dijelaskan.
Bohr terdiri dengan cara ini visi atom yang mengintegrasikan konsep -konsep mekanik klasik yang diketahui dengan yang baru ditemui, seperti pemalar Planck, foton, elektron, nukleus atom (Rutherford telah menjadi mentor Bohr) dan spektrum yang disebutkan di atas.
[TOC]
Ciri -ciri utama model Bohr
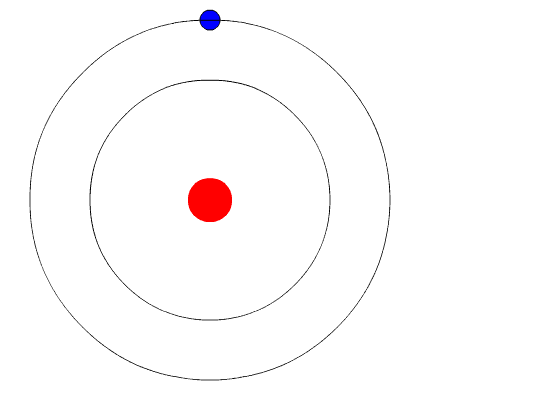 Atom Bohr. Animasi mewakili elektron apabila ia dari tahap tenaga yang lebih tinggi ke tenaga lain yang kurang, memancarkan cahaya cahaya (foton). Sumber: Wikimedia Commons.
Atom Bohr. Animasi mewakili elektron apabila ia dari tahap tenaga yang lebih tinggi ke tenaga lain yang kurang, memancarkan cahaya cahaya (foton). Sumber: Wikimedia Commons. Model atom Bohr mengandaikan bahawa elektron bergerak di orbit bulat di sekitar teras oleh tindakan tarikan elektrostatik coulomb dan mencadangkan bahawa momentum sudut elektron dikira.
Boleh melayani anda: mengimbangi vektor: pengiraan, contoh, latihanMari lihat bagaimana mengintegrasikan kedua -dua konsep dalam bentuk matematik:
Biarkan magnitud momentum sudut, j jisim elektron, dan kelajuan elektron dan radius orbit. Untuk mengira L kita ada:
L = m ⋅ r ⋅V
Bohr mencadangkan bahawa L sama dengan gandaan keseluruhan h/2π, di mana h adalah Planck pemalar, diperkenalkan tidak lama dahulu oleh ahli fizik Max Planck (1858-1947) dalam menyelesaikan masalah tenaga yang dipancarkan oleh badan hitam, objek teoritis yang menyerap semua cahaya kejadian.
Nilainya ialah h = 6.626 × 10-34 J ・ s, sementara di h/2π ia dilambangkan sebagai ħ, Yang dibaca "H bar".
Oleh itu, momentum sudut L tetap:
m⋅ r ⋅ v = nħ, Dengan n = 1.2, 3 ..
Dan dari keadaan ini radio orbit yang dibenarkan untuk elektron disimpulkan, seperti yang akan kita lihat ketika itu.
Pengiraan radius orbit elektron
Dalam apa yang berikut, kita akan menganggap atom yang paling mudah: hidrogen, yang terdiri daripada proton tunggal dan elektron, baik dengan beban magnitud dan.
Daya sentripetal yang menyimpan elektron dalam orbit bulatnya disediakan oleh tarikan elektrostatik, yang magnitud F adalah:
F = ke2/r2
Di mana k adalah pemalar elektrostatik coulomb dan undang-undang r. Mengetahui bahawa dalam pergerakan bulat pecutan sentripetalc Ia diberikan oleh sebab antara persegi kelajuan dan jarak r:
kec = v2 / r
Oleh undang -undang kedua Newton, kekuatan bersih adalah hasil jisim m dengan pecutan:
Mv2/r = ke2/r2
Memudahkan Radio R diperoleh:
M jauh2R = ke2
Menggabungkan ungkapan ini dengan momentum sudut kita mempunyai sistem persamaan, yang diberikan oleh:
Ia boleh melayani anda: trajektori fizikal: ciri, jenis, contoh dan latihan1) mv2R = ke2
2) r = n ħ/mv
Ideanya adalah untuk menyelesaikan sistem dan menentukan r, jejari orbit yang dibenarkan. Algebra asas kecil membawa kepada jawapannya:
R = (nħ)2 / K angani2
Dengan n = 1, 2, 3, 4, 5 ..
Untuk n = 1 kita mempunyai paling sedikit radio, yang dipanggil Bohr Radio aSama ada Dengan nilai 0.529 × 10-10 m. Radio orbit lain dinyatakan dari segi keSama ada.
Dengan cara ini Bohr memperkenalkan nombor kuantum utama n, menunjukkan bahawa radio yang dibenarkan didasarkan pada pemalar planck, pemalar elektrostatik dan jisim dan beban elektron.
Model atom bohr postulates
 Fizik Denmark Niels Bohr (1885-1962).
Fizik Denmark Niels Bohr (1885-1962). Bohr dengan mahir menggabungkan mekanik Newtonian dengan penemuan baru yang terus memberi pada separuh kedua abad ke -19 dan permulaan abad ke -20. Antara mereka konsep revolusioner "berapa banyak", yang mana Planck sendiri mendakwa tidak sangat yakin.
Melalui teorinya, Bohr dapat dengan memuaskan menjelaskan siri spektrum hidrogen dan meramalkan pelepasan tenaga dalam pangkat ultraviolet dan inframerah, yang belum diperhatikan.
Kami dapat meringkaskan postulat anda seperti berikut:
Elektron menggambarkan trajektori bulat
Elektron berkisar di sekitar nukleus dalam orbit bulat yang stabil, dengan pergerakan pekeliling seragam. Pergerakan ini disebabkan oleh daya tarikan elektrostatik yang nukleus menggunakannya.
Momentum sudut dikira
Momentum sudut elektron dikira mengikut ungkapan:
L = mvr = nħ
Di mana n adalah integer: n = 1, 2, 3, 4 ..., yang membawa kepada elektron hanya boleh berada di orbit tertentu, yang radio adalah:
R = (n ħ)2 / k m e2
Elektron memancarkan atau menyerap foton ketika mereka bergerak dari satu keadaan tenaga ke yang lain
 Apabila bergerak dari satu keadaan tenaga ke yang lain, elektron menyerap atau memancarkan tenaga dalam jumlah diskret yang dipanggil foton. Sumber: Wikimedia Commons.
Apabila bergerak dari satu keadaan tenaga ke yang lain, elektron menyerap atau memancarkan tenaga dalam jumlah diskret yang dipanggil foton. Sumber: Wikimedia Commons. Oleh kerana momentum sudut dikira, tenaga dan juga. Ia dapat ditunjukkan bahawa E diberikan oleh:
Boleh melayani anda: pukulan menegak: formula, persamaan, contoh
Elektron Volt atau EV, adalah unit lain untuk tenaga, digunakan secara meluas dalam fizik atom. Tanda negatif tenaga memastikan kestabilan orbit, menunjukkan bahawa kerja harus dilakukan untuk memisahkan elektron dari kedudukan ini.
Walaupun elektron berada di orbitnya tidak menyerap atau memancarkan cahaya. Tetapi apabila ia melompat dari orbit tenaga yang lebih besar ke yang lebih rendah, ia melakukannya.
Kekerapan F dari cahaya yang dipancarkan bergantung kepada perbezaan antara tahap tenaga orbit:
E = hf = epermulaan - efinal
Batasan
Model Bohr mempunyai batasan tertentu:
-Ia hanya berjaya digunakan untuk atom hidrogen. Percubaan untuk menerapkannya ke atom yang lebih kompleks tidak berfungsi.
-Ia tidak bertindak balas mengapa beberapa orbit stabil dan yang lain tidak. Hakikat bahawa tenaga dalam atom dikira bekerja dengan baik, tetapi model itu tidak memberikan alasan, dan itu adalah sesuatu yang menyebabkan ketidakselesaan kepada saintis.
-Satu lagi batasan penting ialah ia tidak menerangkan garis tambahan yang dikeluarkan oleh atom dengan kehadiran medan elektromagnet (kesan zeeman dan kesan stark). Atau mengapa beberapa garis spektrum lebih sengit daripada yang lain.
-Model Bohr tidak menganggap kesan relativistik, yang diperlukan.
-Diperlukan untuk diberikan bahawa adalah mungkin untuk mengetahui dengan tepat kedudukan dan kelajuan elektron, tetapi apa yang benar -benar dikira adalah kebarangkalian bahawa elektron menduduki kedudukan tertentu.
Walaupun terdapat batasannya, model itu berjaya pada masa itu, bukan hanya untuk mengintegrasikan penemuan baru dengan unsur -unsur yang sudah diketahui, tetapi kerana ia menunjukkan soalan -soalan baru, dengan jelas bahawa jalan menuju penjelasan yang memuaskan atom itu dalam mekanik kuantum.
Artikel yang menarik
Model atom Schrödinger.
Model Broglie Atom.
Model Atom Chadwick.
Model Atom Heisenberg.
Model atom Perrin.
Model Thomson Atom.
Model Atom Dalton.
Model Atom Dirac Jordan.
Model Atom Democritus.
Model Atom Leucipo.
Model atom Sommerfeld.
Model atom semasa.


