Model Broglie Atom

- 1400
- 325
- Erick Krajcik
Dia Model Broglie Atom Ia dicadangkan oleh ahli fizik Perancis Louis Broglie pada tahun 1924. Dalam tesis kedoktorannya, Broglie berkata dualitas gelombang-zarah elektron, meletakkan asas-asas mekanik bergelora. Broglie menerbitkan penemuan teoritis penting mengenai sifat gelombang-corpusculus.
Seterusnya pernyataan Broglie ditunjukkan secara eksperimen oleh saintis Clinton Davisson dan Lester Germer, pada tahun 1927. Teori Gelombang Elektron Broglie didasarkan pada cadangan Einstein mengenai sifat -sifat cahaya cahaya dalam panjang gelombang pendek.
 Louis Broglie
Louis Broglie Broglie mengumumkan kemungkinan perkara itu mempunyai tingkah laku yang serupa dengan cahaya, dan mencadangkan sifat serupa dalam zarah subatomik seperti elektron.
Beban elektrik dan orbit menyekat amplitud, panjang dan kekerapan gelombang yang diterangkan oleh elektron. Broglie menjelaskan pergerakan elektron di sekitar nukleus atom.
[TOC]
Ciri -ciri model atom Broglie
Untuk membangunkan cadangan mereka, Broglie bermula dari prinsip bahawa elektron mempunyai sifat ganda antara gelombang dan zarah, serupa dengan cahaya.
Dalam erti kata itu, Broglie membuat simile antara kedua -dua fenomena, dan berdasarkan persamaan yang dibangunkan oleh Einstein untuk mengkaji sifat cahaya yang beralun, kata berikut:
- Jumlah tenaga foton dan, akibatnya, jumlah tenaga elektron, hasil dari produk frekuensi gelombang dan pemalar papan (6,62606957 (29) × 10 -3. 4 Jules x saat), seperti yang terperinci dalam ungkapan berikut:

Dalam ungkapan ini:
E = tenaga elektron.
H = pemalar papan.
F = Frekuensi Gelombang.
- Momen linear foton, dan oleh itu, elektron, berkadar songsang dengan panjang gelombang, dan kedua -dua magnitud berkaitan melalui pemalar papan:
Boleh melayani anda: osmosis terbalik: bagaimana ia berfungsi, apa itu, contohnya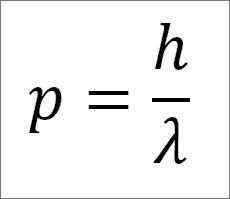
Dalam ungkapan ini:
P = momen linear elektron.
H = pemalar papan.
λ = panjang gelombang.
- Momen linear adalah hasil jisim zarah kerana kelajuan yang dikatakan zarah telah semasa anjakannya.
Jika ungkapan matematik sebelumnya disusun semula bergantung kepada panjang gelombang, berikut adalah:
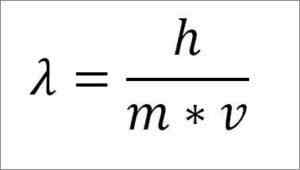
Dalam ungkapan itu:
λ = panjang gelombang.
H = pemalar papan.
M = jisim elektron.
V = kelajuan elektron.
Oleh kerana h, pemalar papan, mempunyai nilai kecil, panjang gelombang λ juga. Oleh itu, adalah mungkin menyatakan bahawa sifat gelombang elektron hanya dibentangkan pada tahap atom dan subatomik.
- Broglie juga berdasarkan postulat Model Atom Bohr. Menurut yang terakhir, orbit elektron adalah terhad dan hanya boleh menjadi gandaan dari seluruh nombor. Jadi:
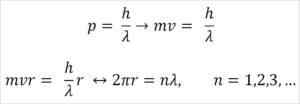
Di mana:
λ = panjang gelombang.
H = pemalar papan.
M = jisim elektron.
V = kelajuan elektron.
R = jejari orbit.
n = keseluruhan nombor.
Menurut model atom Bohr, yang mana Broglie diterima pakai sebagai pangkalan, jika elektron berkelakuan sebagai gelombang pegun, satu -satunya orbit yang dibenarkan adalah mereka yang jejari sama dengan seluruh gandaan panjang gelombang λ.
Oleh itu, tidak semua orbit mematuhi parameter yang diperlukan untuk elektron untuk menggerakkannya. Inilah sebabnya mengapa elektron hanya dapat bergerak di orbit tertentu.
Teori Gelombang Elektron Broglie membenarkan kejayaan model atom Bohr untuk menerangkan tingkah laku elektron unik atom hidrogen.
Boleh melayani anda: bateri keringBegitu juga, beliau juga memberi lampu tentang mengapa model ini tidak menyesuaikan diri dengan sistem yang lebih kompleks, iaitu atom dengan lebih daripada satu elektron.
Eksperimen Davisson dan Germer
Pemeriksaan eksperimen model atom Broglie berlangsung 3 tahun kemudian penerbitannya, pada tahun 1927.
Ahli fizik AS terkemuka Clinton J. Davisson dan Lester Germer secara eksperimen mengesahkan teori mekanik beralun.
Davisson dan Germer melakukan ujian penyebaran rasuk elektron melalui kristal nikel dan memerhatikan fenomena difraksi melalui persekitaran logam.
Eksperimen yang dijalankan terdiri daripada menjalankan prosedur berikut:
- Pada mulanya, perhimpunan dengan rasuk elektron diletakkan yang mempunyai tenaga awal yang diketahui.
- Sumber voltan dipasang untuk mempercepat pergerakan elektron yang menghasut perbezaan yang berpotensi.
- Aliran rasuk elektron ke kaca logam diarahkan; Dalam kes ini, nikel.
- Bilangan elektron yang melanda kaca nikel diukur.
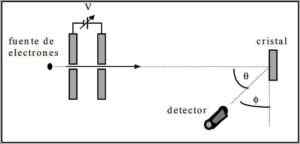
Pada akhir eksperimen, Davisson dan Germer mengesan bahawa elektron tersebar ke arah yang berbeza.
Apabila mengulangi eksperimen menggunakan kristal logam dengan orientasi yang berbeza, saintis mengesan perkara berikut:
- Penyebaran rasuk elektron melalui kaca logam adalah setanding dengan fenomena gangguan dan difraksi sinar cahaya.
- Refleksi elektron pada kaca impak menggambarkan trajektori yang, secara teorinya, harus menggambarkan mengikut teori gelombang elektron broglie.
Pendek kata, percubaan Davisson dan germer secara eksperimen membuktikan sifat gelombang dua zarah elektron.
Boleh melayani anda: Pautan kovalen kutub: Ciri dan contohBatasan
Model atom Broglie tidak meramalkan lokasi sebenar elektron di orbit di mana ia bergerak.
Dalam model ini, elektron dianggap sebagai gelombang yang digerakkan di seluruh orbit tanpa lokasi tertentu, yang memperkenalkan konsep orbital elektronik.

Di samping itu, model atom Broglie, yang sama dengan model Schrödinger, tidak menganggap putaran elektron pada paksi yang sama (berputar).
Dengan mengabaikan momentum elektron sudut intrinsik, variasi spatial zarah subatomik ini ditinggalkan.
Dalam urutan idea yang sama, model ini juga tidak mengambil kira perubahan dalam tingkah laku elektron cepat akibat kesan relativistik.
Artikel yang menarik
Model atom Schrödinger.
Model Atom Chadwick.
Model Atom Heisenberg.
Model atom Perrin.
Model Thomson Atom.
Model Atom Dalton.
Model Atom Dirac Jordan.
Model Atom Democritus.
Model Atom Leucipo.
Model Atom Bohr.
Model atom semasa.
Rujukan
- Teori Kuantum Bohr dan Gelombang De Broglie (s.F.). Pulih dari: ne.Phys.Kyushu-u.Ac.J
- Louis de Broglie - Biografi (1929). © The Nobel Foundation. Pulih dari: Nobelprize.org
- Louis-Victor de Broglie (s.F.). Diperolehi daripada: Chemed.Chem.Purdue.Edu
- Lovett, b. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Pulih dari: Britannica.com
- Model Atom De Broglie. Universiti Negara Pendidikan Jarak Jauh. Sepanyol. Pulih dari: ocw.Innova.Tidak.adalah
- Louis de Broglie.F.). Pulih dari: hiru.Eus
- Von Pamel, atau., Dan Marchisio, s. (s.F.). Mekanik kuantum. Universiti Kebangsaan Rosario. Pulih dari: fceia.a r.Edu.ar

