Kaedah pengimbangan algebra (dengan contoh)

- 2332
- 675
- Clarence Greenholt DDS
Dia Kaedah keseimbangan algebra Ia digunakan dalam kimia untuk memadankan bilangan atom di kedua -dua belah tindak balas kimia. Reaksi kimia yang ditulis dengan betul, mesti mempunyai formula semua reagen yang mengambil bahagian di sebelah kiri dan produk, juga dengan formula mereka, di sebelah kanan.
Walau bagaimanapun, apabila anda mempunyai tindak balas, bilangan atom dalam formula reagen sama dengan atom masing -masing dalam formula produk tidak selalu tidak selalu.
 Rajah 1. Kaedah pengimbangan algebra adalah alat mudah untuk mengimbangi persamaan kimia. Sumber: f. Zapata.
Rajah 1. Kaedah pengimbangan algebra adalah alat mudah untuk mengimbangi persamaan kimia. Sumber: f. Zapata. Walau bagaimanapun, doh dipelihara. Sebagai contoh, mari kita lihat reaksi berikut:
KCl3 → kcl + o2
Persamaan ini mempunyai sebatian yang dipanggil kalium klorat, yang dipecahkan oleh pemanasan dalam kalium klorida dan oksigen gas. Tetapi apabila menonton dengan teliti, kita perhatikan bahawa dalam molekul klorat terdapat 3 atom oksigen, sementara di sebelah kanan hanya terdapat satu molekul oksigen gas dengan 2 atom.
Apa yang dilakukan kemudian adalah untuk membiak dengan pekali berangka kepada reagen kiri, sehingga bilangan atom semua elemen yang mengambil bahagian adalah sama sebelum dan selepas reaksi.
Tetapi ... apakah nilai pekali ini?
[TOC]
Cara Mengimbangi Persamaan
Dalam persamaan sebelumnya, mudah untuk menentukan pekali yang sesuai dengan pemeriksaan. Sekiranya kita membiak dengan 2 di sebelah kiri kita mempunyai 2 atom k, 2 dari Cl dan 6 dari O.
Oleh itu, ke kanan kita melipatgandakan kalium klorida dengan 2 dan o2 oleh 3:
2 kclo3 → 2kcl + 3o2
Dan sekarang kita dapat melihat bahawa perakaunan itu betul di kedua -dua belah anak panah dan reaksi itu seimbang. Perhatikan bahawa nilai berangka lain juga boleh menghasilkan persamaan yang seimbang, sebagai contoh:
Boleh melayani anda: asid borik: struktur kimia, sifat, penyediaan, kegunaan4 kclo3 → 4kcl + 6o2
Walau bagaimanapun, set nombor minimum yang sama dengan jumlah atom di kedua -dua belah pihak harus selalu dicari.
Nombor yang melipatgandakan setiap formula dipanggil Koefisien. Sangat penting untuk diperhatikan bahawa pekali boleh diberikan untuk mengimbangi, tetapi subskrip mesti kekal ketika ia muncul dalam setiap formula.
Koefisien tidak boleh dimasukkan di tengah -tengah formula setiap sebatian, kerana ia akan mengubahnya.
Persamaan mudah seperti contoh boleh seimbang dengan pemeriksaan atau skor. Bagi mereka yang sedikit lebih kompleks terdapat kaedah algebra dengan satu siri langkah mudah dan operasi aritmetik asas yang terperinci di bawah.
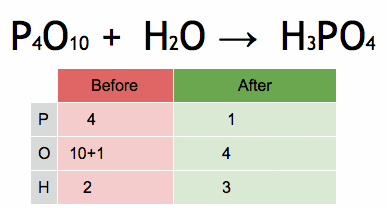 Rajah 2. Animasi yang menunjukkan keseimbangan persamaan kimia untuk mendapatkan asid fosforik. Sumber: Wikimedia Commons. Ephert/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0)
Rajah 2. Animasi yang menunjukkan keseimbangan persamaan kimia untuk mendapatkan asid fosforik. Sumber: Wikimedia Commons. Ephert/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/4.0) Langkah -langkah untuk mengimbangi persamaan kimia secara algebra
Langkah 1
-Berikan kepada setiap molekul pekali sewenang -wenangnya, dilambangkan oleh surat. Lirik A, B, C, D .. ., Sebagaimana yang diperlukan.
Penting: Ingatlah bahawa hanya pekali yang digunakan oleh molekul dan tidak pernah diselingi di tengah -tengahnya, ia selalu diletakkan di sebelah kiri.
Langkah 2
-Buat senarai setiap elemen yang mengambil bahagian.
Langkah 3
-Letakkan pekali atau koefisien yang diberikan kepada setiap sebatian ke kiri dan padankan mereka di sebelah kanan. Sekiranya terdapat subskrip, mereka membiak dengan pekali untuk mencari jumlah atom.
Dan jika ada elemen yang terdapat dalam lebih daripada satu molekul, jumlah atom yang terdapat di setiap sisi ditambah. Dengan cara ini Persamaan separa setiap elemen.
Langkah 4
-Nilai berangka diberikan kepada salah satu pekali. Biasanya nilai berangka ini adalah 1 dan diberikan kepada surat yang kelihatan lebih banyak kali. Ini mencapai persamaan mudah yang berfungsi sebagai titik permulaan untuk mencari pekali lain.
Boleh melayani anda: faktor pencairanLangkah 5
-Tentukan nilai pekali berikut dengan aritmetik mudah dan ganti nilainya dalam persamaan lain, untuk meningkatkan yang baru.
Langkah 6
-Ulangi langkah sebelumnya untuk menggantikan nilai dan buat persamaan baru, sehingga anda dapati semua pekali.
Langkah 7
-Ganti nilai yang ditentukan dengan demikian. Sekiranya nilai -nilai ini keseluruhan, mesti disahkan bahawa persamaan itu seimbang. Sekiranya mereka tidak keseluruhannya, ia didarabkan dengan pelbagai minimum yang biasa dari penyebut dan baki diperiksa.
Kemudian kami akan memvisualisasikan penerapan langkah -langkah ini dalam resolusi beberapa contoh.
Contoh mengimbangi yang diselesaikan
Contoh 1
Mengimbangi tindak balas berikut jika perlu, melalui kaedah algebra:
N2Sama ada5 → n2Sama ada4 + Sama ada2
Penyelesaian
Kami melihat bahawa tindak balas tidak seimbang, kerana walaupun terdapat 2 atom nitrogen di kedua -dua belah pihak, dengan oksigen kuantiti di sebelah kiri dan kanan berbeza.
Kemudian kita mesti mengikuti langkah -langkah yang diterangkan dalam bahagian sebelumnya:
-Kami menulis persamaan sekali lagi dan membiak setiap molekul dengan pekali yang berbeza. Huruf kecil dipilih supaya mereka tidak keliru dengan unsur -unsur:
A ⋅N2Sama ada5 → B angani2Sama ada4 + C ⋅O2
-Sekarang kita menyenaraikan setiap elemen dan sepadan dengan jumlah elemen itu ke kiri dan kanan. Ini adalah persamaan separa bagi setiap elemen:
- A ⋅N2 = B ⋅N2
- A ⋅o5 = B⋅o4 + C ⋅O2
-Mengalikan pekali dan subskrip kami memperoleh bilangan atom nitrogen. Dari Persamaan 1 kita dapat:
2a = 2b
-Persamaan 2 mempunyai 5th atom oksigen ke kiri, sementara di sebelah kanan ada 4b dan 2 c:
5a = 4b + 2c
-Kami memberikan nilai 1 kepada pekali A, dengan cara ini:
A = 1
Pilihan ini sewenang -wenangnya, ia juga boleh dipilih pertama b = 1.
-Nilai -nilai ini digantikan dalam Persamaan 2, untuk menentukan nilai C:
Ia boleh melayani anda: Cupric Oxide (CUO)5 = 4 + 2c
2c = 5-4 = 1
C = ½
-Kami menggantikan pekali dalam persamaan asal, 1 tidak perlu menulis secara eksplisit:
N2Sama ada5 → n2Sama ada4 + ½ o2
-Oleh kerana lebih baik pekali keseluruhannya, keseluruhan persamaan didarabkan oleh pelbagai minimum yang biasa dari penyebut, iaitu 2 dan 1:
m.c.m. (1.2) = 2
Kemudian, dengan mengalikan kiri dan kanan dengan 2, ia diperolehi:
2n2Sama ada5 → 2n2Sama ada4 + Sama ada2
Dan kami mengira bilangan atom di kedua -dua belah pihak, untuk memeriksa baki:
- N ke kiri: 4
- Atau kiri: 10
- N ke kanan: 4
- Atau betul: 8 + 2 = 10
Contoh 2
Keseimbangan tindak balas kimia berikut:
Nahco3 → NA2Co3 + H2Atau + co2
Penyelesaian
Kami membiak setiap molekul dengan pekali yang berbeza:
A ⋅ nahco3 → b ipa2Co3 + C ⋅H2O + D ⋅CO2
Kemudian kami mencadangkan perakaunan setiap elemen di sebelah kanan dan di sebelah kiri anak panah. Terdapat sejumlah 4 elemen dalam tindak balas: natrium na; Hidrogen H; kereta kereta dan oksigen atau, semua mesti dikira:
- A ⋅ na = b ⋅ na2
- a ⋅H = c ⋅H2
- A ⋅ c = b ⋅ c + d ⋅ c
- A ⋅o3 = B⋅o3+C ⋅o+D ⋅O2
Menurut setiap baki, persamaan berikut diperoleh:
1) A = 2b
2) A = 2c
3) A = B + D
4) a = 3b + c + 2d
Pekali yang paling berulang adalah ke, Oleh itu, kami memberikan nilai 1:
A = 1
Jadi:
1) a = 2b ⇒ b = ½
2) A = 2c ⇒ C = ½
3) A = B + D ⇒ D = A - B = 1 - ½ = ½
Kami menggantikan pekali dalam persamaan:
Nahco3 → ½. Na2Co3 + ½. H2O + ½.Co2
Kami membiak di kedua -dua belah anak panah dengan 2, kerana ia adalah satu -satunya penyebut yang hadir, untuk menghapuskan pecahan:
2nahco3 → NA2Co3 + H2Atau + co2
Kami mengira bilangan atom yang hadir di sebelah kiri: 2 atom Na, H dan C dan 6 dari O. Pembaca boleh mengesahkan bahawa setiap daripada mereka juga hadir di sebelah kanan dalam kuantiti yang sama.
Rujukan
- Atkins, ms. Prinsip Kimia: Laluan Penemuan. Pan -American Editorial. Edisi ke -3.
- Briceño, j. Panduan Kimia USB. Pulih dari: gecousb.com.Pergi.
- Chang, R. 2013. Kimia. 11va. Edisi. Pendidikan MC Graw Hill.
- Latihan yang diselesaikan. Mengimbangi algebra. Diperolehi daripada: Latihan Dihantar.co.
- Simoza, l. Mengimbangi persamaan kimia. Pulih dari: guao.org.

