Struktur kimia nitrat barium, kegunaan, sifat

- 2868
- 233
- Julius Dibbert
Dia barium nitrat Ia adalah garam yang terdiri daripada atom barium (BA) dan ion nitrat (tidak3). Ia dibentangkan sebagai pepejal kristal putih pada suhu bilik dan wujud sebagai mineral yang sangat jarang dikenali sebagai nitrobarita. Sifatnya menjadikannya sebatian toksik yang mesti diuruskan dengan teliti.
Malah, sebatian ini mempunyai banyak kegunaan dalam industri ketenteraan, kerana ia dapat dikaitkan dengan bahan kimia lain dan ditambah kepada formulasi letupan dan pembakar, antara lain.
 Barium nitrate penampilan. Sumber: w. OELEN/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0)
Barium nitrate penampilan. Sumber: w. OELEN/CC BY-SA (https: // creativeCommons.Org/lesen/by-sa/3.0) [TOC]
Formula
Barium nitrat, juga dikenali sebagai barium dyitrate, mempunyai formula bahan kimia (tidak3)2, dan biasanya dihasilkan melalui dua kaedah.
Yang pertama melibatkan pembubaran kepingan kecil barium karbonat (Bacchus3) Dalam medium sederhana -asid (hno3, asid mineral yang sangat menghakis), yang membolehkan kekotoran besi untuk mendakan dan kemudian campuran ini ditapis, disejat dan kristal.
Kaedah kedua dilakukan melalui gabungan barium klorida (BACL2, Salah satu garam barium kelarutan yang lebih besar di dalam air) dengan penyelesaian nitrat natrium yang dipanaskan. Ini menghasilkan tindak balas yang mengakibatkan pemisahan kristal barium nitrat campuran.
Struktur kimia barium nitrat
Garam ini membentangkan ciri -ciri struktur kristal padu atau octaedros anhydrous.
Struktur kimianya adalah seperti berikut:
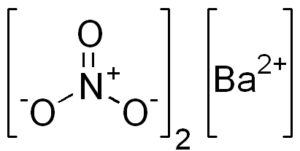
Penyisihan
Pada suhu tinggi (592 ºC), barium nitrat terurai untuk membentuk barium oksida (BAO), nitrogen dioksida (tidak2) dan oksigen (atau2), Menurut tindak balas kimia berikut:
Boleh melayani anda: Beryl Hydroxide (Be (OH) 2)2BA (no3)2 + Haba → 2bao + 4no2 +Sama ada2
Dalam media dengan kepekatan tinggi nitrik oksida (NO), penguraian barium nitrat menghasilkan sebatian yang dipanggil barium nitrite (BA (tidak2)2), Mengikut persamaan berikut:
Bilik mandi3)2 + 2no → ba (tidak2)2 + 22
Reaksi dengan logam larut atau sulfat asid sulfurik (h2SW4) Menjana barium sulfat (BASO4). Sebilangan besar garam barium yang tidak larut, seperti karbonat (Bacchus3), Oxalate (BAC2Sama ada4) atau fosfat logam (BA3(PO4)2), dicetuskan oleh tindak balas penguraian yang sama.
Barium Nitrate menggunakan
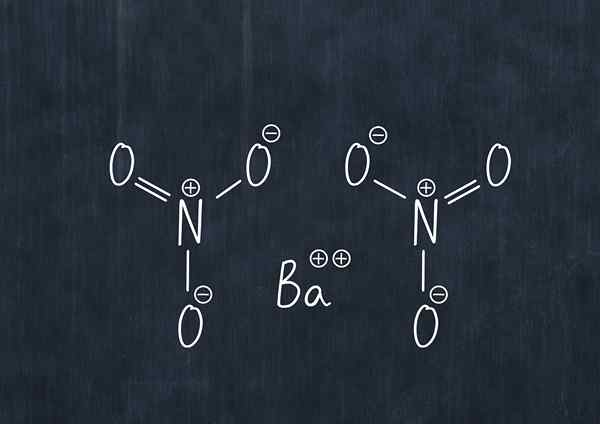 Formula kimia barium nitrat
Formula kimia barium nitrat Bahan ini dalam habuk adalah agen pengoksidaan dan bertindak balas dengan ketara dengan ejen pengurangan biasa.
Apabila garam ini dicampur dengan logam lain, seperti aluminium atau zink dalam bentuknya yang dibahagikan dengan halus, atau dengan aloi seperti aluminium-magn0esio, ia menghidupkan dan mengeksploitasi kesannya. Atas sebab ini, barium nitrat dianggap sebagai komponen senjata dan bahan peledak yang sangat baik.
Bersama Trinitrotoluene (secara komersil dikenali sebagai TNT, atau C6H2(Tidak2)3Ch3) dan pengikat (lilin parafin kerap), garam ini membentuk sebatian yang dipanggil baratol, yang mempunyai sifat letupan. Ketumpatan tinggi barium nitrat menyebabkan baratol juga memperoleh ketumpatan yang lebih besar, menjadikannya lebih berkesan dalam fungsinya.
Barium Nitrate juga menyertai habuk aluminium, formula yang menghasilkan pembentukan serbuk mesiu, yang digunakan terutamanya dalam bunga api dan piroteknik teater.
Kilauan ini juga telah melihat kegunaan dalam pengeluaran suar (seperti langkah antimile kapal terbang) dan dalam bom tangan yang terkejut. Di samping itu, bahan ini sangat meletup.
Ia boleh melayani anda: Natrium Cyanide (NACN): Struktur, Hartanah, Risiko, KegunaanGaram ini digabungkan dengan campuran reaktan yang dipanggil termite untuk membentuk variasi termat yang disebut ini, yang menghasilkan kelip -kelip pendek dan sangat kuat suhu tinggi di kawasan kecil untuk masa yang singkat.
Termate-TH3 adalah termat yang mengandungi komposisi 29 % oleh berat barium nitrat, yang membantu meningkatkan kesan haba, menghasilkan api dan mengurangkan suhu pencucuhan termat.
Theroots biasanya digunakan dalam pengeluaran bom tangan yang membakar dan mempunyai fungsi memusnahkan perisai dan struktur tangki tentera.
Di samping itu, barium nitrat adalah salah satu bahan yang paling banyak digunakan dalam pengeluaran caj pembakar yang digunakan oleh British dalam kapal terbang mereka semasa Perang Dunia II, yang bersenjata dengan peluru pembakar yang berfungsi untuk memusnahkan pesawat musuh.
Akhirnya, garam ini telah digunakan dalam proses pembuatan barium oksida, dalam industri injap thermionic dan, seperti yang telah dikatakan, dalam penciptaan piroteknik, terutama warna hijau.
Sifat fizikal dan kimia
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Garam dibentangkan sebagai pepejal putih, hygroscopic dan tandas, yang sedikit larut dalam air dan tidak larut dalam alkohol.
Ia mempunyai jisim molar sebanyak 261,337 g/mol, ketumpatan 3.24 g/cm3 dan titik gabungan 592 ºC. Setelah sampai ke titik mendidihnya, ia telah rosak, seperti yang telah dikatakan di atas. Pada suhu bilik, ia mempunyai kelarutan air 10.5 g/100 ml.
Ia dianggap stabil, tetapi ia adalah ejen pengoksidaan yang kuat dan mesti jauh dari bahan mudah terbakar untuk mengelakkan kebakaran. Ia mempunyai kepekaan air dan tidak boleh dicampur dengan asid atau anhydrous.
Boleh melayani anda: isotherms penjerapan: konsep, jenis, contohDalam kepekatan yang tinggi (contohnya, bekas) mesti diasingkan dari bahan yang dapat membuatnya bertindak balas, kerana ia dapat mengeksploitasi dengan ganas.
Seperti mana -mana sebatian barium yang lain, ia adalah bahan toksik untuk haiwan dan manusia.
Ia tidak boleh dihirup atau dimakan, kerana gejala keracunan (terutamanya pengerasan otot muka), muntah, cirit -birit, sakit perut, gegaran otot, kecemasan, kelemahan, kesusahan pernafasan, ketidakteraturan jantung dan kejang dan kejang.
Kematian boleh berlaku berikutan keracunan dengan bahan ini, beberapa jam atau beberapa hari selepas menyampaikan.
Penyedutan nitrat barium menghasilkan kerengsaan dalam mukosa pernafasan dan, dalam kedua -dua mod keracunan, penyelesaian garam sulfat mesti disediakan untuk memohon pertolongan cemas kepada yang terjejas.
Sekiranya tumpahan, ia mesti diasingkan dari bahan dan bahan yang mudah terbakar dan, dalam kes -kes kebakaran, anda tidak boleh bersentuhan dengan bahan kimia atau busa kering. Kawasan mesti dibanjiri air jika api lebih besar.
Rujukan
- Mabus. (s.F.). Sciencemadness. Diperolehi dari Sciencemadness.org
- Bom Inceniary Amerika Syarikat TH3-M50A3. (s.F.). Diperoleh dari peluru.com
- Cameo Chemicals. (s.F.). Diperolehi daripada cameochemicals.Noaa.Gov
- Chemspider. (s.F.). Diperolehi daripada chemspider.com

