Struktur, Kno2) Struktur, Harta dan Kegunaan Potassium

- 4147
- 163
- Mr. Tracy Parisian
Dia Potassium nitrite Ia adalah garam bukan organik yang formula kimianya seperti2, yang berkaitan secara kimia dan farmakologi dengan kalium nitrat3. Penampilan fizikalnya terdiri daripada kristal putih kekuningan, sangat hygroscopic, dan oleh itu, kecemasan; iaitu, mereka membubarkan dengan cepat di persekitaran yang lembap.
Formulanya menunjukkan bahawa perkadaran k+ dan tidak2- Ia adalah 1: 1, dan tetap bersatu dengan kuasa elektrostatik atau hubungan ionik. Sumber semulajadi murni tidak dijumpai untuk kristal mereka, walaupun anion niter boleh didapati di tanah, baja, tumbuh -tumbuhan dan haiwan.
 Potassium nital kristal. Sumber: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]
Potassium nital kristal. Sumber: Leiem [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)] Imej atas menunjukkan bagaimana rupa kristal kno2, Dengan nada kuning yang jelas. Jika kristal ini dibiarkan bersentuhan dengan udara, mereka akan menyerap kelembapan untuk menjadi penyelesaian berair; penyelesaian yang telah menghasilkan kontroversi berkenaan dengan sama ada penggunaannya bermanfaat atau tidak.
Sebaliknya, kristalnya, di bawah kuantiti yang sangat kecil (200 ppm), digunakan untuk menghidupkan daging dan menjamin pemuliharaan mereka terhadap tindakan bakteria. Juga, KNO2 Meningkatkan warna daging, menjadikannya lebih kemerahan; Walau bagaimanapun, ia tertakluk kepada beberapa sekatan untuk mengelakkan kesan toksik garam ini pada badan.
[TOC]
Struktur nitrit kalium
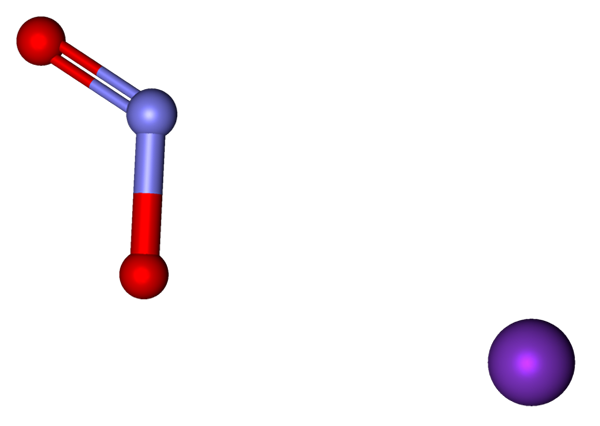 Ion yang membentuk KNO2 yang diwakili dengan model sfera dan bar. Sumber: Marinavladivok [CC0].
Ion yang membentuk KNO2 yang diwakili dengan model sfera dan bar. Sumber: Marinavladivok [CC0]. Ion yang terdapat dalam nitrit kalium ditunjukkan di atas. Kation k+ sepadan dengan sfera ungu, sementara anion tidak2- Ia diwakili oleh sfera kebiruan dan merah.
Anion no2- Ia ditunjukkan dengan ikatan berganda dan mudah [O = N-O]-; Tetapi pada hakikatnya, kedua -dua pautan adalah sama dengan hasil resonans beban negatif di antara mereka.
The k ion+ dan tidak2- Mereka menarik satu sama lain di ruang angkasa untuk mengatur corak struktur dengan tenaga paling sedikit; Ini, di mana penolakan antara beban yang sama adalah minimum. Oleh itu, kristal kno percaya2, sel unitnya terdedah kepada perubahan suhu, peralihan fasa mana.
Boleh melayani anda: Stanislao CannizzaroContohnya, pada suhu rendah (kurang daripada 25 ° C) kristal KNO2 Mengamalkan sistem monoklinik (Fasa I). Apabila suhu melebihi 25 ° C, peralihan fasa monoklinik rhomboébic berlaku (Fasa II). Akhirnya, melebihi 40 ° C kristal KNO2 Tukar menjadi padu (Fasa III).
Juga, KNO2 boleh mempamerkan fasa kristal lain (Fasa IV, V dan VI) di bawah tekanan tinggi. Dengan ini, k ion+ dan tidak2- Mereka akhirnya bergerak dan dipesan dengan cara yang berbeza dalam kristal tulen mereka.
Sifat
Jisim molekul
85,1038 g/mol.
Ketumpatan
1,9150 g/ml.
Takat lebur
440.02 ° C (tetapi mula pecah dari 350 ° C, memancarkan asap toksik).
Takat didih
537 ° C (letupan).
Kelarutan air
312 g/ 100 g air pada 25 ° C.
Delicuescence
Kelarutannya dalam air adalah sedemikian rupa sehingga hygroscopic; Begitu banyak, yang mempamerkan kelebihan, menyerap kelembapan yang mencukupi untuk dibubarkan. Hubungan ini untuk air mungkin disebabkan oleh kestabilan tenaga yang mendapat keuntungan+ Apabila menghidrat, serta entalpi rangkaian kristal yang rendah untuk kristal KNO2.
Kristal boleh menyerap air tanpa melarutkan menjadi hidrat2· H2Sama ada. Dalam menghidrat molekul air mengiringi ion, yang mengubah struktur kristal.
Hydrate ini (atau beberapa daripada mereka) boleh dibentuk di bawah -9 ° C; Pada suhu yang lebih tinggi, air larut dan menghidrat ion, mengubah bentuk kaca.
Kelarutan dalam pelarut lain
Sedikit larut dalam alkohol panas, dan sangat larut dalam ammonia.
Ph
6-9. Oleh itu, penyelesaian berairnya adalah alkali, kerana anion tidak2- Ia boleh menghidrolisis.
Nomenclature
Ke kno2 Ia juga boleh dinamakan dengan cara lain. 'Potassium Nitrite' sepadan dengan nama garam ini mengikut tatanama saham; 'Potassium Nitrito', menurut tatanama yang sistematik, di mana satu -satunya valensi kalium, +1 diserlahkan; dan dioxonitrate (iii) kalium, menurut tatanama sistematik.
Ia boleh melayani anda: Dibenzalacetona: sifat, mekanisme tindak balas, kegunaan, risikoPotassium 'dioxonitrate (iii), menyoroti valensi +3 atom nitrogen. Malah nama yang paling disyorkan oleh IUPAC untuk KNO2, 'Potassium Nitrite' terus menjadi yang paling selesa dan paling mudah diingat.
Memperoleh
Cara yang paling langsung untuk mensintesisnya, tetapi dengan prestasi yang lebih rendah, adalah melalui penguraian termal kalium nitrat atau garam pada 400 ° C atau lebih:
2kno3 => Kno2 + Sama ada2
Walau bagaimanapun, sebahagian daripada KNO2 berakhir dengan decomposing oleh haba, sebagai tambahan kepada produk lain.
Kaedah lain untuk menyediakan atau mensintesisnya dengan prestasi yang lebih tinggi adalah dengan mengurangkan KNO3 Di hadapan plumbum, tembaga atau zink. Persamaan untuk tindak balas ini adalah seperti berikut:
Kno3 + Pb => kno2 + Pbo
Potassium dan Lead Nitrate bercampur dengan stoikiometri dalam kuali besi, di mana mereka bergabung dengan pengadukan dan pemanasan yang berterusan selama setengah jam. Lead Oxide (II) berwarna kuning, dan adunan yang dihasilkan panas dan dirawat dengan air mendidih. Kemudian penapis campuran panas.
Gelembung penapis panas dengan karbon dioksida selama lima minit, yang akan mendakan karbonat plumbum, PBCO3, tidak larut. Dengan cara ini pendahuluan selesai. Asid nitrik yang dicairkan ke penapisan ditambah sehingga pH adalah neutral, ia dibenarkan untuk menyejukkan, dan akhirnya air menguap sehingga kristal KNO terbentuk2.
Aplikasi
Aditif dan reagen
Potassium Nitrite digunakan sebagai bahan tambahan untuk menyembuhkan daging merah, mengekalkan rasa mereka dan lebih banyak warna semasa penyimpanan, sementara menangguhkan tindakan bakteria dan toksin tertentu, seperti botulinik. Oleh itu, ia mempamerkan tindakan antibakteria.
Kno2 Ia tidak mengoksidakan, yang bertindak balas dengan myoglobin daging dan, akibatnya, akhirnya mengubahsuai warna merah semula jadi. Kemudian, apabila daging dimasak, ia memperoleh warna merah jambu yang kuatnya ciri.
Boleh melayani anda: 20 contoh penyejatan dan ciri kimiaWalau bagaimanapun, dalam keadaan tanpa menentukan KNO2 bertindak balas dengan protein daging untuk menimbulkan nitrosamine, yang boleh menjadi karsinogenik.
Sebaliknya, KNO2 (Walaupun sebaiknya nano2) Ia adalah reagen analitik yang boleh digunakan dalam sintesis pewarna azoik (reaksi asid nitrous dengan amina aromatik), dan dalam analisis asid amino.
Penawar
Walaupun ia mempunyai kesan negatif, KNO2 Ia bertindak sebagai penawar pada pesakit beracun dengan sianida dan hidrogen sulfida. Mekanisme adalah untuk mengoksidakan pusat iman2+ untuk iman3+ Daripada kumpulan yang kita ada dari hemoglobin, menghasilkan methemoglobin, yang kemudiannya bertindak balas dengan anion CN- dan HS-.
Doktor
Dalam jus perut perut anion tidak2- Ia dikurangkan kepada tidak, yang diketahui mempunyai tindakan vasodilator, meningkatkan aliran darah. Di kawasan lain badan di mana pH tidak cukup asid, beberapa enzim, seperti xanthina teroksida, bertanggungjawab untuk mengurangkan bukan -2-.
KNO telah digunakan2 untuk merawat penyakit dan penyakit seperti angina dada dan epilepsi (dengan kesan sampingan yang sangat negatif).
Rujukan
- Wikipedia. (2019). Potassium nitrite. Diperoleh dari: dalam.Wikipedia.org
- Prebchem. (2016). Penyediaan Potassium Nitrite. Pulih dari: prepchem.com
- Mark Gilchrist, Angela C. Pantai, Nigel Benjamin. (2011). Nitrat dan nitrit tak organik dan kawalan tekanan darah, penyelidikan kardiovaskular, kelantangan 89, isu 3, 15 Februari 2011, halaman 492-498, doi.org/10.1093/CVR/CVQ309
- Pubchem. (2019). Potassium nitrite. Pulih dari: pubchem.NCBI.NLM.NIH.Gov
- Perumusan kimia. (2018). Potassium nitrite. Pulih dari: formulasi quimica.com
- Pusat Kebangsaan untuk Memajukan Sains Translasi. (2011). Potassium nitrite. Pulih dari: dadah.ncats.Io
- Richard J. Eley, Paul B. Addis, dan Joseph J. Wartheen. (1992). Nitrit dalam daging. Universiti Minnesota.
- N. R. Rao, b. Prakash, dan m. Natarajan. (1975). Transformasi struktur kristal dalam nitrit tak organik, nitrat, dan karbonat. Jabatan Kimia, Institut Teknologi India, Kanpur, India.

