Struktur, sifat, penggunaan, risiko natrium sodium (Nano2)

- 2926
- 923
- Julius Dibbert
Dia Natrium nitrit Ia adalah pepejal anorganik kristal yang dibentuk oleh natrium na ion+ dan ion nitrit no2-. Formula kimianya adalah nano2. Ia adalah pepejal kristal putih yang cenderung menyerap air dari alam sekitar, iaitu, ia adalah hygroscopic.
Di hadapan udara perlahan -lahan mengoksidakan nitrat nitrat3. Ia mempunyai sifat pengoksidaan (sebatian lain yang teroksida) dan juga pengurangan (ia dioksidakan oleh sebatian lain).
 Nano sodium nitrite2. Aleksander Sobolewski melalui Wikimedia Commons [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons.
Nano sodium nitrite2. Aleksander Sobolewski melalui Wikimedia Commons [CC BY-SA 4.0 (https: // creativeCommons.Org/lesen/by-sa/4.0)]. Sumber: Wikimedia Commons. Ia hadir dalam organisma manusia secara semulajadi dan digunakan sebagai pengawet daging sembuh dan ikan asap kerana ia menghindari pertumbuhan mikroorganisma berbahaya.
Ia mempunyai penggunaan penting dalam rawatan segera keracunan sianida, kerana kesan toksik dan maut sebatian tersebut berkurangan. Walau bagaimanapun, ia mesti diberikan dengan berhati -hati dan tidak berfungsi dalam semua kes.
Telah didapati bahawa ia dapat menghalang jangkitan mata yang disebabkan oleh pencemaran kanta sentuh oleh mikroorganisma. Beberapa kajian menunjukkan bahawa penggunaan mereka dengan makanan boleh menyebabkan kanser, tetapi dianggarkan bahawa ini dapat dielakkan dengan makan vitamin C dengan makanan tersebut.
[TOC]
Struktur
Natrium nitrit dibentuk oleh sodium na cation+ Dan anion nitrit2-.
Dalam anion nitrit no2- Nitrogen mempunyai valensi +3 dan oksigen -2, oleh sebab itu anion mempunyai beban negatif global tunggal.
Nitrite Anion no2- Ia mempunyai struktur sudut, iaitu, ikatan nitrogen (n) dengan atom oksigen (O) membentuk sudut.
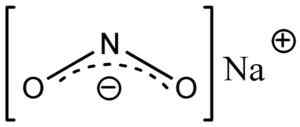 Struktur nitrit nano nano2, di mana anda dapat melihat bentuk sudut anion nitrit tidak2-. Eschenmoser [domain awam]. Sumber: Wikimedia Commons.
Struktur nitrit nano nano2, di mana anda dapat melihat bentuk sudut anion nitrit tidak2-. Eschenmoser [domain awam]. Sumber: Wikimedia Commons. Nomenclature
- Natrium nitrit
- Natrium nitrit
- Garam natrium asid nitrous.
Sifat
Keadaan fizikal
Pepejal kristal putih kekuningan. Kristal Ortorrombic.
Berat molekul
68,995 g/mol
Takat lebur
271 ºC
Takat didih
Jangan mendidih. Ia terurai melebihi 320 ºC
Ia boleh melayani anda: Magnesium Hidrida: Struktur, Hartanah dan KegunaanKetumpatan
2.17 g/cm3 pada 20 ºC
Kelarutan
Air larut: 84.8 g/100 g air pada 25 ºC. Sedikit larut dalam etanol. Larut sederhana dalam metanol. Hampir tidak larut dalam eter deety.
Ph
Penyelesaian berairnya adalah alkali, pH kira -kira 9. Ini kerana asid nitrous adalah asid lemah yang cenderung untuk tidak memisahkan, jadi ion tidak2- Cuba ambil proton h+ Air untuk membentuk hno2, yang membawa kepada pembentukan oh ion- Mereka menghasilkan kealkalian.
Tidak2- + H2O → hno2 + Oh-
Sifat lain
Nano natrium nitrit2 Di hadapan udara perlahan -lahan mengoksidakan nitrat nitrat3. Ia adalah pepejal hygroscopic, kerana ia menyerap air dari persekitaran.
Ia mempunyai sifat pengoksidaan (ia dapat mengoksidakan sebatian lain) dan juga pengurangan (ia boleh dioksidakan oleh sebatian lain).
Sekiranya anda bersentuhan dengan bahan seperti kayu, kertas atau tekstil, anda boleh membuatnya masuk ke dalam pembakaran dengan bahaya.
Dengan asid penguraiannya berlaku, menghasilkan campuran gas toksik nitrogen oksida (tidakx).
Memperoleh
Ia boleh diperoleh dengan pemanasan nano nitrat3 Dengan PB plumbum:
Abang3 + PB → Nano2 + Pbo
Kehadiran dalam organisma
Anion nitrit secara semulajadi hadir dalam darah dan tisu, kerana ia dibentuk sebagai akibat daripada pengoksidaan bukan -.
Aplikasi
Dalam industri makanan
Ia digunakan untuk adobar daging kerana ia bertindak sebagai ejen pengekalan warna dan rasa, dan sebagai pengawet kerana ia mengawal pertumbuhan mikroorganisma, mengelakkan perkembangan perkembangan perkembangan pembangunan Clostridium botulinum Menyebabkan penyakit botulisme.
Natrium nitrit dalam daging bertindak balas dengan hemoglobin sel darah merah atau sel darah merah makanan ini. Ia juga digunakan dalam ikan asap sembuh.
 Ikan salai. Pengarang: Reinhard Thrainer. Sumber: Pixabay.
Ikan salai. Pengarang: Reinhard Thrainer. Sumber: Pixabay. Sebagai rawatan kecemasan dalam keracunan sianida
Natrium nitrit digunakan untuk rawatan keracunan sianida akut. Ia adalah penawar untuk masalah serius ini.
Boleh melayani anda: Acetonitrile (C2H3N)Tindakannya adalah disebabkan oleh fakta bahawa ia memihak kepada pembentukan methemoglobin (sejenis hemoglobin) dalam darah, yang menangkap ion sianida dan tidak melepaskannya, dan dengan itu menghalang mereka daripada dibebaskan dalam sel, menjadikannya kurang toksik.
Sekiranya keracunan sianida, natrium nitrit digunakan secara intravena, mengambil masa kira -kira 12 minit untuk menghasilkan methemoglobin. Walaupun kelewatan ini, ia juga menawarkan perlindungan untuk kesan vasodilatornya.
 Rawatan intravena. Michaelberry di Wikipedia Inggeris [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]. Sumber: Wikimedia Commons.
Rawatan intravena. Michaelberry di Wikipedia Inggeris [CC oleh 3.0 (https: // creativeCommons.Org/lesen/oleh/3.0)]. Sumber: Wikimedia Commons. Untuk peleburan saluran darah
Ia berfungsi untuk merawat hipertensi arteri pulmonari kerana ia bertindak dengan melambatkan saluran darah sehingga menurunkan tekanan darah. Dianggarkan bahawa kesan ini disebabkan oleh fakta bahawa ia berubah menjadi nitrik oksida bukan yang bertindak melegakan otot lembut.
Walau bagaimanapun, punca keberkesanannya masih dalam kajian.
Terhadap beberapa parasit
Penyelidik tertentu mendapati bahawa natrium nitrit menghalang pertumbuhan dan pendaraban parasit usus Blastocystis Hominis Walaupun ini tahan terhadap ubat lain.
Didapati bahawa nano2 Ia menghasilkan kematian parasit ini oleh apoptosis, yang merupakan sejenis bunuh diri sel parasit. Natrium nitrit menyebabkan sel usus menghasilkan NO, yang nampaknya penting dalam proses ini.
Untuk mengelakkan kerosakan organ
Menurut beberapa kajian, nitrit adalah perencat yang kuat terhadap kerosakan jantung dan hati dalam proses iskemia (penurunan pengairan darah di bahagian badan). Dipercayai bahawa ini adalah kerana ia adalah rizab biologi tidak.
Disimpulkan bahawa ia boleh digunakan untuk mengelakkan kerosakan pada organ selepas memulihkan aliran darah yang telah terganggu oleh serangan jantung, intervensi pembedahan perut tinggi atau pemindahan sesetengah organ.
Untuk mengelakkan jangkitan untuk penggunaan kanta lekap
Telah didapati bahawa nano2 menghalang pembentukan filem mikroorganisma patogen Staphylococcus aureus dan Pseudomonas aeruginosa Mengenai kanta sentuh.
Boleh melayani anda: pengurangan (kimia) Kanta kenalan boleh tercemar dengan bakteria atau kulat. Fotografi kanta kenalan pada 7 Januari 2006. Sumber: Fotografi oleh BPW. Sumber: Wikimedia Commons.
Kanta kenalan boleh tercemar dengan bakteria atau kulat. Fotografi kanta kenalan pada 7 Januari 2006. Sumber: Fotografi oleh BPW. Sumber: Wikimedia Commons. Dalam beberapa kegunaan
Natrium Nitrite digunakan untuk mengeluarkan pewarna, ubat dan pelbagai sebatian organik.
Ia juga berfungsi sebagai perencat kakisan dalam pelbagai lemak.
Risiko atau kesulitan
Salah satu masalah menggunakan natrium nitrit untuk keracunan sianida ialah menyebabkan gangguan kardiovaskular yang serius pada kanak -kanak.
Ia tidak disyorkan untuk mangsa kebakaran di mana pendedahan serentak kedua -dua sianida dan karbon monoksida (CO) berlaku (CO). CO mengurangkan keupayaan darah untuk mengangkut oksigen, jadi pentadbiran nano2 akan memburukkan keadaan oksigen kecil dalam darah pesakit.
Nitrit natrium yang disedut adalah menjengkelkan dan toksik, ia boleh merosakkan sistem kardiovaskular dan sistem saraf pusat. Di samping itu, dia memudaratkan alam sekitar.
Natrium nitrit yang ditelan dengan makanan boleh berbahaya. Nitrit, apabila mencapai perut, bertindak balas dengan sebatian tertentu yang membentuk nitrosamines, yang dapat menghasilkan kanser.
Reaksi ini dapat dielakkan dengan kehadiran vitamin C.
Menurut sumber tertentu yang dirujuk, risiko memakan nitrit dengan daging atau ikan yang sembuh adalah minimum kerana nitrit secara semulajadi hadir dalam air liur.
Sumber menunjukkan bahawa risiko ini juga minimum berbanding dengan manfaat besar memakan makanan yang bebas daripada mikroorganisma yang berbahaya.
Rujukan
- Bhattacharya, r. dan Flora, s.J.S. (2015). Ketoksikan sianida dan rawatannya. Dalam Buku Panduan Toksikologi Ejen Peperangan Kimia (edisi kedua). Pulih dari Scientedirect.com.
- Atau.S. Perpustakaan Perubatan Negara. (2019). Natrium nitrit. Pulih dari: pubchem.NCBI.NLM.NIH.Gov.
- Kim, d.J. et al. (2017). Keberkesanan antibiofilm oksida nitrik pada lensa hubungan lembut. BMC Ophthalmol 17, 206 (2017). Diperolehi daripada Bmcophthalmol.Biomedcentral.com.
- Ramis-Ramos, g. (2003). Antioksidan. Antioksidan sintetik. Dalam Ensiklopedia Sains Makanan dan Pemakanan (Edisi Kedua). Pulih dari Scientedirect.
- Barozzi Seabra, a. dan Durán, n. (2017). Penderma oksida nitrat untuk merawat penyakit yang diabaikan. Dalam penderma oksida nitrat. Pulih dari Scientedirect.com.
- Duranski, m.R. et al. (2005). Kesan sitoprotektif nitrit semasa dalam vivo ischemia-reperfusion jantung dan hati. J Clin Invest 2005; 115 (5): 1232-1240. NCBI pulih.NLM.NIH.Gov.
- Kapas, f. Albert dan Wilkinson, Geoffrey. (1980). Kimia bukan organik maju. Edisi keempat. John Wiley & Sons.

