Sifat nitrit, struktur, tatanama, latihan
- 2782
- 174
- Ms. Santos Fritsch
The nitrit Semuanya adalah sebatian yang mengandungi anion tidak2-, Sekiranya mereka tidak organik, atau kumpulan -ono, jika mereka organik. Majoriti adalah nitrit logam, yang merupakan garam bukan organik di mana tidak2- berinteraksi secara elektrostatik dengan Cation Cn+; Contohnya, natrium kation, na+.
Oleh itu, natrium nitrit, nano2, Ia adalah contoh garam atau sebatian nitrit. Garam ini terdapat di alam semula jadi, sama ada di tanah, laut, mamalia dan tisu tumbuhan, kerana ia adalah sebahagian daripada kitaran biologi nitrogen. Oleh itu, tidak2- Ia adalah bahan yang terdapat dalam organisma kita, dan dikaitkan dengan proses vasodilator.
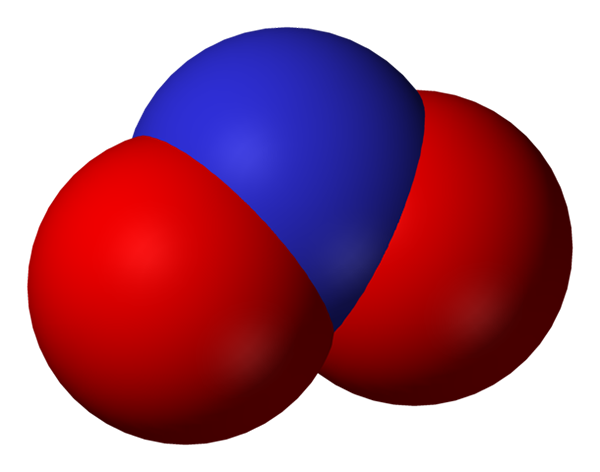
 Ruang yang penuh dengan anion nitrit. Sumber: Benjah-bmm27.
Ruang yang penuh dengan anion nitrit. Sumber: Benjah-bmm27. Nitrit menjadi bentuk nitrogen yang lebih kecil, atau kurang teroksida, daripada nitrat, tidak3-. Oksida nitrik berlaku daripadanya, tidak di kawasan organisma di mana terdapat kekurangan oksigen. Dia bukan molekul isyarat yang menimbulkan kesan vasodilator oleh otot dan arteri yang santai.
Daripada biokimia dan perubatan, nitrit digunakan sebagai bakteria, sebagai pengagregatan mereka kepada daging yang biasa. Ini dengan tujuan menyembuhkan mereka dan memperluas kualiti dan kesegaran mereka lebih lama.
Nitrit mempunyai dua muka: satu memberi manfaat kepada kesihatan, dan satu lagi yang meletakkannya dalam bahaya. Wajah yang baik adalah tepat disebabkan oleh tindak balas yang mengurangkannya kepada tidak. Sementara itu, wajah buruk disebabkan oleh transformasinya kepada nitrosamine: keluarga sebatian organik yang mempunyai beberapa ahli yang telah diiktiraf sebagai bahan karsinogenik.
[TOC]
Sifat nitrit
Asas
Nitrit adalah garam asas, kerana anion tidak2- Ia adalah asas konjugasi asid nitrous, hno2:
Hno2 + H2Atau ⇌ Tidak2- + H3Sama ada+
Di dalam air dan dalam beberapa kuantiti ia dihidrolisiskan untuk berasal dari ion OH-:
Tidak2- + H2Atau ⇌ hno2 + Oh-
Asas ini intrinsik untuk semua garam nitrit, kerana ia bergantung pada tidak2- dan bukannya kation yang menemani dia. Walau bagaimanapun, kation ini dan interaksi mereka dengan tidak2- Mereka mempengaruhi kelarutan garam nitrit di dalam air dan pelarut kutub yang lain.
Reaksi
Reaksi nitrit berbeza -beza bergantung kepada kation yang menemani tidak2-, atau sama ada ia adalah nitrit organik, Rono. Secara umum, nitrit boleh mengurai, mengoksidakan atau mengurangkan kepada: oksida logam, tidak3-, Tidak2, Tidak, dan juga gas nitrogen, n2.
Boleh melayani anda: proses termodinamikSebagai contoh, ammonium nitrite, NH4Tidak2 boleh terurai ke n2 dan h2Sama ada.
Penampilan fizikal
Hampir semua nitrit adalah pepejal penampilan kristal. Banyak warna putih atau kekuningan, walaupun terdapat berwarna -warni jika mereka mengandungi kation logam peralihan.
Sebaliknya, kebanyakan nitrit organik adalah cecair yang tidak stabil dan letupan yang tidak stabil.
Struktur
Anion nitrit
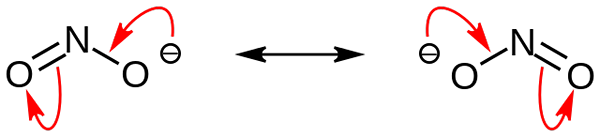 Struktur resonans anion nitrite. Sumber: Domain Nohingserius / Pub
Struktur resonans anion nitrite. Sumber: Domain Nohingserius / Pub Dalam imej pertama anion nitrit ditunjukkan dengan model ruang penuh. Model ini mempunyai kelemahan yang sama seperti nitrogen dioksida, tidak2. Sebaliknya, imej unggul menggambarkan anion nitrit lebih baik dan bagaimana beban negatifnya berkelakuan.
Beban ini dipindahkan antara dua atom oksigen, jadi masing-masing mempunyai separuh beban negatif (-1/2). Dan ini adalah beban negatif yang bertanggungjawab untuk menarik kation sekitar kerana tarikan elektrostatik yang mudah.
Pepejal
Nitrit bukan organik adalah semua sebatian pepejal kristal. Interaksinya semata -mata elektrostatik, mempunyai tarikan antara no2- dan kation mn+. Oleh itu, sebagai contoh, nano2 Ia mempunyai struktur kristal ortorrombik, dan dibentuk oleh ion na+ dan tidak2-.
Jenis struktur kristal akan bergantung kepada identiti m+n, Jadi tidak semua nitrit berkongsi struktur ortorrombik.
Nitrit organik
Nitrit organik, tidak seperti yang tidak organik, bukan sebatian ionik tetapi kovalen. Oleh itu, mereka terbentuk daripada molekul, yang dicirikan dengan mempunyai pautan R-aon, di mana R boleh menjadi kumpulan alkil atau aromatik.
Mereka dianggap ester asid nitrous, kerana hidrogen mereka, H-Don, digantikan oleh kumpulan R:
 Formula Umum untuk Nitrit Organik. Sumber: PNGBOT melalui Wikipedia.
Formula Umum untuk Nitrit Organik. Sumber: PNGBOT melalui Wikipedia. Menurut imej unggul, ester ini boleh ditulis sebagai rum = o, sangat mirip dengan formula ester karbon, roc = o. Perhatikan persamaan hebat bahawa struktur ini mempunyai dengan sebatian nitro, RNO2, di mana sekarang pautan utama adalah r-no2 dan bukan r-dono. Oleh itu, perbezaannya terletak pada atom yang mana ia bergabung2 kepada kumpulan r.
Oleh sebab itu, ester nitrit dan sebatian nitro dianggap sebagai isomer pautan, kerana mereka mempunyai atom yang sama, tetapi dikaitkan dengan cara yang berbeza.
Kompleks
Kompleks nitrit boleh mempunyai komponen bukan organik dan organik. Mereka membentuk hubungan koordinasi antara pusat logam dan salah satu oksigen2-. Iaitu, tidak ada perbincangan mengenai interaksi elektrostatik semata -mata, mn+Tidak2-, tetapi koordinasi mn+-ATAU TIDAK-.
Boleh melayani anda: apakah sifat fizikal perkara?Nitrit organik dan kompleks mereka akan menubuhkan atau tidak struktur kristal bergantung kepada sama ada interaksi mereka berjaya menetapkan zarah mereka di ruang angkasa.
Nomenclature
Nitrit bukan organik dan organik berkongsi tatanama yang sangat mudah. Untuk menamakannya, perkataan 'nitrite', diikuti dengan nama logam dan valensi yang ditulis dalam kurungan diletakkan terlebih dahulu. Begitu juga, pengakhiran -co dan -Jadi sekiranya terdapat lebih daripada satu Valencia boleh digunakan.
Contohnya, cuno2 boleh dinamakan dalam dua cara: nitrit tembaga (i), atau nitrit cuprous.
Peraturan tatanama ini juga terpakai kepada nitrit organik. Contohnya, CHO3Ono dipanggil methilo nitrito, kerana ch3 sepadan dengan kumpulan r yang dikaitkan dengan oksigen tiada2.
Tatanama boleh menjadi rumit jika terdapat kumpulan lain yang sama atau lebih relevan kimia daripada tidak2, atau jika mereka adalah kompleks logam.
Latihan
Nitrifikasi
Banyak nitrit bukan organik terbentuk dalam salah satu langkah kitaran nitrogen: nitrifikasi. Proses ini terdiri daripada pengoksidaan ammonia yang dijalankan oleh mikroorganisma, khususnya, oleh bakteria Nitrosomonas.
Nitrifikasi juga meliputi pengoksidaan berikutnya nitrat ke nitrat; Walau bagaimanapun, pembentukan nitrit adalah langkah perlahan tindak balas ini, kerana ia memerlukan tenaga yang lebih besar dan mesti mengatasi halangan kinetik yang lebih besar.
Persamaan berikut mencontohkan yang baru terdedah:
2nh4+ + Ke -32 → 2no2- + 4H+ + 2h2Sama ada
Beberapa enzim mengambil bahagian dalam tindak balas ini dan hidrokslamine dihasilkan, NH2Oh, yang merupakan produk dari mana anion nitrit akhirnya akan berasal.
Terima kasih kepada nitrifikasi bahawa tumbuh -tumbuhan mengandungi nitrit, dan pada gilirannya, haiwan yang memakannya. Nitrit tidak hanya ada di dalam tanah, tetapi juga di lautan, dan hampir semua pengeluaran semulajadi mereka disebabkan oleh tindakan oksidatif dan anaerobik pelbagai mikroorganisma.
Oksida nitrogen dalam media asas
Nitrit logam alkali boleh disediakan secara industri dengan bubbing nitrogen oksida dalam penyelesaian asas atau media, sama ada dari hidroksida atau karbonat masing -masing. Sebagai contoh, natrium nitrit berlaku mengikut tindak balas berikut:
Tidak +tidak2 + NaOH → 2nano2 + H2Sama ada
Dalam kes ammonium nitrit, dyitrogen trioksida bubbled dalam ammonia:
Boleh melayani anda: rodio: sejarah, sifat, struktur, kegunaan, risiko2nh3 + H2Atau +n2Sama ada3 → 2nh4Tidak2
Tindak balas dengan oksida nitrik
Alquilico Nitrites, Rono, boleh disintesis oleh React. Reaksi umum adalah seperti berikut:
R-OH → R-aon
Permohonan Nitrit
Menyembuhkan daging
 Warna daging kemerahan adalah disebabkan oleh penyembuhannya dengan garam nitrat dan nitrat. Sumber: Pxhere.
Warna daging kemerahan adalah disebabkan oleh penyembuhannya dengan garam nitrat dan nitrat. Sumber: Pxhere. Nitrit mempunyai kesan antibakteria, jadi ia ditambah dalam kuantiti sederhana untuk daging untuk melambatkan reput mereka. Di samping memenuhi fungsi ini, mereka bertindak balas dengan protein daging untuk memberi mereka warna yang lebih kemerahan dan menarik.
Bahagian buruk amalan ini adalah bahawa sesetengah daging boleh mempunyai terlalu banyak garam nitrit, dan ketika memasaknya pada suhu tinggi, mereka berubah menjadi nitrosoaminas. Oleh itu, terdapat risiko meningkatkan peluang untuk mengontrak beberapa jenis kanser jika penggunaan daging sembuh ini berlebihan.
Pewarna Rod
Nitrit digunakan dalam kimia organik untuk menjalankan tindak balas diazotasi, yang mana pewarna atau pewarna disintesis.
Pigmen
Beberapa kompleks nitrit, seperti kobalt, boleh digunakan sebagai pigmen untuk lukisan atau porselin kerana warna yang menarik.
Vasodilator
Nitrit bertanggungjawab untuk menjana oksida nitrik di dalam badan di kawasan oksigen kekurangan. Dia bukan molekul isyarat, yang bertindak balas terhadap saluran darah yang santai dan berkembang. Pengembangan atau peleburan ini akibatnya tekanan darah menurun.
Contoh nitrit
Akhirnya, beberapa contoh nitrit akan disenaraikan dengan formula dan nama masing -masing:
-Abang2: natrium nitrit
-Kno2: Potassium nitrite
-Mg (no2)2: Magnesium nitrite
-Spout2)2: Kalsium nitrit
-Ch3Ch2Ono: etil nitrit
-NH4Tidak2: Ammonium nitrite
-Zn (no2)2: zink nitrite
-PB (tidak2)2: Memimpin nitrit (ii) atau nitrit plumbose
-Iman (tidak2)3: Nitrit besi (iii) atau nitrit ferrik
-(Ch3)2Chch2Ch2Ono: Isoamilo Nitrito
Rujukan
- Shiver & Atkins. (2008). Kimia bukan organik. (Edisi Keempat). MC Graw Hill.
- Carey f. (2008). Kimia organik. (Edisi keenam). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Kimia organik. (Edisi ke -10.). Wiley Plus.
- Wikipedia. (2020). Nitrit. Diperoleh dari: dalam.Wikipedia.org
- Elsevier b.V. (2020). Nitrit. Scientedirect. Diperoleh dari: Scientedirect.com
- Alfa Aesar. (2020). Garam nitrit. Themo Fisher Scientific. Pulih dari: alfa.com
- Editor enyclopaedia Britannica. (23 Februari 2018). Nitrit. Encyclopædia Britannica. Pulih dari: Britannica.com
- Anthony r. Butler & Martin Feelisch. (22 April 2018). Penggunaan terapeutik nitrit bukan organik dan nitrat. doi.org/10.1161/Circulationaha.107.753814
- Kris Gunnars. (10 Februari 2020). Adakah nitrat dan nitrit dalam makanan berbahaya? Pulih dari: kesihatan.com

